海洋酸化与磷浓度变化对龙须菜光合作用和ATPase活性的影响
2021-04-12卫燕云金鹏江莹莹夏建荣
卫燕云, 金鹏, 江莹莹 , 夏建荣, *
海洋酸化与磷浓度变化对龙须菜光合作用和ATPase活性的影响
卫燕云1, 金鹏2, 江莹莹2, 夏建荣2, *
1. 广州大学生命科学学院, 广州 510006 2. 广州大学环境科学与工程学院, 广州 510006
以大型海藻龙须菜()为实验材料, 设置不同CO2浓度(400μL·L–1和1000μL·L–1)和磷浓度(0.5和30 μmol·L-1)实验, 探讨大气CO2浓度升高对不同磷浓度培养下龙须菜生长、光合作用及ATPase活性的影响。结果显示大气CO2下, 磷加富导致龙须菜的相对生长速率和最大光合速率增加, 暗呼吸速率降低; 但高CO2浓度下, 磷浓度变化对三者的影响不明显。不论是在大气CO2浓度还是高浓度CO2下, 磷加富对叶绿素a、类胡萝卜素含量和实际光化学效率均没有明显影响, 但导致ATPase活性均明显增加。以上结果表明在高浓度CO2诱导海洋酸化环境中, 磷加富可以通过调节光合速率、暗呼吸速率和ATPase活性, 改变能量的利用效率调控其生长。
龙须菜; 二氧化碳; 生长; 光合作用; ATPase活性
0 前言
随现代工业化发展, 大气中CO2的浓度正不断升高, 据IPCC预测, 到21世纪末, 大气CO2浓度将升高到1000 ppm[1]。大气中CO2浓度升高, 导致海洋酸化, 据估计至本世纪末, 海洋表层海水的pH将继续下降0.3—0.4个单位[2]。藻类是海洋中的初级生产力的主要贡献者, 在全球碳循环中起着非常重要的作用, 它们对大气CO2浓度升高的响应已经引起广泛关注。大气CO2浓度升高对大型藻类的影响会呈现种间异质性[3]。CO2加富导致的海洋酸化可降低部分大型海藻石莼()和龙须菜(.)的光合作用[4], 但对另外一些种类的大型海藻, 无明显影响或表现为正面促进[5-6],如江篱属的[7]。
大气CO2升高导致全球升温, 增强海水分层、减低海洋混合层深度, 削弱从深海向表层海水的营养盐补充, 从而导致海洋表层水体中营养盐浓度(如磷浓度)降低[8-9]。同时近海水域受纳的工、农业及生活废水增加, 以及水产养殖业的污染日益严重, 海水中磷等营养盐含量大幅度增加[10-11]。磷是大型海藻生长的必需的大量元素, 其存在于细胞的磷脂、核酸和核蛋白中。磷脂是生物体细胞质, 生物膜和很多酶的重要组成成分, 在生物的能量传递和新陈代谢中起着关键作用[12]。大型海藻在生长过程中通过吸收氮磷, 同化成自身需要的营养成分, 在近海碳循环中发挥着重要的作用。当氮磷营养盐浓度较高时, 大型海藻具有储存大量营养盐的能力, 因此大型海藻是海洋生态系统中重要的氮库和磷库。研究表明, 海水中磷浓度加富, 对海藻光合磷酸化过程有明显的促进作用, 最终刺激海藻的生长。海水无机磷浓度升高导致了海藻的生长和丰度增加[13]。高磷水平下, 海藻对磷的吸收速率、光合作用和色素含量都明显的升高[12]。面对海洋酸化和富营养化, 大型海藻如何响应已越来越受到人们的关注。徐智广等探讨了不同 CO2浓度和磷水平对龙须菜的影响, 发现CO2加富会刺激龙须菜对磷的吸收, 同时磷浓度也能调节不同CO2浓度培养下龙须菜无机碳的利用[14], 但未涉及CO2加富和磷对龙须菜ATPase活性影响报道。本研究将在已有基础上探究CO2加富和磷浓度对龙须菜ATPase活性影响。龙须菜()隶属于红藻门江蓠属江蓠科, 生长快, 产量高, 其细胞壁富含琼胶且质量较好, 是中国近岸重要的经济海藻[15]。
本文利用龙须菜作为实验材料, 分析不同CO2浓度与不同磷营养条件下龙须菜藻体的相对生长速率、光合作用、藻体内可溶性蛋白质、色素含量及ATP酶活等生理生化指标的变化, 探讨了磷浓度变化可能影响海洋酸化对龙须菜的效应(包括ATP酶活性等), 旨在为未来海洋酸化环境中大型海藻的养殖提供理论依据。
1 材料与方法
1.1 实验材料
本实验所用龙须菜()于2018年7月采于广东南澳岛近海筏式养殖区采取, 于低温条件运至实验室, 用过滤的自然营养加富海水(pH=8.2, 盐度为33, NO3-N: 10 μmol·L-1, PO43-P: 0.5 μmol·L-1), 通过滤空气, 暂养3 d, 暂养条件为: 温度20℃; 光照强度100 μmol photos ·m-2·s-1; 光暗周期为12 h: 12 h。选取生长状况较一致的个体作为正式实验材料。
将实验材料置于装有2 L培养液的锥形瓶中, 培养密度为0.4 gFW·L-1。实验设置四个处理: 两种不同CO2浓度(LC=400 μL·L-1和HC=1000 μL·L-1)和磷浓度(LP=0.5 μmol·L-1和HP=30 μmol·L-1NaH2PO4), CO2浓度通过CO2加富器(CE100D-3A; 武汉瑞华仪器设备有限责任公司; 武汉, 中国)来控制。光温条件同暂养条件。每组设置三个重复, 通过通入不同CO2浓度空气调控培养液中pH值分别为8.20±0.05和7.80±0.05, 每两天更换一次培养海水, 培养7d后进行龙须菜进行各项生理指标的测定。
1.2 测定项目
1.2.1 相对生长速率(RGR)
分别测定实验开始时藻体的鲜重(W0)和培养结束鲜重(Wt), 通过下列公式计算期间的相对生长速率(RGR):
RGR(% day-1)=ln(Wt/W0)/t ×100%
其中, W0为藻体初始重量(FW), Wt为实验中第t天的藻体鲜重(FW)。
1.2.2 色素含量测定
叶绿素a(Chla)的测定计算参照Ritchie等[16]的方法, 类胡萝卜素(Car)含量的测定参考Stickland[17], 用丙酮研磨一定鲜重的藻体, 定容, 离心, 取上清液测量其在波长480 nm、510 nm、647 nm、664 nm和750 nm处的吸光值。通过如下公式计算色素含量:
Chla=12.25×(A664-A750)-2.55×(A647-A750)
Car=7.6×(A480-A750)-1.49×(A510-A750)
1.2.3 可溶性蛋白含量(SP)的测定
采用考马斯亮G-250染料结合法。取0.05 g藻体用0.1 mol·L-1的磷酸缓冲液(pH=6.8)研磨, 定容, 离心, 取0.5 mL上清液加5 mL考马斯亮蓝G-250, 混匀后595 nm测定其吸光度。其计算公式为:
SP=C×V1/V2×W×1000
式中: C为查得的牛血清标准曲线值(μg); V2为提取液总体积(mL); W为样品鲜重(g); V1为测定时的加样量(mL)。
1.2.4 P-I曲线测定
称取鲜重0.05 g龙须菜放入存有5mL自然营养加富海水的反应杯中。在20℃下, 用氧电极(YSI Model 5300, Yellow Springs, OH, USA)测定反应杯中氧浓度的变化。光源由碘钨灯提供, 不同光强(0-800 μmol photons·m-2·s-1)通过调节反应杯与光源之间的距离获得, 光强用光量子测定仪(MQ-500, Apogee, UK)测定。
P-I曲线的参数值通过拟合曲线获得, 光合效率(α)为P-I曲线在低光时的初始斜率, 光补偿点(Ic)和光饱和点(Ik)通过Rd/α和Pm/α计算(Henley 1993),

式中Rd为暗呼吸速率, Pm为饱和光下的最大光合放氧速率。
1.2.5 叶绿素荧光参数测定
通过便携式调制叶绿素荧光仪(PAM-2100, Heinz Walz GmbH, Germany)测定叶绿素荧光参数。弱测量光和光化光分别为0.01和100 µmol photons·m-2·s-1,饱和脉冲光为 5000 µmol photons ·m-2·s-1持续0.8 s。PSII的实际光能转化效率(Yield)[18-19]通过以下公式计算:
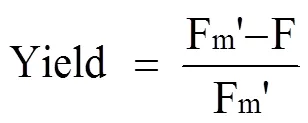
Fm'为光化光的最大荧光产量稳定水平; F为激发状态下的实时荧光。
1.2.6 ATP酶活性测定
取培养后藻体0.05 g于STN(蔗糖-Tricine-NaCl溶液)缓冲液中研磨过滤, 加入激活液(0.25 mol·L-1Tris-HCl, pH=8.0, 0.5mol·L-1NaCl, 0.05 mol·L-1MgCl2, 50 mmol·L-1DTT, 0.5 mmol·L-1PMS)于室温在白炽光50000 Lx下进行光激活6 min。再加入0.5 mL的反应液(0.5 mol·L-1Tris-HCl, pH=8.0, 0.05 mol·L-1MgCl2, 50 mmol·L-1ATP), 置于37℃水浴中(冰浴作空白)保温10 min, 各加入0.1 mL20%的三氯乙酸停止反应, 离心后各取上清液测定ATP水解后的无机磷浓度[20]。酶活性用每毫克每分钟蛋白质分解ATP释放无机磷的含量来表示[ μmol Pi (mg Pro.min)-1]。
单位时间内叶绿素的ATP酶活力= C × VT×1000/(Vs × t × W)
式中: C为标准曲线上查得的无机磷含量, μmol/L; VT为反应体积, ml; W为可溶性蛋白的质量浓度, mg/ml; Vs为测定时取用体积, ml; t为反应时间, min。
1.2.7 统计分析
所有实验的测定结果表示为平均值±标准差(n=3), 不同CO2浓度培养下磷的效应用t-检验进行统计显著性分析, 以P<0.05作为差异的显著性水平, 数据图中不同字母表示有显著差异。
2 结果
2.1 不同CO2浓度和P浓度对龙须菜生长的影响
图1为不同CO2浓度和磷浓度培养下龙须菜的相对生长速率。在大气CO2浓度培养下, 与低磷浓度培养相比, 高磷浓度培养的龙须菜其生长速率明显加快, 其相对生长速率增加了17.84%(P<0.05, P=0.029); 但在高CO2浓度下, 两种磷浓度培养下龙须菜的相对生长速率无显著差异(P>0.05, P=0.30)。可见高浓度CO2培养抑制了磷对生长的促进效应。

注: 不同小写字母表示具有显著性差异(P<0.05)。
Figure1 Relative growth rate ofgrown under different CO2and P concentrations. The different letters have a significant effect onat the same CO2concentration (< 0.05)(LC:ambient CO2level; HC:elevated CO2level; LP: low P concentration; HP: increased P concentration)
2.2 CO2浓度和P浓度对藻体色素含量的影响
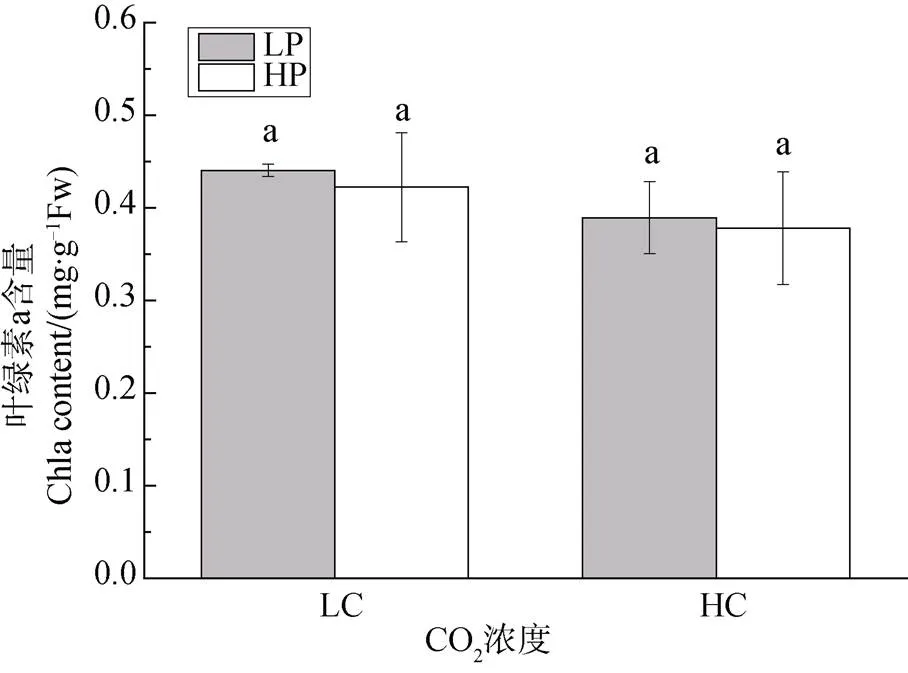
不同CO2和磷浓度培养下龙须菜的叶绿素a (Chla)含量变化如图2所示。结果显示, 不论是在大气CO2浓度还是高CO2浓度下, 磷浓度对龙须菜叶绿素a含量均无显著影响(P>0.05)。与Chla含量趋势一致, 两种CO2浓度下, 磷浓度升高对龙须菜的类胡萝卜素(Car)含量均无显著影响(P>0.05) (图3)。可见, CO2浓度升高并没有改变磷对色素的影响效应。
2.3 CO2浓度和P浓度对藻体中可溶性蛋白含量的影响
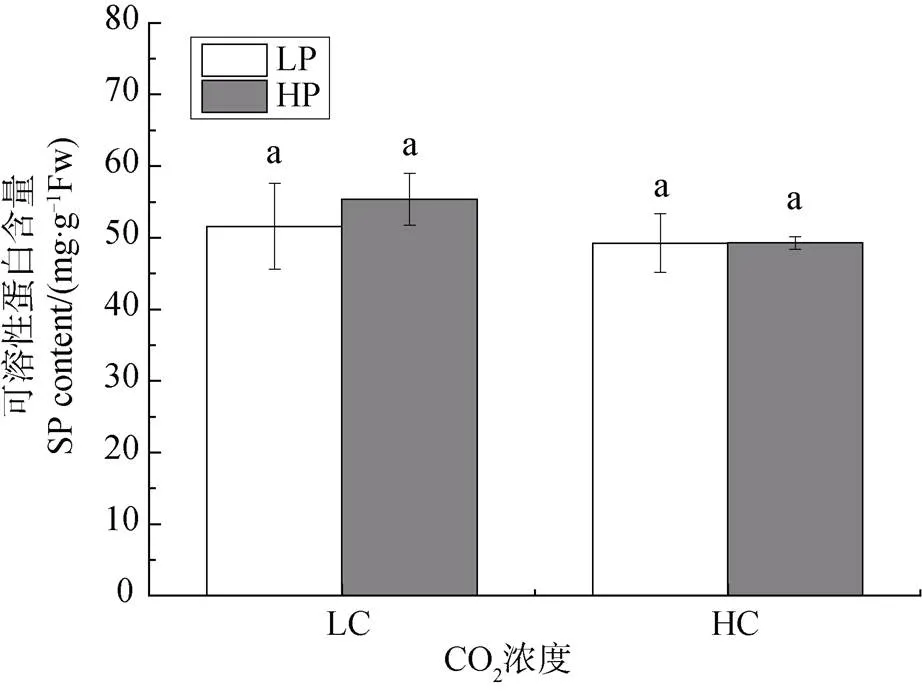
不同CO2浓度和磷浓度培养对龙须菜藻体中可溶性蛋白的含量影响如图4所示, 在大气CO2浓度培养时, 低磷浓度和高磷浓度下可溶性蛋白含量分别为51.59±6.00和55.363±6.1mg·g-1FW; 高CO2浓度下, 分别为49.23±4.10和49.260±8.9 mg·g-1FW, 可见在不同CO2浓度培养下, 磷浓度变化均没有对可溶性蛋白含量产生显著影响(P>0.05)。
注: 不同小写字母表示具有显著性差异(P<0.05)。
Figure 2 The change of Chlcontent incultured under different CO2and P concentrations

注: 不同小写字母表示具有显著性差异(P<0.05)。
Figure 3 Effects of different CO2and P concentrations on Car content of
2.4 不同培养条件对龙须菜光合作用光响应曲线(P-I 曲线)的影响
不同CO2和磷浓度培养下龙须菜的P-I曲线如图5所示, 在大气CO2浓度条件下, 与低磷浓度培养相比, 高磷浓度培养下Pm、和Ik明显增加(P<0.05), 分别增加28.01%和35.56%, 而Rd降低33.77% (P<0.05), 但对α和Ic没有明显影响(P>0.05)。但在高CO2浓度培养下, 磷浓度变化对Pm、Rd、α、Ic和Ik没有显著影响(P>0.05)。因此, CO2浓度升高, 降低了龙须菜光合作用对磷浓度的敏感性。
2.5 不同CO2和磷浓度培养条件对叶绿素荧光参数Yield的影响
图6表示不同CO2浓度和磷浓度培养下龙须菜实际光化学效率的变化。从图中可以看出, 不论是在大气CO2浓度还是高浓度CO2培养下, 磷浓度变化均没有明显影响实际光化学效率(P>0.05)。
2.6 不同CO2和P培养条件对龙须菜的ATPase活性影响
不同CO2和磷浓度培养的龙须菜藻体ATPase活性情况如图7所示。培养期间无论是在低CO2浓度还是在高CO2浓度下, 龙须菜的ATPase活性均随着环境中磷浓度的增加而增强。随着磷的加富, ATPase活性分别提升了13.89%和18.11%(P<0.05)。
注: 不同小写字母表示具有显著性差异(P<0.05)。
Figure 4 The changes of soluble protein ingrown under different CO2and P concentrations
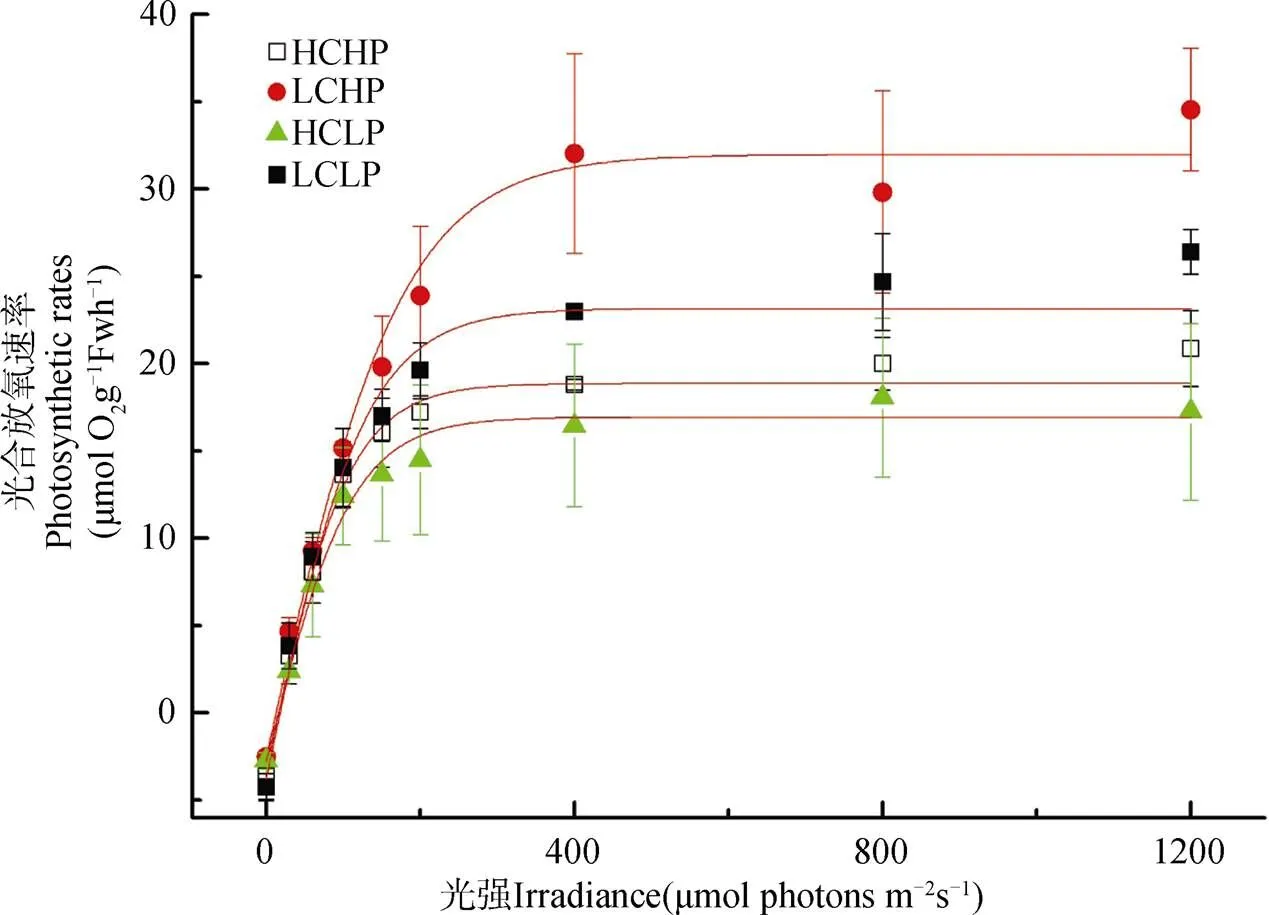
图5 在不同条件培养下的龙须菜的P-I曲线
Figure 5 P-I curves ingrown under different CO2and P concentration.
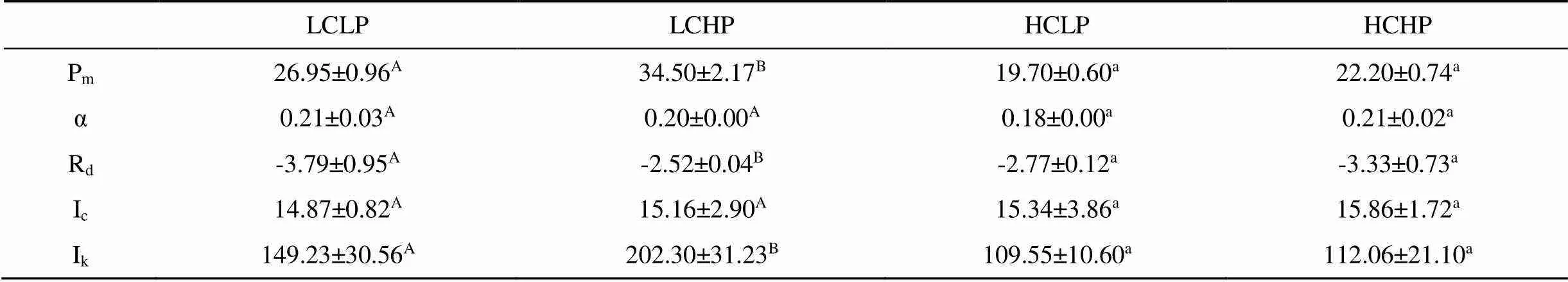
表1 在不同CO2和P浓度培养下龙须菜的 P-I 曲线参数
注: 表中同行不同字母表示不同处理间差异呈显著水平(<0.05)。
最大光合速率Pm: μmol O2·g-1Fw·h-1; 光合效率α: ( μmol O2·g-1Fw·h-1) /(μmol photons·m-2·s-1); 暗呼吸速率Rd:μmol O2·g-1Fw·h-1; 光补偿点Ic: μmol photons·m-2·s-1; 光饱和点Ik: μmol photons·m-2·s-1

注: 不同小写字母表示具有显著性差异(P<0.05)
Figure 6 The changes of Yield ofgrown under different CO2and P concentrations
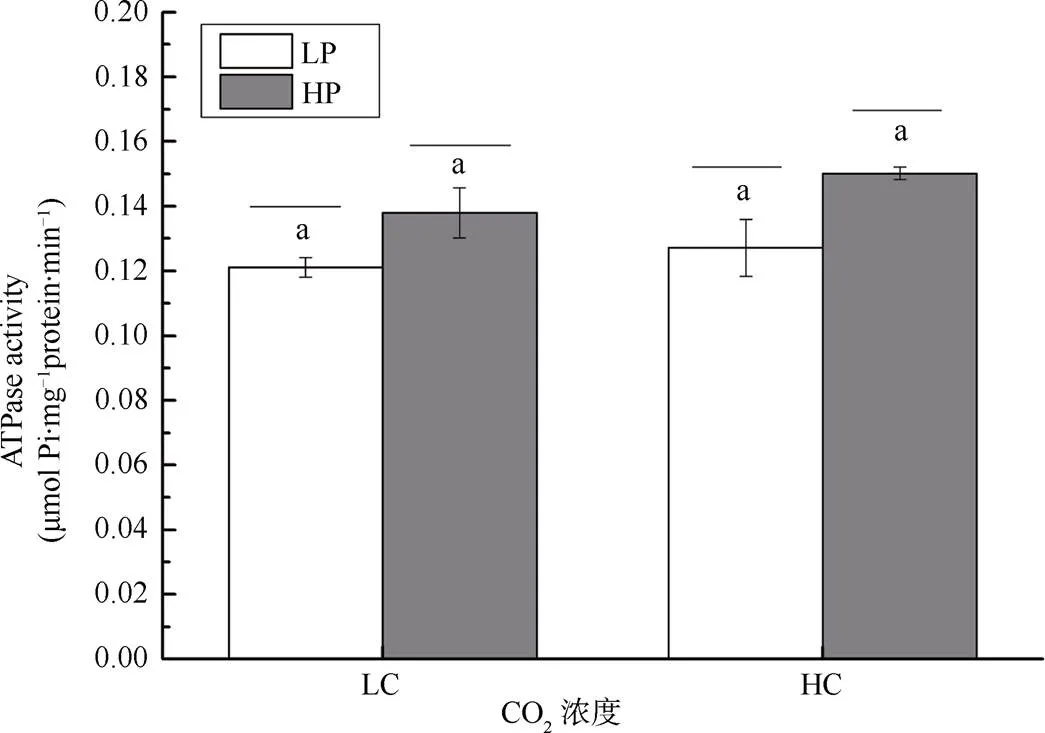
注: 不同小写字母表示具有显著性差异(P<0.05)
Figure 7 Effects of different CO2and P concentrations on ATPase activities in
3 讨论
海藻的生长涉及一系列复杂的生理代谢过程, 磷是生物体的必需元素, 是三磷酸腺苷(ATP)传递能量的核心元素[21]。目前我们的研究结果显示在正常大气CO2浓度下, 较高的磷浓度导致龙须菜相对生长速率明显增加, 这可能与磷加富可以促进RuBP的合成, 或提高Rubisco酶的活性有关[ 22-23]。但大气CO2浓度升高所诱导的海洋酸化环境中高磷浓度并未对龙须菜的生长产生同样的效应, 这一结果显示海洋酸化环境中磷浓度增加对龙须菜的生长效应受到了一定程度上的抑制, 这与Xu 等(2007)的研究结果一致[29]。光合和呼吸是直接影响大型藻类碳代谢和生长的重要生理过程[26]。Farmaki 等(2014)的研究表明大气CO2浓度下, 磷浓度增加可提高大型藻类的净光合速率[11,25]。我们的研究结果也印证了这一点: 即正常大气CO2浓度条件下, 磷浓度的增加明显提高龙须菜的最大光合速率(Pm)和光饱和点(Ik), 同时暗呼吸速率(Rd)明显下降, 表明磷加富可提高龙须菜的光合能力, 降低暗呼吸速率, 进而促进龙须菜的生长。而在高浓度CO2条件下, 磷加富对龙须菜的Pm、Ik以及Rd均无显著影响。大型藻类普遍具有自身的碳浓缩机制(CCM), 通过CCM机制来满足光合作用过程对无机碳的需求[25], 龙须菜光合作用中同样具有CCM机制进行辅助, 而CCM机制正常运行需要足够的能量供应, ATP在CCM机制中起了非常重要的作用[26]。
ATP酶的主要功能是催化细胞内ATP水解过程并释放能量, 维持生命体的正常生命活动需求[31-32], 是生物体能量代谢的关键酶。磷是ATP的重要合成底物, 充分的磷供应可维持海洋藻类的无机碳利用过程中ATP合成、相关蛋白合成和酶的磷酸化需求[29-30]。具有正常活性的生命体可通过ATP分解与合成的偶联循环, 使细胞内ATP含量稳定在一定水平, 但生物体代谢需要的能量愈多, 要求的循环速度就越快[31]。ATPase活性强弱可直接影响这一循环的速度。本研究发现不论是在正常CO2浓度还是高浓度CO2条件下, 高磷浓度下ATP酶活性均明显增强, 表明高磷环境中细胞内能量的释放增加。海洋酸化环境中, 虽然能量代谢速度增加, 但这一部分能量并没有直接用于龙须菜的生长上, 原因可能是此部分能量用于细胞的其他代谢过程, 包括海洋酸化导致的海水中H+浓度增加可能会导致藻类生理调节机制的变化(如营养代谢、细胞膜氧化还原与膜蛋白、电子传递等)而引起负面效应[3]。海洋酸化对大型海藻生长的负面效应, 在缘管浒苔(Gao et al., 2018), 条斑紫菜(Gao et al., 2019)和钝马尾藻(Xu et al., 2017)中已经得到验证, 这一现象的主要原因是环境pH下降扰乱了藻体内外的酸碱平衡, 导致藻体需分配更多能量用于内稳态的维持[5,33-34]。
Garcia-Sanchez等(1996)在高磷浓度培养下的藻体中发现藻体叶绿素a和可溶性蛋白含量都有明显的升高[14]; 但徐智广的研究显示磷加富下藻体叶绿素a含量增加, 而藻体可溶性蛋白含量却降低[29], 这可能与实验所选择的海藻种类及营养盐浓度设置有关。本研究中龙须菜不管是在大气CO2浓度还是高CO2浓度培养下, 藻体的叶绿素a和Car含量均没有随着磷浓度的变化而变化, 这与实际光化学效率与光合效率的变化是一致的, 这表明大气CO2浓度升高并没有影响叶绿素和Car合成, 对光能的捕获和收集并没有产生明显的影响。可见高浓度CO2诱导海洋酸化环境中, 磷加富可以通过调节光合速率、呼吸作用速率和ATPase活性, 改变能量的利用效率调控其生长。
4 结论
大气CO2培养下, 磷加富导致龙须菜的相对生长速率和最大光合速率增加, 暗呼吸速率降低; 但高CO2浓度下, 磷浓度变化对三者的影响不明显。不管是在大气CO2浓度还是高浓度CO2下, 磷加富对叶绿素a、类胡萝卜素含量和实际光化学效率均没有明显影响, 但使ATPase活性明显增加。以上结果表明在高浓度CO2诱导海洋酸化环境中, 磷加富可以通过调节光合速率、暗呼吸速率和ATPase活性, 改变能量的利用效率调控其生长。龙须菜近海养殖已初步产业化, 我们的研究对预测未来海洋酸化环境下海区营养物质(磷浓度)的变化对龙须菜产量的影响具有重要意义。但海洋实际环境较为复杂, 海洋酸化下其它环境因子特别是富营养化(氮浓度变化等)产生的生理学效应需要进一步深入探究。
[1] IPCC (Intergovernmental Panel on Climate Change). Climate change 2007: synthesis report[R]. New York, Cambridge University Press, 2007
[2] Sabine C L, Feely R A, Gruber N,. The oceanic sink for anthropogenic CO2[J]. Science, 2004, 305: 367– 371.
[3] 高坤山. 海洋酸化正负效应: 藻类的生理学响应[J]. 厦门大学学报(自然科学版), 2011, 50(2): 411–417.
[4] 邹定辉, 高坤山, 阮祚禧. 高CO2浓度对石莼光合作用及营养盐吸收的影响[J]. 青岛海洋大学学报(自然科学版), 2001,31(6): 877–882.
[5] XU Zhiguang, GAO Guang, XU Juntian, et al. Physiological response of a golden tide alga () to the interaction of ocean acidification and phosphorus enrichment[J]. Biogeosciences, 2017. 14(3): 671–681.
[6] 徐军田, 高坤山. 二氧化碳和阳光紫外辐射对龙须菜生长和光合生理的影响[J]. 海洋学报, 2010, 32(5): 144– 151.
[7] ANDRIA J R, VERGARA J J, Perez-Llorens J L. Biochemical responses and photosynthetic performance ofsp. (Rhodophyta) from Cádiz, Spain, cultured under different inorganic carbon and nitrogen levels [J]. European Journal of Phycology, 1999, 34(05): 497–504.
[8] Barker S, Diz P, Vautravers M J, et al. Interhemispheric Atlantic seesaw response during the last deglaciation[J]. Nature. 2009, 457: 1097–1102.
[9] 李小梅, 夏建荣. 氮磷营养限制影响三角褐指藻光合无机碳利用和碳酸酐酶活性[J]. 水生生物学报, 2013, 37(03): 405–412
[10] Fleming-Lehtinen V, Andersen J H, Carstensen J, et al. Recent developments in assessment methodology reveal that the Baltic Sea eutrophication problem is expanding[J]. Ecological Indicators, 2015, 48: 380–388.
[11] Farmaki E G, THOMAIDIS N S, PASIAS I N, et alEnvironmental impact of intensive aquaculture: investigation on the accumulation of metals and nutrients in marine sediments of Greece[J]. Science of The Total Environment, 2014, 485-486: 554–562.
[12] LOBBAN C S, HARRISON P J, DUNCAN M J. The physiological ecology of seaweeds[M]. Cambridge:, 1985
[13] DIAZ-PULIDO G. MCCOOK L J. Effects of nutrient enrichment on the fecundity of a coral reef macroalga[J]. Journal of Experimental Marine Biology and Ecology, 2004, 317(1): 13–24
[14] GAREIA-SANEHEZ M J, FEMANDEZ J A, NIELL F X. Photosynthetic response of P-deficientunder two different phosphate treatments[J]. Physiologia Plantarum, 1996, 96: 601–606
[15] XU Zhiguang, ZOU Duihui and GAO Kaoshan.. Effects of elevated CO2and phosphorus supply on growth, photosynthesis and nutrient uptake in the marine macroalga(Rhodophyta)[J].Botanica Marina, 2010, 53(2): 123–129
[16] 夏邦美, 张峻甫.中国海藻志(第二卷红藻门第五分册: 伊谷藻目, 杉藻目, 红皮藻目)[M]. 北京: 科学出版社, 1999.
[17] Ritchie R J. Consistent sets of spectrophotometric chlorophyll equations for acetone, methanol and ethanol solvents[J]. Photosynthesis Research, 2006, 89(1): 27-41.
[18] STRICKLAND J D H, PARSONS T R. A Practical Handbook of Seawater Analysis[M]. Fisheries Research Board of Canada, Ottawa. 1972: 186–190.
[19] KITAJIMA M, BUTLER W. Quenching of chlorophyll fluorescence and primary photochemistry in chloroplasts by dibromothymoquinone[J]. Biochimica et Biophysica Acta, 1975, 376(1): 105–115.
[20] GENTY B, BRIANTAIS J M, BAKER N R. The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence[J]. Biochimica et Biophysica Acta, 1989, 990(1): 87–92.
[21] 郭培国, 李明启. 杂交水稻及其亲本光合特性的研究Ⅱ. 功能叶片的希尔反应、光合磷酸化、ATP酶活性和ATP含量[J]. 热带亚热带植物学报, 1997, 5(1): 65–70.
[22] RAO I M, TERRY N. Leaf Phosphate Status, Photosynthesis, and Carbon Partitioning in Sugar Beet: I. Changes in Growth, Gas Exchange, and Calvin Cycle Enzymes[J]. Plant Physiology, 1989, 90(3): 814–819.
[23] LAUER M J, PALLARDY S G, Blevins D G, et al. Whole Leaf Carbon Exchange Characteristics of Phosphate Deficient Soybeans (Glycine max L.)[J]. Plant Physiology, 1989, 91(3): 848–854.
[24] BREMBU T, MÜHLROTH A, ALIPANAH L, et al. The effects of phosphorus limitation on carbon metabolism in diatoms[J]. Philosophical Transactions of The Royal Society B Biological Sciences. 2017, 372(1728): 20160406.
[25] CHEN Binbin, ZOU Duihui, MA Jiahai. Interactive effects of elevated CO2and nitrogen-phosphorus supply on the physiological properties of(Bangiales, Rhodophyta)[J]. Journal of Applied Phycology, 2016, 28: 1235–1243
[26] 邹定辉, 高坤山. 大型海藻类光合无机碳利用研究进展[J]. 海洋通报, 2001, (5): 84–91.
[27] ZOU Duihui, XIA Jiarong, YANG Yufeng. et al. Photosynthetic use of exogenous inorganic carbon in the agarphyte(Rhodophyta)[J]. Aquaculture, 2004, 237: 421–431.
[28] WU Yaping, GAO Kunshan, RIEBESELL U. CO2-induced seawater acidification affects physiological performance of the marine diatom[J]. Biogeosciences, 2010, 7(9): 2915–2923.
[29] 徐智广. 2种大型经济海藻对海水中营养盐供应的生理响应[D]. 汕头: 汕头大学, 2007.
[30] ZER H, OHAD I. Light, redox state, thylakoid-protein phosphorylation and signaling gene expression[J]. Trends in Biochemical Sciences, 2003, 28(9): 467–470.
[31] 刘春光, 金相灿, 邱金泉, 等. 光照与磷的交互作用对两种淡水藻类生长的影响[J]. 中国环境科学, 2005, 25(1): 32–36.
[32] MORSOMME P, BOUTRY M. The plant plasma membrane H+-ATPase: structure、Function and regulation[J]. Biochim.Biophys. Acta, 2000, 1465: 1–16.
[33] Gao Guang, John B, Bao Menglin, et al. Ocean acidification and nutrient limitation synergistically reduce growth and photosynthetic performances of a green tide alga. Biogeosciences, 2018, 15: 3409–3420.
[34] GAO Guang, GAO Qi, BAO Menglin, et al. Nitrogen availability modulates the effects of ocean acidification on biomass yield and food quality of a marine crop. Food Chemistry, 2019, 271: 623–629.
[35] SONDERGAARD T E, SCHU L Z A, Palmgren M G. Energization of transport processes in plants. Roles of the plasma membrane H+-ATPase[J]. Plant Physiol. 2004, 136 (1): 2475–2482
[36] 陈颖, 刘柿良, 杨容孑, 等. 镉胁迫对龙葵生长、质膜ATP酶活性及氮磷钾吸收的影响[J]. 应用与环境生物学报, 2015, 21(1): 121–128.
Effects of ocean acidification and phosphorus concentration on photosynthesis and ATPase activity of
WEI Yanyun1, JIN Peng2, JIANG Yingying2, XIA Jianrong2,*
1.School of Life Sciences, Guangzhou University, Guangzhou 510006, China 2. School of Environmental Science and Engineering, Guangzhou University, Guangzhou 510006, China
The effects of different concentrations of phosphorus (0.5 and 30 μmol·L-1) on the growth, photosynthetic metabolism and ATPase activity ofwere examined under the conditions of low CO2concentration (390μL·L–1) and high CO2concentration (1000μL·L–1). The results were found that the relative growth rate and the maximum photosynthetic rate increased and the dark respiration rate decreased with the enrichment of phosphorus under ambient CO2, but the change of phosphorus concentration had no significant effect at the high level of CO2. At different CO2levels, phosphorus enrichment had no significant effect on chlorophyll a, carotenoid content or actual photochemical efficiency of, but enhanced ATPase activity significantly. The present study shows that high phosphorus regulates the growth ofby adjusting the photosynthetic rate, dark respiration rate and ATPase activity, and changing the efficiency of energy utilization at the high level of CO2.
; CO2; phosphorus; photosynthesis; ATPase activity
卫燕云, 金鹏, 江莹莹, 等. 海洋酸化与磷浓度变化对龙须菜光合作用和ATPase活性的影响[J]. 生态科学, 2021, 40(1): 1–8.
WEI Yanyun, JIN Peng, JIANG Yingying, et al. Effects of ocean acidification and phosphorus concentration on photosynthesis and ATPase activity of[J]. Ecological Science, 2021, 40(1): 1–8.
10.14108/j.cnki.1008-8873.2021.01.001
A
1008-8873(2021)01-001-08
2020-06-20;
2020-07-20
国家自然科学基金(41376156)
卫燕云(1996—), 硕士研究生, 主要从事藻类生理生态学研究, E-mail: 2111714024@e.gzhu.edu.cn
夏建荣, 博士, 教授, 主要从事藻类生理生态学研究, E-mail: jrxia@gzhu.edu.cn
