小麦miR5062靶基因的鉴定及功能研究
2021-04-12吴保为李志杰刘振兰赵惠贤
刘 涛,吴保为,李志杰,刘振兰,王 倩,2,赵惠贤,2
(1.西北农林科技大学生命科学学院,陕西杨凌 712100;2.西北农林科技大学旱区作物逆境生物学国家重点实验室,陕西杨凌 712100;3.华南农业大学生命科学学院,广东广州 510642;4.华南农业大学亚热带农业生物资源保护与利用国家重点实验室,广东广州 510642)
miRNA作为植物中一种重要的内源小分子,通过调控靶基因的表达在植株生长发育、逆境胁迫响应等方面发挥重要的调节作用。近二十多年来,植物体内大量的miRNA被鉴定,而且对许多miRNA的调控机制也有深入的研究。如拟南芥miR160通过调控其靶基因ARF17参与了生长素信号传导途径,影响植株胚胎和根的发育[1]。
小麦的miRNA研究起步较晚,但近些年相关的研究进展迅速。小麦中大量的miRNA主要是通过小RNA测序方法在不同组织和发育阶段及不同逆境胁迫下被鉴定出来。如本实验室在小麦旗叶和发育的籽粒中鉴定出24个已知的miRNA和55个新的miRNA[2]。截至2014年6月,小麦中119个miRNA已在miRBase数据库里登记[3]。然而这些miRNA的靶基因及其在小麦生长发育等方面的生物学功能基本上尚未鉴定。关于小麦中单个miRNA对植株生长发育作用的研究只有少量报道。过量表达tae-miR408或其靶基因TaTOC1被RNAi干扰均会引起小麦提前抽穗,而且tae-miR408通过调控其靶基因TaTOC1的表达影响植株高度和旗叶角度[4]。miR172通过调控Q等位基因在小麦穗部形态和谷物脱粒能力方面起到重要作用[5]。miR156通过调控靶基因SBP-Box转录因子来影响小麦株型[6]。小麦中的miR9678和TaMIR1139分别影响种子发芽、脱落酸或赤霉素信号转导和磷饥饿响应,但它们调控的靶基因尚未被鉴定出[7-8]。
ARGONAUTE(AGO)蛋白在生物界中的作用是十分广泛又极其重要的。AGO蛋白与小RNA结合,共同维持基因组的稳定,调控个体对生物和非生物胁迫的响应以及在动植物的各种发育事件中调节转录或转录后基因沉默[9]。AGO基因广泛存在于生物界,在许多不同的物种中都已鉴定出AGO基因的存在。不过在不同物种中AGO家族成员的数量具有一定的差异,如酵母只有1个AGO基因,果蝇含有5个AGO基因[10],线虫有27个AGO基因[11],人类编码8个AGO蛋白[12]。在开花植物中,拟南芥有10个AGO基因,水稻有19个AGO基因[13],玉米有17 个AGO基因[14]。在植物中,有关拟南芥AGO家族的研究最多且最清楚;水稻和玉米的部分AGO家族成员的功能也有所揭示,如最近Zheng等[15]研究发现,OsAGO2在水稻花药中通过在表观遗传学层次上调控OsHXK1的表达来控制活性氧化物的产生和绒毡层细胞程序性死亡的启动。然而关于小麦AGO家族的研究却未见报道。此外,植物AGO基因是否作为miRNA的靶标基因而受到调控也鲜有研究。
本课题组前期对小麦品种小偃6号的幼苗、旗叶和籽粒的3个发育时期(花后5 d、10 d和 20 d)的小分子RNA分别进行高通量深度测序和分析,然后从在旗叶中偏爱性高表达的miRNA里选取了一个新的miRNA:tae-miR5062。tae-miR5062在小麦幼苗、旗叶和发育的籽粒中表达量高(分别为510、1 509和2 932 RPM)[2]。本研究在明晰tae-miR5062靶标基因的基础上,并进一步探究tae-miR5062靶标基因的基本性质和生物学功能,以期揭示该基因在小麦生长发育方面起的作用。
1 材料与方法
1.1 材 料
1.1.1 植物材料
本研究所用小麦材料有小偃6号(采集苗期的根、茎、叶,二棱期的生长点,抽穗期的穗部、旗叶,花后15 d的籽粒)和宁春16。拟南芥材料为哥伦比亚野生型(Columbia)。烟草材料为本氏烟草。
1.1.2 菌株和载体
大肠杆菌(Escherichiacoli)DH5α菌株、农杆菌(Agrobacteriumrhizogenes)转化菌株GV3101、烟草瞬时表达载体pBI121及遗传转化表达载体pCAMBIA1304由本实验室保存。亚细胞定位载体pGL3由西北农林科技大学生命科学学院赵天永教授惠赠。
1.1.3 主要试剂
KOD FX购自TOYOBO公司(日本);限制性内切酶XbaI、BamHI、XhoI和NcoI、T4DNA连接酶、PrimeScript RT reagent Kit等购自宝生物工程有限公司(大连);高纯总RNA快速抽提试剂盒购自百泰克生物技术有限公司;质粒小提试剂盒以及通用型DNA纯化回收试剂盒均购自TianGen生物公司(北京);快速克隆技术试剂盒购自诺唯赞生物技术有限公司(南京);DL2000 DNA Marker和250 bp DNA Marker购自康为世纪生物科技有限公司(北京)。所用PCR引物由西安擎科泽西生物有限公司合成。
1.2 试验方法
1.2.1tae-miR5062的靶基因预测及克隆
利用本实验室前期未发表的降解组数据和patmatch软件预测tae-miR5062的靶基因,通过参考IWGSC RefSeq v1.0的最新信息对预测结果进一步分析,推测TraesCS2A01G419900.1及其在2B、2D染色体上同源基因为tae-miR5062的靶基因。利用DNAMAN软件进行miR5062与靶基因的结合位点检测。采用ClustalX软件将该基因与拟南芥、水稻的同源基因进行比对,并利用MEGA5.0的邻近法(neghhor-joining)构建系统进化树,bootstrap值设置为1 000。根据靶基因编码序列(coding sequence,CDS)设计引物,引物序列如下:
TaAGO2-F:5′-ATGGATTACGAGCAAGG C-3′;
TaAGO2-R:5′-GATGAAGAACATGTTG TC-3′。
以宁春16各时期/部位的cDNA为模板,进行PCR扩增。PCR体系:2×KOD buffer 25 μL, dNTPs(10 mmol·L-1)10 μL, KOD-FX 1 μL, 上下游引物(10 μmol·L-1)各1 μL,宁春16 cDNA模板2 μL, 以ddH2O补足至50 μL。PCR程序:95 ℃ 2 min;98 ℃ 10 s,65 ℃ 30 s,68 ℃ 3 min 15 s,35个循环;68 ℃ 10 min。扩增产物经1%琼脂糖凝胶电泳检测,切胶回收目的片段;将目的片段经TA克隆后连接pMD19T载体;连接产物转化大肠杆菌DH5α,经菌落PCR鉴定后,阳性单克隆菌液送西安擎科泽西生物有限公司测序,测序正确的即为靶基因克隆载体pMD19T-TaAGO2。
1.2.2 构建重组表达载体pBI121-pre-miR5062、pBI121-TaAGO2和pCA1304-TaAGO2及亚细胞定位载体pGL3-TaAGO2
根据miRBase(http://www.mirbase.org/)网站上公布的tae-miR5062的前体序列和表达载体pBI121,设计带有XbaI和BamHI酶切位点的引物,引物序列如下(下划线指示酶切位点):
pre-miR5062-F:5′-CTAGTCTAGACAATT ATGTGCAAGTTAT-3′;
pre-miR5062-R:5′-CGCGGATCCACATGG TTCATATGCACT-3′。
根据靶基因TaAGO2的CDS和表达载体pBI121,设计带有XbaI和BamHI酶切位点的同源重组引物,引物序列如下(下划线指示酶切位点):
TaAGO2-F:5′-GAGAACACGGGGGACTC TAGAATGGATTACGAGCAAGGCG-3′;
TaAGO2-R:5′-GGACTGACCACCCGGGG ATCCGATGAAGAACATGTTGTCC-3′。
根据靶基因TaAGO2的CDS和表达载体pCA1304设计带有XbaI和NcoI酶切位点的引物,引物序列如下(下划线指示酶切位点):
TaAGO2-F:5′-CTAGTCTAGAATGGATTACG AGCAAGGC-3′;
TaAGO2-R:5′-CATGCCATGGAGATGA AGAACATGTTGTC-3′。
根据靶基因TaAGO2的CDS和亚细胞定位载体pGL3设计带有XhoI和NcoI酶切位点的引物,引物序列如下(下划线指示酶切位点):
TaAGO2-F:5′-CCGCTCGAGATGGATTA CGAGCAAGGCGG-3′;
TaAGO2-R:5′-CATGCCATGGGATGAAG AACATGTTGTCCT-3′。
以宁春16 DNA为模板扩增pre-miR5062序列。PCR体系:2×KOD buffer 25 μL, dNTPs(10 mmol·L-1)10 μL, KOD-FX 1 μL, 上下游引物(10 μmol·L-1)各1 μL,宁春16 DNA模板2 μL, 以ddH2O补足至50 μL。PCR程序:95 ℃ 2 min;98 ℃ 10 s,65 ℃ 30 s,68 ℃ 18 s,35个循环;68 ℃ 10 min。扩增产物经1%琼脂糖凝胶电泳检测,切胶回收目的片段;用XbaI和BamHI分别将目的片段和pBI121载体进行双酶切,胶回收后用T4连接酶连接;连接产物转化大肠杆菌DH5α,经菌落PCR鉴定后,阳性单克隆菌液送西安擎科泽西生物有限公司测序,测序正确的即为pre-miR5062表达载体pBI121-pre-miR5062。
以质粒pMD19T-TaAGO2为模板进行PCR扩增。PCR体系:2×KOD buffer 25 μL, dNTPs(10 mmol·L-1)10 μL, KOD-FX 1 μL, 上下游引物(10 μmol·L-1)各1 μL,模板pMD19T-TaAGO2质粒2 μL, 以ddH2O补足至50 μL。PCR程序:95 ℃ 2 min;98 ℃ 10 s,65 ℃ 30 s, 68 ℃ 3 min 15 s,35个循环;68 ℃ 10 min。扩增产物经1%琼脂糖凝胶电泳检测,切胶回收目的片段。
用XbaI和BamHI将pBI121载体进行双酶切,胶回收后用同源重组法连接目的片段和线性化载体。连接体系:5×CEII Buffer 4 μL,Exnase II 2 μL,线性化载体5 μL,目的片段2 μL,以ddH2O补足至20 μL。连接反应:37 ℃ 30 min。连接产物转化大肠杆菌DH5α,经菌落PCR鉴定后,阳性单克隆菌液送西安擎科泽西生物有限公司测序,测序正确的即为靶基因表达载体pBI121-TaAGO2。
用XbaI和NcoI分别将目的片段和pCA1304载体进行双酶切,胶回收后用T4连接酶连接;连接产物转化大肠杆菌DH5α,经菌落PCR鉴定后,阳性单克隆菌液送西安擎科泽西生物有限公司测序,测序正确的即为重组表达载体pCA1304-TaAGO2。
用XhoI和NcoI分别将目的片段和pGL3载体进行双酶切,胶回收后用T4连接酶连接;连接产物转化大肠杆菌DH5α,经菌落PCR鉴定后,阳性单克隆菌液送西安擎科泽西生物有限公司测序,测序正确的即为亚细胞定位载体pGL3-TaAGO2。
1.2.3tae-miR5062与靶基因的烟草瞬时表达互作验证
将重组质粒pBI121-pre-miR5062和pBI121-TaAGO2转化农杆菌GV3101,经菌落PCR鉴定后,将阳性单克隆菌株置于摇床中,28 ℃、180 r·min-1过夜培养;经4 ℃、3 000 r·min-1离心收集菌体,用乙酰丁香酮溶液重悬菌体并将OD600调至0.4,避光孵育2 h;按照图1在1月龄的烟草叶片上进行注射;注射后将烟草置于适宜环境中继续生长,两天后进行GUS染色。
1.2.4 靶基因表达模式分析
为了检测靶基因在小麦各时期/部位的表达量,我们设计了靶基因定量引物,引物序列如下:
TaAGO2-qpcr-F:5′-CCAAGTACGTGCCT AGAATCCG-3′;
TaAGO2-qpcr-R:5′-AGCACATTGCCGTT CTTCGTCT-3′。
以actin基因作为内参基因:
actin-qpcr-F:5′-AAATCTGGCATCACAC TTTCTAC-3′;
actin-qpcr-R:5′-GTCTCAAACATAATCT GGGTCATC-3′。
检测小偃6号苗期的根、茎、叶,二棱期的生长点,抽穗期的穗部、旗叶以及花后15 d的籽粒中TaAGO2基因的相对表达量。基因相对表达量计算方法采用2-△△Ct,每个反应3个重复,采用SPSS 20.0进行差异显著性分析。
1.2.5 靶基因的亚细胞定位
根据Yang等[16]报道的方法进行水稻原生质体的制备。将C端连有GFP的重组质粒pGL3-TaAGO2与原生质体,按10 μL质粒(5 μg)+100 μL细胞悬浮液+110 μL PEG依次加入到2 mL离心管中,横放,避光,28 ℃静置15 min。缓慢加入1 mL W5溶液洗涤,250 ×g离心10 min,收集细胞。用1 mL WI溶液悬浮细胞。避光, 28 ℃静置培养约12 h。300 ×g离心10 min。将转化的原生质体置于0.1 μg·mL-1的4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)溶液中,避光静置5 min。在460 nm荧光显微镜下观察DAPI与DNA结合后的蓝色荧光,在530 nm下观察GFP的绿色荧光。从而确定TaAGO2在细胞中的位置。
1.2.6 靶基因过表达拟南芥制备及阳性植株的筛选和鉴定
将重组表达载体pCA1304-TaAGO2转化农杆菌GV3101;转化成功后,采用蘸花法侵染拟南芥;通过在叶片喷施0.1% BASTA除草剂来进行转基因阳性植株的筛选。提取存活植株的叶片RNA,反转录合成cDNA,利用引物TaAGO2-qpcr-F和TaAGO2-qpcr-R进行PCR鉴定。选取10个以上阳性T2代转基因株系,用于以后的试验分析。
2 结果与分析
2.1 tae-miR5062的靶基因预测及筛选
结合本实验室前期未发表的降解组数据,利用patmatch软件对tae-miR5062的靶基因进行预测,结果共预测到5个靶基因(表1)。其中,TraesCS6D01G057600.1功能注释为Photosystem II protein K;TraesCS5B01G451400.1和TraesCS5D01G192700.1是小麦不同染色体组上的同源基因,功能注释为ARGONAUTE(AGO)MEL1蛋白;TraesCS2A01G419900.1和Traes CS2B01G439000.1同样属于同源基因,功能注释为AGO2蛋白。
通过参考IWGSC RefSeq v1.0的最新信息对预测结果进一步分析,排除掉不匹配和重复的结果后,选择TraesCS2A01G419900.1及其在 2B、2D 染色体上同源基因作为tae-miR5062的靶基因。miRNA与靶基因的结合位点检测显示tae-miR5062作用于靶基因的编码序列(图2)。
2.2 tae-miR5062的靶基因的进化分析
tae-miR5062的靶基因属于AGO蛋白家族。通过与拟南芥和水稻AGO蛋白的进化分析,该基因与OsAGO2亲缘关系最近,与AtAGO2、AtAGO3、AtAGO7、OsAGO2、OsAGO3和OsAGO7同属于AGO2/3/7进化类群(图3),所以将TraesCS2A01G419900.1命名为TaAGO2。
2.3 重组表达载体pBI121- pre-miR5062、 pBI121- TaAGO2和pCA1304- TaAGO2以及亚细胞定位载体pGL3- TaAGO2构建
将表达载体pBI121质粒和pre-miR5062的PCR产物经XbaI和BamHI双酶切后连接,转化大肠杆菌DH5α,挑取单克隆进行菌落PCR鉴定(图4A)。pre-miR5062大小为273 bp,菌落PCR下游引物长度为载体插入位点下游180 bp,因此菌落PCR产物大小为453 bp。进一步进行测序验证的结果显示重组表达载体pBI121-pre-miR5062序列和读码框正确。
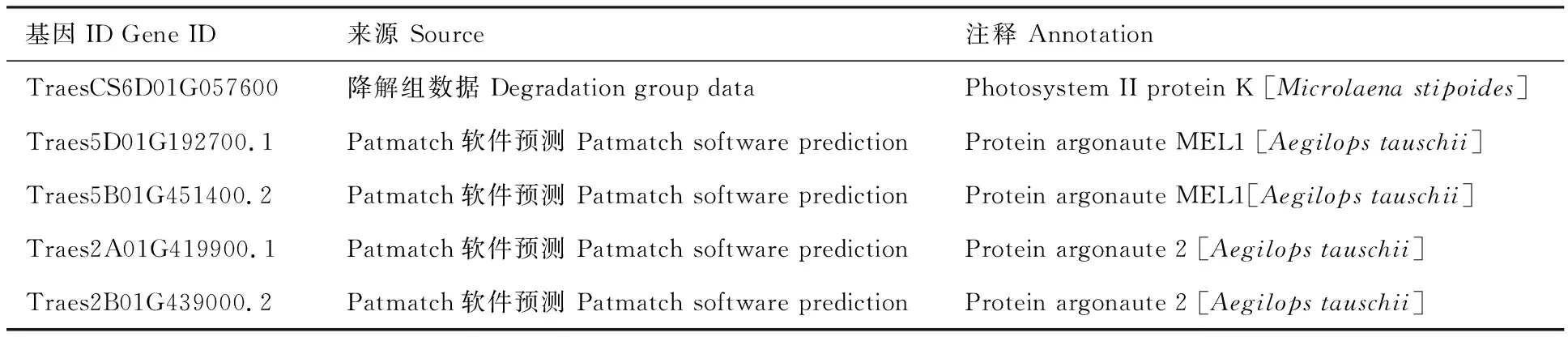
表1 tae-miR5062靶基因预测结果Table 1 Predicted target genes for tae-miR5062
将表达载体pBI121质粒经XbaI和BamHI双酶切后,与靶基因TaAGO2的PCR产物进行同源重组连接,连接产物转化大肠杆菌DH5α,挑取单克隆进行菌落PCR鉴定(图4B)。靶基因大小为3 150 bp。进一步进行测序验证的结果显示,重组表达载体pBI121-TaAGO2序列和读码框正确。
将表达载体pCAMBIA1304质粒和靶基因TaAGO2的PCR产物经XbaI和NcoI双酶切后连接,转化大肠杆菌DH5α,挑取单克隆进行菌落PCR鉴定(图4C)。进一步进行测序验证的结果显示,重组表达载体pCA1304-TaAGO2序列和读码框正确。
将亚细胞定位载体pGL3质粒和靶基因TaAGO2的PCR产物经XhoI和NcoI双酶切后连接,转化大肠杆菌DH5α,挑取单克隆进行菌落PCR鉴定(图4D)。进一步进行测序验证的结果显示,重组载体pGL3-TaAGO2序列和读码框 正确。
2.4 tae-miR5062与其靶基因 TaAGO2互作的验证
将构建的重组质粒pBI121-pre-miR5062和pBI121-TaAGO2分别转入农杆菌GV3101感受态细胞,然后在烟草叶片上进行分区注射。GUS染色结果表明转化的未连接GUS的pre-miR5062的农杆菌注射区未染上色,另外转化pBI121空载和转化TaAGO2的农杆菌的注射区能够染上色且染色程度基本一致。但是共注射含有pre-miR5062和TaAGO2的区域的蓝色明显减弱(图5),说明tae-miR5062与其靶基因TaAGO2互作降解,并降低了TaAGO2的表达。
2.5 TaAGO2表达模式分析
利用实时定量PCR方法对小麦不同组织中TaAGO2的转录水平进行定量分析,结果显示,TaAGO2在根中表达量很低,在叶中表达量也不高,但在旗叶、茎、穗和籽粒中都有较高的表达量,其中在生长点(apical meristem,AM)中的表达量最高(图6)。
2.6 TaAGO2的亚细胞定位
为了明确TaAGO2蛋白在细胞中的表达部位,我们将C端连有GFP的TaAGO2融合表达载体pGL3-TaAGO2转入水稻黄化苗叶鞘的原生质体中瞬时表达。经DAPI染色和荧光显微镜观察显示,TaAGO2蛋白的绿色荧光表达位置与细胞核与细胞质位置一致,说明TaAGO2定位于细胞核和细胞质内(图7)。
2.7 过量表达 TaAGO2基因对拟南芥生长发育的影响
通过BASTA喷施,筛选转基因阳性株系至T1代(图8)。实时定量检测发现,转基因拟南芥TaAGO2基因表达水平显著高于野生型(图9)。通过T2代转基因阳性植株表型观察,与野生型相比,过表达TaAGO2拟南芥并无明显表型。
3 讨 论
miRNA主要是通过调控靶基因的表达而发挥一定的生物学功能。本研究通过生物信息学预测和实验验证tae-miR5062的靶基因是TaAGO2。小麦里已鉴定出的上百个miRNA中只有几个miRNA的靶基因被实验验证,因此大量的小麦miRNA的靶基因需要鉴定。miRNA的靶基因首先通过生物信息学的软件预测,如Target Finder、PatScan、miRU、psRNATarget等[17-19]。动物和植物的miRNA作用机制有差异,因此须使用不同的预测软件,如Target Finder用来预测动物miRNA的靶基因。在植物中,psRNATarget用的比较多。但这些预测结果会出现数据海量、假阳性高和准确性差等弊端。验证单个miRNA的靶基因方法主要有5′-RACE技术,而5′-RACE技术又存在成本高和操作难度大的缺点。本研究采用农杆菌介导的烟草瞬时共转化试验验证miRNA和靶基因,该方法具有成本低、难度小和时间短的优点,为验证小麦miRNA与其靶基因互作提供简便快速方法,有助于小麦大量miRNA靶基因的鉴定。例如,Wang等[20]利用农杆菌介导的烟草瞬时表达体系和荧光定量分析证明了tae-miR164对TaMAPF4的调控。
据报道,水稻OsAGO2调控花药的发育[15]。过量表达OsAGO1b引起水稻叶片正面内卷,而且分蘖数降低;RNAi介导的OsAGO1b降低表达的转基因植株叶片未见明显表型,但花药异常且花粉育性降低,导致种子减少[21]。水稻中过量表达OsAGO17能增加籽粒大小和粒重,且促进茎部发育[22]。但我们发现TaAGO2在拟南芥中过量表达时植株在生长发育方面并未见明显的表型。例如,TaAGO2在生长点、旗叶和籽粒中高表达,转基因后代在生殖生长及角果数等方面与野生型相比没有明显的差异。这可能是由于物种间的差异,小麦的TaAGO2在拟南芥中过量表达的转基因植株的表型与已报道的AGO家族成员过量表达或低表达的突变体的表型不同。另外,AGO蛋白大家族在生物界中的作用是十分广泛又极其重要的,但植物AGO蛋白转录后水平被miRNA调控未见报道。本研究首次揭示小麦的TaAGO2是tae-miR5062的靶基因。
TaAGO2在小麦根中表达量很低,在叶中表达量也不高,但在旗叶、茎、穗、籽粒和生长点中都有较高的表达量,其在旗叶和籽粒中的表达量相当。tae-miR5062在小麦旗叶和籽粒中都高表达,表达量分别为1 509和2 932 RPM[2],即籽粒中的表达比旗叶中的高约一倍,这与靶基因TaAGO2在该组织中的表达模式并不完全一致。同一miRNA可能调控多种不同类型的基因的表达,而同一个基因也有可能受多个miRNA的调控[23-24]。tae-miR5062另外一个可信度较高的靶基因还有AGO MEL1,这可能是导致tae-miR5062和靶基因TaAGO2在小麦各组织中的表达没有完全对应的原因之一。
培育转基因小麦具有难度大、花费高和时间长的缺点,病毒诱导的基因沉默(virus-induced gene silencing,VIGS)节省时间,但花费高,操作难度大,且表型不明显。转入拟南芥进行表达则简单、花费低且时间短。因此,将小麦中感兴趣的基因首先转到拟南芥中观察植株表型,若有明显的、值得深入研究的表型,再将其转入小麦中进行深入分析是研究小麦基因的的首选方案。本研究结果为深入探究TaAGO2在小麦生长发育过程中的功能提功了基础信息。
4 结 论
本研究在小麦(Triticumaestivum)中新发现了幼苗、旗叶和发育籽粒中高表达的tae-miR5062,利用生物信息学方法确定TaAGO2为其靶基因,进一步构建tae-miR5062前体和TaAGO2的重组表达载体,分别转入农杆菌感受态细胞,然后进行农杆菌介导的烟草瞬时共转化试验。结果表明,tae-miR5062与其靶基因TaAGO2互作。TaAGO2在根和叶中表达量不高,但在旗叶、茎、穗、籽粒和生长点中都有较高的表达量。TaAGO2蛋白被定位于细胞核和细胞质中;在拟南芥过量表达TaAGO2转基因植株与野生型相比,在植物生长发育方面无明显的表型。
