Mg2+、Mn2+对波吉卵囊藻生长的影响
2021-04-11刘锦上黄翔鹄
张 慧,刘锦上,黄翔鹄,2,3
(1.广东海洋大学水产学院//2.广东省藻类养殖及应用工程技术研究中心,广东 湛江 524088;3.广东海洋大学深圳研究院,广东 深圳 518000;4.茂名市金阳热带海珍养殖有限公司,广东 茂名 525000)
波吉卵囊藻(Oocystis borgei)隶属于绿藻门Chorophyta,绿藻纲Chlorophyceae,绿球藻目Chlorococcales,卵囊藻科Oocystaceas,卵囊藻属Oocystis,是对虾池塘中重要的生长因子,具有种群稳定、抑制弧菌生长、吸附重金属、吸收氨氮等重要功能,对保持对虾池塘环境生态系统平衡有重要作用,被广泛用于对虾池塘水质控制[1-3]。Mg2+、Mn2+离子对于微藻种群的稳定增长具有极为重要的影响[4-5]。郭丽丽等[6]认为Mg2+影响着微囊藻的新陈代谢过程,从而影响微囊藻的生长状况以及合成有机物的能力。Mg2+是维持细胞正常机能,促进植物生长发育的必要条件[7]。刘静等[8]认为Mn2+作为藻类生长必需的之一,是生物体进行光合作用的催化剂,对有氧呼吸产生的氧化产物有去毒作用,是一些酶的活化剂,以及在生成ATP方面也起功能性作用。李灏等[9-10]认为一般水体中Mn2+等元素的含量是很低的,常常成为藻类生长的限制因子。在池塘定向培育波吉卵囊藻的生产活动中,Mg2+、Mn2+等是对虾养殖水体存在的重要离子,对卵囊藻的生长具有特定调控作用。目前,关于波吉卵囊藻的研究报道主要在其生理生态及应用方面,李长玲等[2]、黄翔鹄等[3]等研究了波吉卵囊藻培养的生态条件及其对虾池环境增强凡纳滨对虾抗病力的影响,波吉卵囊藻对Cu2+和Zn2+的耐受力、吸附率和吸附量的作用规律,但未见有关于波吉卵囊藻对Mg2+、Mn2+等离子需求的研究报道。本实验通过设置不同的Mg2+、Mn2+浓度梯度,对波吉卵囊藻的藻细胞数目、叶绿素a含量、类胡萝卜素含量及胞内外多糖含量测定,探索Mg2+、Mn2+等离子在波吉卵囊藻的生理生态和生长状况的影响,为波吉卵囊藻在河口等低盐度地带的培育提供科学依据。
1 材料与方法
1.1 材料
实验用波吉卵囊藻由广东海洋大学水域生态与水产养殖研究室提供,经蒸馏水洗涤后培养在实验室中备用。实验用蒸馏水取自广东海洋大学超纯水仪,煮沸冷却后使用。
1.2 方法
1.2.1接种和培养条件 营养液采用f/2 培养液的配方[11]为基础,取蒸馏水培养数日后的波吉卵囊藻液接入新鲜培养液中,实验用 500 mL锥形瓶,培养液体积400 mL,置于PGX-280A-12H光照培养箱中培养,实验照度为4 000 lx,光暗周期为12 h∶12 h,温度为24 ℃,每天定时摇瓶4次,并交换位置。
1.2.2单因子实验浓度设置 分别设5个实验浓度组,每组设3个平行组,以f/2培养液的配方为基础,采取仅改变Mg和Mn其中一种营养盐浓度而另一种不变的方法进行单因子实验。Mg2+质量浓度梯度分别设置为0、1、2、4、8 mg/L,并以不含Mg2+的培养液为对照组。Mn2+浓度梯度分别设置为0、0.005、0.050、0.500、5.000 mg/L,并以不含Mn2+的培养液为对照组。
1.2.3藻细胞密度光密度值与细胞密度关系建立
先做D和藻类细胞数相关初步实验,将实验用藻液稀释成不同浓度梯度,用UV-2450 日本岛津紫外-可见光分光光度计在650 nm 处测各浓度组D值,将藻液用血球计数板计算其细胞数,结果表明在650 nm处D值与藻细胞密度N(mL)相关性良好,线性关系为:N=748.34×D(650 nm)+6.324 5(R2=0.99)。以不加藻液的相同培养液为空白对照,从接种日起,每天定时取藻液8 mL,用UV-2450日本岛津紫外-可见光分光光度计测定650 nm处的D值,再换算为细胞密度N[2]。
1.2.4色素蛋白含量的测定 根据韩建刚等[12]的方法测定叶绿素a、类胡萝卜素的含量,但有所改进,具体方法:培养10 d后用移液枪吸取8 mL藻液,注入离心管,于4 ℃冰箱避光放置24 h,取出后以5 000 r/min离心15 min,去上清液,加入5 mL体积分数95%的乙醇,摇匀,避光条件下置于4 ℃冰箱24 h,提取完成后以5 000 r/min再次离心15 min,将上清液移至离心管,摇匀待测。以95%乙醇为参比溶液,用UV-2450型日本岛津紫外-可见光分光光度计测定上清液中的665、649、646、470 nm处吸光值。
1.2.5多糖含量的测定 采用Yang等[13]的方法提取多糖,但有所改进,具体方法:以葡萄糖为标准品制作标准曲线,用UV-2450型日本岛津紫外-可见光分光光度计在波长490 nm处测定各浓度组D值,得标准曲线方程:Y=0.015 7X-0.021 8(R2=0.999 2)。取培养10 d后的藻液8 mL,5 000 r/min离心15 min,取上清液测定胞外多糖含量。上述离心后的藻团加入5 mL 0.000 03 mol/L的NaOH,摇匀后置于水浴锅中50 ℃水浴2.5 h,取出后5 000 r/min离心15 min,取上清液测定胞内多糖含量。取上述2次的上清液各2 mL用苯酚—硫酸法[12-14]测定450 nm处的D值,即为多糖含量,最后结合藻细胞密度可计算出单细胞胞内外多糖的含量。
1.2.6数据处理 增殖率:K=(lgDt-lgD0)/t× 3.322,Dt表示最终光密度值,D0表示最初光密度值,t表示培养时间[1]。
色素蛋白含量:
ρa=13.95D(665 nm) -6.88D(649 nm);
ρb=24.96D(646 nm) -7.32D(665 nm);
ρc=[1000D(470 nm) -2.05Ca-114.8Cb]/245,
式中,ρa、ρb、ρc分别为叶绿素a,叶绿素b,类胡萝卜素的质量浓度(mg/L)[10]。
1.2.7统计分析 实验数据采用Excle2010和SPSS软件进行方差分析和多重比较,多重比较结果采用标记字母法,各平均数间凡有一个相同标记字母的即为差异不显著(α=0.05)。
2 结果
2.1 Mg2+对波吉卵囊藻相对增长率的影响
图1显示不同Mg2+浓度下波吉卵囊藻的生长情况,由生长曲线可知,波吉卵囊藻培养前期的1~2 d,曲线斜率较缓,之后曲线斜率较大,进入快速生长期。0~2 d,各组细胞生物量差异不明显,4 d时,Mg2+质量浓度为1 mg/L和2 mg/L的组别藻细胞生物量逐渐高于其他组,8 d以后,这种趋势更加明显,波吉卵囊藻的生物量显著增加,说明Mg2+质量浓度为1~2 mg/L时是波吉卵囊藻生长的最适浓度,大于 4 mg/L时对波吉卵囊藻的生长起抑制作用。
由图2相对增长率K值可知,随着Mg2+浓度升高,K值呈现先升高后降低趋势,在Mg2+质量浓度为2 mg/L时,促进作用最强,K值达到峰值,较对照组升高了18.5%。ANOVA结果显示,不同Mg2+浓度组别之间其K值差异达极显著水平(F=478.942,P< 0.01)。Duncan多重比较结果显示,各组之间均具有显著差异。Mg2+质量浓度在2 mg/L时差异最显著,波吉卵囊藻生长最快,是波吉卵囊藻生长的最适浓度,Mg2+质量浓度> 4 mg/L时,波吉卵囊藻的生长受到显著抑制。

图1 不同Mg2+浓度下波吉卵囊藻的生长曲线Fig.1 The growth curve of Oocystis borgeiunder different concentration of Mg2+

图2 不同Mg2+浓度下波吉卵囊藻的相对增长率KFig.2 The relative growth rate of Oocystis borgei under different concentration of Mg2+
2.2 Mg2+对波吉卵囊藻色素蛋白含量的影响
图3显示,随着Mg2+浓度升高,波吉卵囊藻叶绿素a含量呈先升高后降低的趋势。在Mg2+质量浓度为2 mg/L时含量最高,1 mg/L时次之,大于4 mg/L时叶绿素a合成受到抑制。ANOVA结果显示,不同Mg2+浓度组别之间其叶绿素a含量差异达极显著水平(F=343.746,P< 0.01)。Duncan多重比较结果显示,各组之间均具有显著差异。Mg2+质量浓度在2 mg/L时较其他各组差异最显著。
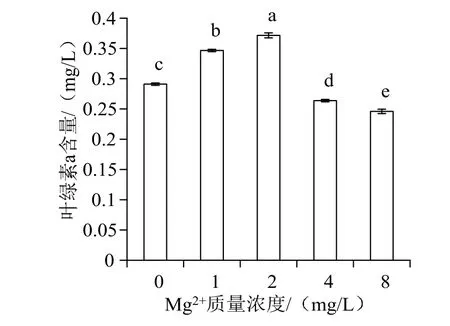
图3 不同Mg2+浓度下波吉卵囊藻叶绿素a含量变化Fig.3 Changes of chlorophyll a content of Oocystis borgei under different concentration of Mg2+
图4显示,随Mg2+浓度升高,波吉卵囊藻类胡萝卜素含量呈先升高后降低趋势。在Mg2+质量浓度为2 mg/L时类胡萝卜素含量最高。ANOVA结果显示,不同Mg2+浓度组间类胡萝卜素含量差异达极显著水平(F=1 162.839,P< 0.01)。Duncan多重比较结果显示,Mg2+质量浓度在2 mg/L时波吉卵囊藻类胡萝卜素含量最高,但Mg2+质量浓度在1~2 mg/L时差异不显著;Mg2+质量浓度为4~8 mg/L时,波吉卵囊藻类胡萝卜素含量最低,且无显著差异。

图4 不同Mg2+浓度下波吉卵囊藻类胡萝卜素含量变化Fig.4 Changes of carotenoid content of Oocystis borgei under different concentration of Mg2+
2.3 Mg2+对波吉卵囊藻多糖含量的影响
如图5显示,随着Mg2+浓度的升高,单个藻细胞中胞内多糖含量呈现先升高后降低的趋势,但均高于对照组。ANOVA结果显示,不同Mg2+浓度组别之间其胞内多糖含量差异达极显著水平(F=202.004,P< 0.01)。Duncan多重比较结果显示,各组之间均具有显著差异。Mg2+质量浓度为4 mg/L时较其他各组差异最显著。

图5 不同Mg2+浓度下单个藻细胞中胞内多糖含量变化Fig.5 Changes of intracellular polysaccharides in single algae cell under different concentration of Mg2+
如图6显示,随着Mg2+浓度升高,波吉卵囊藻单个细胞中胞外多糖含量呈现不断升高趋势,当Mg2+质量浓度为8 mg/L时,单个藻细胞中胞外多糖含量最高,达0.070 pg。ANOVA结果显示,不同Mg2+浓度的组别之间其胞外多糖含量差异达极显著水平(F=457.360,P< 0.01)。Duncan多重比较结果显示,各组之间均具有显著差异。Mg2+质量浓度在8 mg/L时较其他各组差异最显著。

图6 不同Mg2+浓度下单个藻细胞中胞外多糖含量变化Fig.6 Changes of extracellular polysaccharide in single algae cell under different concentration of Mg2+
2.4 Mn2+对波吉卵囊藻相对增长率的影响
图7可知,培养0~2 d时,各组生物量无明显差异,但2 d后,Mn2+质量浓度为0.005 mg/L时,对波吉卵囊藻的生物量有促进作用,但Mn2+质量浓度 > 0.005 mg/L的组别均出现藻体变黄色、藻体生长受到显著抑制和大量死亡的现象,虽然测得D值相比对照组有所升高,但可以明显看出是因为藻体死亡使藻液浑浊导致的,因此波吉卵囊藻生长的最适Mn2+质量浓度为0.005 mg/L。
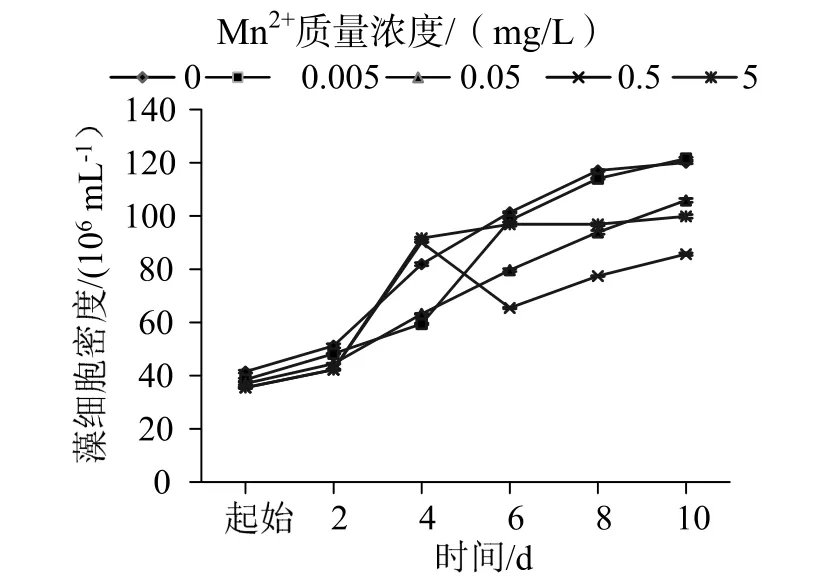
图7 不同Mn2+浓度下波吉卵囊藻的生长曲线Fig.7 The growth curveof Oocystis borgeiunder different concentration of Mn2+
由图8可知,随着Mn2+浓度升高,K值呈现先升高后降低趋势,在Mn2+质量浓度为0.005 mg/L时,K值有所升高,Mn2+质量浓度 > 0.05mg/L时K值显著降低,对波吉卵囊藻的生长呈现抑制作用。ANOVA结果显示,不同Mn2+浓度组间其K值差异达极显著水平(F=457.360,P< 0.01)。Duncan多重比较结果显示,各组之间均有显著差异。Mn2+质量浓度为5 mg/L时较其他各组差异最显著。

图8 不同Mn2+浓度下波吉卵囊藻的相对增长率KFig.8 The relative growth rate of Oocystis borgei under different concentration of Mn2+
2.5 Mn2+对波吉卵囊藻色素蛋白含量的影响
如图9显示,随着Mn2+浓度升高,波吉卵囊藻的叶绿素a含量呈现先升高后降低趋势。在Mn2+质量浓度为0.005 mg/L时促进作用最强,叶绿素a质量浓度达0.35 mg/L。ANOVA结果显示,不同Mn2+浓度的组别之间其叶绿素a含量差异达极显著水平(F=1 162.839,P< 0.01)。Duncan多重比较结果显示,各组之间均具有显著差异。Mn2+质量浓度为0.005 mg/L时较其他各组差异最显著。
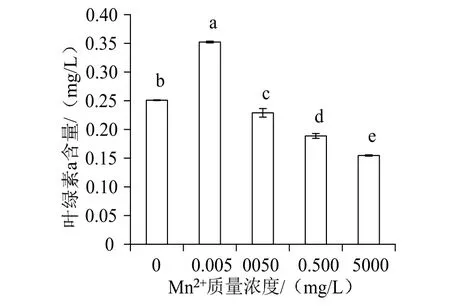
图9 不同Mn2+浓度下波吉卵囊藻叶绿素a含量变化Fig.9 Changes of chlorophyll a content of Oocystis borgei under different concentration of Mn2+
如图10显示,随着Mn2+浓度的升高,波吉卵囊藻的类胡萝卜素含量呈现先升高后降低的趋势。在Mn2+质量浓度为0.005 mg/L时促进作用最强,类胡萝卜素质量浓度达0.19 mg/L。ANOVA结果显示,不同组别之间其类胡萝卜素含量差异达极显著水平(F=150.695,P< 0.01)。Duncan多重比较结果显示,各组之间均具有显著差异。Mn2+质量浓度为0.005 mg/L时较其他各组差异最显著。

图10 不同Mn2+浓度下波吉卵囊藻类胡萝卜素含量变化Fig.10 Changes of carotenoid content of Oocystis borgeiunder different concentration of Mn2+
2.6 Mn2+对波吉卵囊藻多糖含量的影响
如图11显示,随着Mn2+浓度升高,单个藻细胞的胞内多糖含量呈现先升高后降低趋势。ANOVA结果显示,不同Mn2+浓度组别之间其单个藻细胞的胞内多糖含量差异达极显著水平(F=138.836,P< 0.01)。Duncan多重比较结果显示,Mn2+质量浓度在0.005 mg/L时,单个藻细胞的胞内多糖含量显著高于其他各组,Mn2+质量浓度在0.5~5 mg/L时单个藻细胞的胞内多糖含量无显著差异。

图11 不同Mn2+浓度下单个藻细胞中胞内多糖含量变化Fig.11 Changes of intracellular polysaccharides in single algae cell under different concentration of Mn2+
图12显示,随着Mn2+浓度升高,单个藻细胞的胞外多糖含量呈现不断升高趋势,当Mn2+质量浓度为5 mg/L时单个藻细胞的胞外多糖含量达到峰值,为0.095 pg。ANOVA结果显示,不同组别之间,其单个藻细胞的胞外多糖含量差异达极显著水平(F=330.255,P< 0.01)。Duncan多重比较结果显示,各组之间均具有显著差异。Mn2+质量浓度在5 mg/L时,单个藻细胞的胞外多糖含量显著高于其他各组。

图12 不同Mn2+浓度下单个藻细胞中胞外多糖含量变化Fig.12 Changes of extracellular polysaccharide in single algae cell under different concentration of Mg2+
3 讨论
3.1 Mg2+对波吉卵囊藻生长的影响
Mg是植物生长的必需元素。Mg参与了物质吸收与运转、光合作用和蛋白质合成,在植物体内,Mg是许多酶的活化剂,其中特别是与碳水化合物的代谢,磷酸转化以及脱羧作用关系密切[17~19]。同时,Mg也是叶绿素重要组成元素之一,Mg的增加有利于藻类合成更多的叶绿素[6,20]。郭丽丽等[6]研究显示,Mg缺失时,铜绿微囊藻的生长会受到显著的抑制,较高质量浓度的Mg(> 5 mg/L)也会抑制铜绿微囊藻的生长。王珊等[21]研究显示,在缺镁胁迫条件下,普通小球藻的生物量和叶绿素a含量分别降低了20%和27.52%。
本研究结果表明,随着Mg2+浓度增加,波吉卵囊藻的相对增长率、叶绿素a含量和类胡萝卜素含量均呈现先升高后降低的变化趋势,其中在Mg2+质量浓度为2 mg/L时促进作用最强,是波吉卵囊藻生长的最适浓度。因此,低质量浓度Mg2+(0~2 mg/L)能够促进波吉卵囊藻的生长和色素蛋白的合成,当Mg2+质量浓度超过一定限度(> 4 mg/L)则会抑制波吉卵囊藻的生长和色素蛋白的合成。在我国珠江三角洲、长江三角洲、江苏、渤海湾等河口、半咸水或低盐度地带地区,常常因为某些离子元素缺少,导致其水体环境不稳定,易发生变化,限制了波吉卵囊藻的定向培育,危害对虾的健康养殖。因此,在低盐度或淡化养殖模式中,注意Mg2+的添加,从而保证藻类种群的稳定,保持生态系统的动态平衡和良好的养殖环境,使对虾能够健康生长。
3.2 Mg2+对波吉卵囊藻多糖合成的影响
Mg作为合成叶绿素的重要元素,会影响光合作用,藻类通过光合作用合成有机物,除用于呼吸作用外,大部分转化为蛋白质、脂类、核酸等物质,其余部分则以多糖形式存留在细胞中或者分泌到细胞外,Mg浓度增大有利于微囊藻合成更多叶绿素从而合成更多糖类[6],且藻类胞外多糖中含有相当质量浓度的Mg[22-23]。郭丽丽等[6]研究发现Mg在适宜质量浓度(5 mg/L)会促进铜绿微囊藻合成多糖总量增加,抑制多糖分泌、防止多糖溶解。赵荣芳等[24]研究发现水动力作用下镁离子促进铜绿微囊藻胞外多糖的分泌,有利于微囊藻群体形成,以降低外界环境对自身的影响,从而适应环境变化。从本实验结果来看,随着Mg2+浓度增加,各实验组胞内多糖含量表现为先升高后降低的趋势,相比对照组均有明显增加,当Mg2+质量浓度为2 mg/L时,其胞内多糖合成量是对照组的1.1倍,Mg2+的添加有利于胞内多糖储存,以便在受到环境胁迫时分泌。各实验组胞外多糖的含量表现为不断升高趋势,当Mg2+质量浓度为2 mg/L时,其胞外多糖的合成量是对照组的1.2倍,且Mg2+浓度越高,胞外多糖增加量越高,Mg2+质量浓度为8 mg/L时合成的胞外多糖含量是对照组的2.4倍。因此可以得出,有Mg2+添加的培养液比不添加Mg2+的培养液更有利于波吉卵囊藻胞内外多糖的合成,且Mg2+浓度越高,越有利于胞外多糖合成,以帮助藻类在不良环境下生存。
3.3 Mn2+对波吉卵囊藻生长的影响
Mn2+作为藻类生长必需的离子之一,是生物体进行光合作用的催化剂,对有氧呼吸产生的氧化产物有去毒的作用。对糖酵解中的某些酶如己糖磷酸激酶、烯醇化酶、羧化酶有活化的作用,也是三羧酸循环中某些酶如异柠檬酸脱氢酶、α-酮戊二酸脱氢酶和柠檬酸合成酶等的活化剂,在生成ATP方面也起功能性作用。适量Mn2+可加快藻类光合速率,在光合作用方面,水的光解需要Mn2+参与,也是叶绿体的结构成分,缺少时,叶绿体结构会被破坏,甚至解体[8,25]。相关研究显示,Mn有自己的浓度极限,低浓度时促进藻的生长,高浓度时则抑制藻的生长[10,25-28],适量锰可加快藻类光合速率[29]。5.5×10-6mg/L的Mn2+浓度已经接近于铜绿微囊藻对Mn2+耐受的极限[8],0.018~0.036 mg/L的Mn2+质量浓度下亚历山大藻LC3可获得较快生长速 率[28],Rai等[26]报道,2 mg/L的锰对微襄藻有中度毒性,3.1 mg/L的锰可使月芽藻体积减少5%,在50 mg/kg的锰溶液中,小球藻体积减少5%。从本实验结果来看,随着Mn2+浓度增强,波吉卵囊藻的相对增长率呈现先升高后降低的趋势,且质量浓度 > 0.005 mg/L的组别藻体在生长第二天就出现变黄,水体变浑浊的现象。且波吉卵囊藻的叶绿素a含量、类胡萝卜素含量都呈现先升高后降低的趋势。推测是因为低浓度Mn2+促进波吉卵囊藻的代谢过程、促进光合作用和色素蛋白的积累,而过高的Mn2+浓度则抑制波吉卵囊藻的色素蛋白合成、破坏叶绿体结构,对波吉卵囊藻生长起到了抑制作用,甚至导致藻体死亡。因此在波吉卵囊藻的定向培育中,要注意Mn2+添加的量,将Mn2+浓度控制在< 0.005 mg/L的范围内,可在一定程度上促进波吉卵囊藻生长和色素蛋白的合成。
3.4 Mn2+对波吉卵囊藻多糖合成的影响
锰作为藻类生长必需的元素之一,可以活化细胞内的一系列酶反应,如水解反应、还原反应、磷酸化和脱羧基作用等,促进多余的蛋白质、脂类等转化为多糖的形式存留在细胞中形成胞内多糖,或者分泌到细胞外形成固着性胞外多糖或溶解性胞外多糖,而过量的Mn2+又会形成高盐胁迫造成生物量下降、作物减产等[6,30-31]。
本实验结果来看,随着Mn2+浓度增加,波吉卵囊藻胞内多糖含量呈现先升高后降低趋势,当Mn2+质量浓度为0~0.005 mg/L时,能够促进波吉卵囊藻胞内多糖合成,有利于储备大量胞内多糖,以便一旦藻体生长受到胁迫可大量分泌到细胞外,对藻体起到保护作用。随着Mn2+浓度增加,波吉卵囊藻的胞内多糖含量呈现先升高后降低趋势,当Mn2+质量浓度为0.005 mg/L时,波吉卵囊藻生长良好,此时其胞内多糖含量是对照组的1.1倍,波吉卵囊藻在环境适宜时,有利于其胞内多糖的产生和储存,以便在受到胁迫时分泌。当处于Mn2+质量浓度 > 0.005 mg/L 时的胁迫环境时,波吉卵囊藻的胞内多糖含量有所降低,是在胁迫环境下藻细胞破裂胞内多糖分泌到细胞外导致的。陈国元等[32]研究表明,铜绿微囊藻在受到东方香蒲毒性胁迫时,化感效应随培养时间加剧,藻细胞内类囊体结构破碎,藻的光合系统被严重破坏,光合活性和光合效率降低,抑制多糖合成,进一步促进多糖分泌和溶解,造成胞内多糖含量急剧降低,溶解性胞外多糖含量急剧增加的现象。
本实验结果显示,波吉卵囊藻的胞外多糖随Mn2+浓度增加呈现不断升高的趋势,当Mn2+质量浓度为0.005 mg/L时,其胞外多糖的合成量是对照组的2.3倍,当Mn2+质量浓度为5 mg/L时,其胞外多糖含量是对照组的3.36倍,因此,相比适宜浓度,高浓度Mn2+形成的胁迫环境更能够促进其胞外多糖分泌,以保护藻体不受伤害。因此,在波吉卵囊藻的定向培育中要注意将Mn2+浓度控制在合理范围内。
3.5 多糖产生与波吉卵囊藻抗逆性的关系
有研究显示,微藻的胞外多聚物主要由多糖构成[33-36]。杨州等[37]研究显示,微囊藻单细胞在原生动物鞭毛虫诱发下,其单细胞表面粘性增强,胞外多聚糖(extracellular polysaccharides)含量增高,诱发单细胞微囊藻重新形成由数十个到数百个细胞组成的防御性群体的方式防御牧食,因此胞外多糖有利于藻类形成防御性的群体,提高其在胁迫环境的抗性。
大量研究[38-42]发现,藻细胞中蛋白质的含量与生长率呈显著正相关关系。即外界生长环境较好时,藻类倾向于合成蛋白质等物质保证藻细胞的分裂。相反,当受到外界环境胁迫时,藻类则不能够合成充分的蛋白质等物质,此时多糖含量相对较高。当球等鞭金藻超过其生长盐度适应范围时,其胞内多糖和胞外多糖含量急剧降低,均不足适宜盐度时的5%[43]。当极大螺旋藻438受到强度为7 000 lx的极端照度胁迫时,胞内多糖含量增加,是生长适宜照度的1.1倍,胞外多糖含量增加为生长适宜照度时的1.75倍[44]。本实验结果表明,当Mg2+质量浓度为8 mg/L时,波吉卵囊藻的K值显著降低,生长受到显著抑制,而胞内多糖的合成量是对照组的1.21倍,胞外多糖的合成量是对照组的2.43倍。当Mn2+质量浓度为5 mg/L时,波吉卵囊藻的生长受到明显抑制,而此时胞外多糖含量是对照组的3.36倍。可以明显看出,在胁迫环境下,当Mg2+或Mn2+浓度过高时,波吉卵囊藻的生长受到抑制,藻细胞内碳水化合物转化为蛋白质等其他物质的比例减少,转化为胞外多糖含量的增加,使波吉卵囊藻具有较强的抗逆性。
