医用高分子材料抗凝血表面构建策略及研究进展
2021-04-10施德安石恒冲
栾 轲,班 雨,施德安,石恒冲
(1.湖北大学材料科学与工程学院,高分子材料湖北省重点实验室,武汉 430062;2.中国科学院长春应用化学研究所,高分子物理与化学国家重点实验室,长春 130022)
在医学领域中,医用高分子材料及医疗器械主要用于诊断和治疗,每天有成千上万的病人使用血液接触类器械,如血液透析循环管路、中心静脉导管、心脏支架、血管移植物、心脏瓣膜等[1]。该类器械直接与血液接触时会发生一系列反应,血浆蛋白首先会瞬间在材料表面吸附形成血浆蛋白,然后血小板会在血浆蛋白表面黏附、聚集,进而使血小板激活、凝血级联及补体激活,最终导致血栓形成[2]。据美国食品药品管理局(FDA)统计,2016年美国此类医疗器械的市场销售额约为90亿美元,但在心脏支架的使用过程中由于血栓形成导致的死亡率高达80%,严重威胁着人类的健康及生命安全[3]。临床上,通常需要口服抗血小板药物或抗凝剂来抑制器械表面血栓形成,但同时会增加出血的风险。因此,在材料/器械表面设计及构建安全和有效的抗凝血表面至关重要。
本文概述了高分子材料/器械表面凝血和血栓形成的过程及相关机制,并总结了目前常见的4种抗凝血表面构建策略,主要有生物惰性涂层、生物活性涂层、具有内皮(EC)特异性生长因子的表面涂层和复合抗凝涂层,同时展望了未来材料/器械抗凝血表面构建的发展趋势[4]。
1 凝血机理及血栓形成
血液接触类医疗器械接触血液时,血浆蛋白会在几秒钟内吸附到材料/器械表面,并与血小板上的糖蛋白受体结合,导致血小板活化、凝血级联以及补体激活,最终形成血栓[5],从而导致器械失效。
1.1 血浆蛋白吸附
血浆蛋白是血浆中最主要的成分之一,质量浓度为60~80 g/L。当血液与生物材料相互接触时,会在其表面瞬间形成一层血浆蛋白吸附黏膜。被吸附的血浆蛋白可形成厚度2~10 nm的单层,其表面蛋白浓度比血浆中的浓度高1 000倍[3-6]。纤维蛋白原是最早沉积在血液接触类器械上的血浆蛋白之一,其他黏附蛋白吸附在器械表面,并与纤维蛋白原共同作用,引发血小板的黏附与聚集[7]。
1.2 血小板的黏附与聚集
血小板是血栓形成的重要组成部分,在正常血液中血小板是一种质量浓度为150×106~450×106g/mL的无核血细胞[6,7]。吸附在血液接触类器械上的纤维蛋白原会进一步激活血小板,导致血小板活化以及形状变化[8,9]。这些活化的血小板为凝血酶的生成创造了一个巢穴,加快了凝血酶的生成[10]。
1.3 凝血酶的生成
凝血酶是一种丝氨酸蛋白酶,也是血液凝血级联反应中的主要蛋白酶。血小板在血液接触类器械表面黏附与聚集后,会进一步释放凝血因子XII(FXII)、高分子量激肽原和前激肽释放酶。被吸附的FXII经过自激活成为凝血因子XIIa(FXIIa),并激活前激肽释放酶[11]。起辅助作用的高分子量激肽原会与器械表面结合,进一步激活FXII,使得前激肽释放酶激活导致激肽释放酶的产生,从而以相互作用的方式激活更多的FXII。FXII的激活引发一系列蛋白水解反应,最终形成凝血酶从而引发了下一步补体系统的激活[12]。
1.4 补体系统的激活
补体系统是先天免疫系统的一部分,由近40种成分组成,多数组分为糖蛋白,主要组分有三碳糖磷酸(C3)、五碳糖磷酸(C5)等,能增强机体对病原体和细胞碎片的清除能力[13]。当血液接触类器械表面形成凝血酶后,产生的前激肽释放酶裂解FXIIa生成酶b-FXIIa,酶b-FXIIa会使补体系统初步被激活,导致C3和C5沉积在器械表面。由此产生的磷酸片段可促进白细胞黏附于器械表面并随后激活,从而导致血液接触类器械表面的凝血以及血栓形成[7-9]。
2 涂层表面构建策略
为了赋予材料表面抗凝血性能,需有针对性地设计和构建抗凝血表面。目前构建策略主要分为以下4类:生物惰性涂层、生物活性涂层、具有EC特异性生长因子的表面涂层和复合抗凝涂层。
2.1 生物惰性涂层
生物惰性涂层可以阻止血液与器械表面之间的相互作用,尤其是非特异性蛋白质吸附。目前主要有两种构建方法:(1)构建聚乙二醇(PEG)或两性离子聚合物等亲水刷或水凝胶,抑制蛋白质、血小板等的吸附。(2)构建滑移表面,抑制水或血液润湿从而阻碍蛋白质、血小板等在材料/器械表面吸附。上述两种方法都能有效减少血浆蛋白和血小板在材料表面的黏附,并减轻材料表面非特异性吸附引起的各种不良反应,有效提高材料表面的生物相容性及抗凝性[3, 4, 14]。
2.1.1 PEG PEG是安全、无毒、且具有良好生物相容性的聚合物,同时具备较好的生物惰性和优异的亲水性,是常用于构建血液接触类医疗器械抗凝表面的聚合物之一。基于PEG的表面改性方法有:物理吸附法、共价接枝法和化学偶联法。共价接枝法由于操作简单、方便且接枝后性能优异、稳定,因此是目前较常见的方法[15-17]。其抗凝机制主要是,在高分子材料表面接枝一定密度和链长的PEG后,带中性电荷的亲水性PEG聚合物链会与水分子结合并在其表面形成水化层,从而抵抗蛋白质和血小板的非特异性黏附,起到抗凝血和抗菌的双重作用[18,19, 20]。
Kovach等[21]通过氧气等离子体预处理和PEG接枝的方法对聚二甲基硅氧烷(PDMS)微流控网络进行表面抗凝改性,最终得到了修饰后的PDMS抗凝表面。实验表明,PEG接枝物纤维蛋白原的吸附和血小板黏附显著降低,而无涂层的PDMS微通道网络可快速吸附血液接触器械中的纤维蛋白原,纤维蛋白原吸附导致血小板活化,并导致凝血现象。结果表明,修饰后的PDMS微通道涂层展现出了较好的血液相容性及抗凝性,可望应用到更多的血液接触类器械涂层(如图1所示)。
尽管PEG涂层在短期应用中展现出了较好的非特异性黏附和抗凝性,但在长期体内实验中,该涂层表面的链段易被氧化分解,且PEG层的链长和表面密度逐渐减少[22,23],更适合短期使用的血液接触类器械。
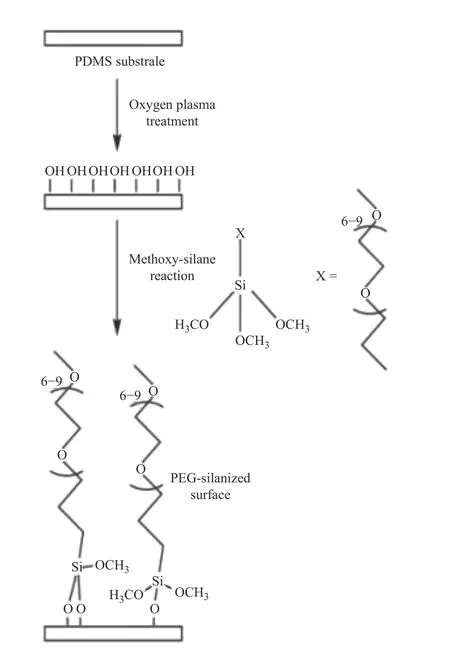
图1 氧等离子体处理过的PDMS表面经甲基硅氧烷偶联反应接枝PEG示意图[21]Fig.1 Schematic diagram of the PEG grafting reaction between methoxysilane molecules and the surface of PDMS treated with oxygen plasma[21]
2.1.2 两性离子聚合物 两性离子聚合物的长链上具有相等数量的阴离子和阳离子基团,这种结构使它们具有高度的亲水性,并可对抗蛋白质和血小板非特异性黏附[24]。两性离子聚合物主要为甜菜碱聚合物,这类聚合物的正负电荷分布在同一单体上,又可分为磷酸盐甜菜碱、磺酸盐甜菜碱和羧酸盐甜菜碱[25]。其抗凝机制与PEG一致,两性离子聚合物在与医疗器械接触时会在表面形成致密水化层,该水化层可抑制蛋白、血小板和人体细胞的黏附与聚集,从而使器械表面具有优越的抗蛋白吸附能力和抗凝血性能[26]。
Smith等[27]提出通过氧化-还原聚合反应表面接枝手段将外周静脉导管(PICC)浸入含有两性离子聚合物磺基甜菜碱(PolySB)的溶液中反应16 h,从而对PICC的内外表面进行改性,最终得到具有抗凝功能的外周静脉导管。实验表明,与未被修饰的PICC相比,经PolySB修饰的PICC在体外接触人体血液后,血小板、淋巴细胞、单核细胞和中性粒细胞的活性显著降低,其附着性降低98%。此外,将改性过的PICC放置在牛血中60 d,PICC周围并无血栓聚集。结果表明,改性后的PICC展现出了较好的抗凝性,与PEG相比PolySB具有较好的氧化稳定性和亲水性,更适合长期应用(如图2所示)。
2.1.3 滑移表面 近年来,滑移表面由于其在高分子材料领域中具有良好的抗非特异性黏附和抗凝抗菌多重功能而广受关注[28]。Leslie等[29]受猪笼草实验的启发,通过将全氟润滑剂吸到聚四氟乙烯多孔材料中,首次成功制备出“滑移表面”。滑移表面的制备原理主要是通过全氟碳化物渗透多孔或粗糙的基底,形成稳定、光滑的液体覆盖层[30,31]。由于该表面具有较小的滑移角和接触角滞后值,因此具有优异的滑移性能,能防止水或血液在表面润湿,从而阻碍蛋白质和血小板的吸附,因此滑移表面具有优异的抗凝抗菌性能[32-34]。
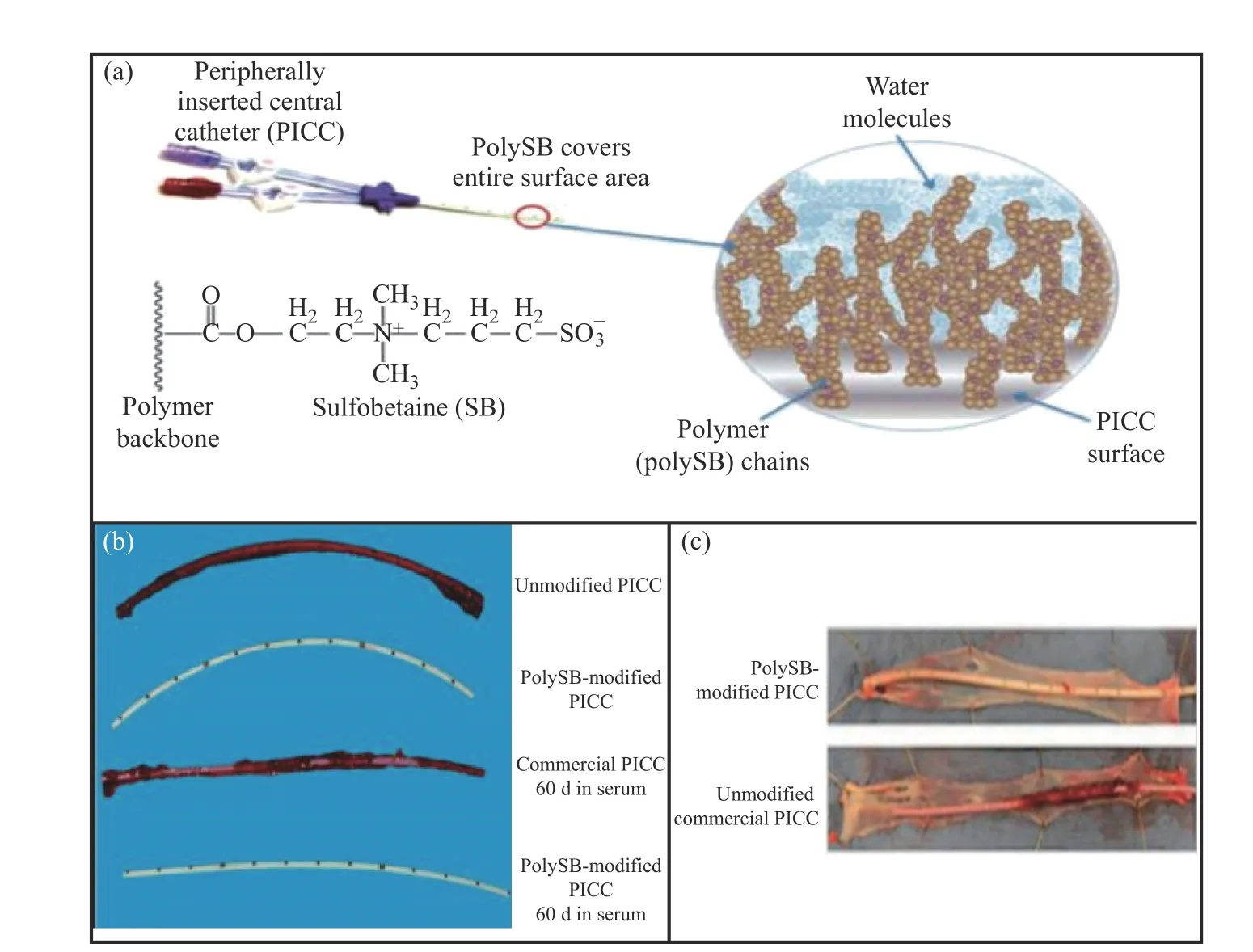
图2 (a)PICC表面的PolySB亲水改性;(b)将经PolySB涂层的PICC和未被涂层的PICC置于流动血清中,经60 d后测得的不同PICC中血栓形成情况;(c)PICC样品在犬血栓模型中的血栓形成情况[27]Fig.2 (a) PolySB hydrophilic modification of PICC surface; (b) Placing the PICC coated with PolySB and the uncoated PICC in the serum, the accumulation of thrombus in different PICCs measured after 60 d; (c) Evaluation of PICC samples in canine thrombosis model[27]
Leslie等[29]通过化学键接柔性含氟碳链与全氟液体相互作用形成“滑移”液膜,最终得到了滑移表面,该表面能有效抑制血小板和蛋白的黏附。为了评估此种滑移表面对血小板黏附的影响,他们通过SEM观察了样品接触人血液30 min,与对照表面相比,涂覆在导管后的滑移表面能有效减少血小板的黏附与聚集。结果表明,此种滑移表面能有效降低血小板的黏附与活化,抑制纤维蛋白原的吸附,具有良好的抗凝性(如图3所示)。
殷敬华课题组[35]通过在聚(苯乙烯-b-异丁烯-苯乙烯)弹性体(SIBS)上采用紫外接枝技术,制备出了一种氟碳褶皱表面(FTWS),在此基础上灌注足量的氟碳液体,最终制备出一种具有褶皱结构、氟化物高分子刷接枝的滑移表面(FLIWS)。该表面能有效“捕获”氟油并形成完整、平滑的氟油液膜,从而赋予材料表面优异的抗凝血和抗菌性,其表面纤维蛋白原吸附量降低了约96%,血小板黏附量极小、凝血指数增大至95%左右,且大肠杆菌和金黄色葡萄球菌的黏附量分别降低了约98.8%和96.9%,因此该表面具有良好的抗凝性和抗菌性能(如图4所示)。
虽然滑移表面涂层抗凝抗菌性能优异,但滑移层表面不稳定、易蒸发,从而导致抗凝持久性欠佳。为了克服这一局限性,在制备滑移表面时需选择稳定、不易挥发的润滑剂注入材料表面[14]。
2.2 生物活性涂层
在高分子材料表面引入生物活性物质,如肝素、一氧化氮(NO)、抗凝药物等形成生物活性涂层预防凝血和血栓形成,这些活性物质可以选择性吸附或结合特定的生物大分子与血液相互作用及减少凝血酶的产生[5,6,21]。目前最常见的生物活性涂层主要有:肝素钠盐涂层、抗凝药物涂层和一氧化氮涂层。
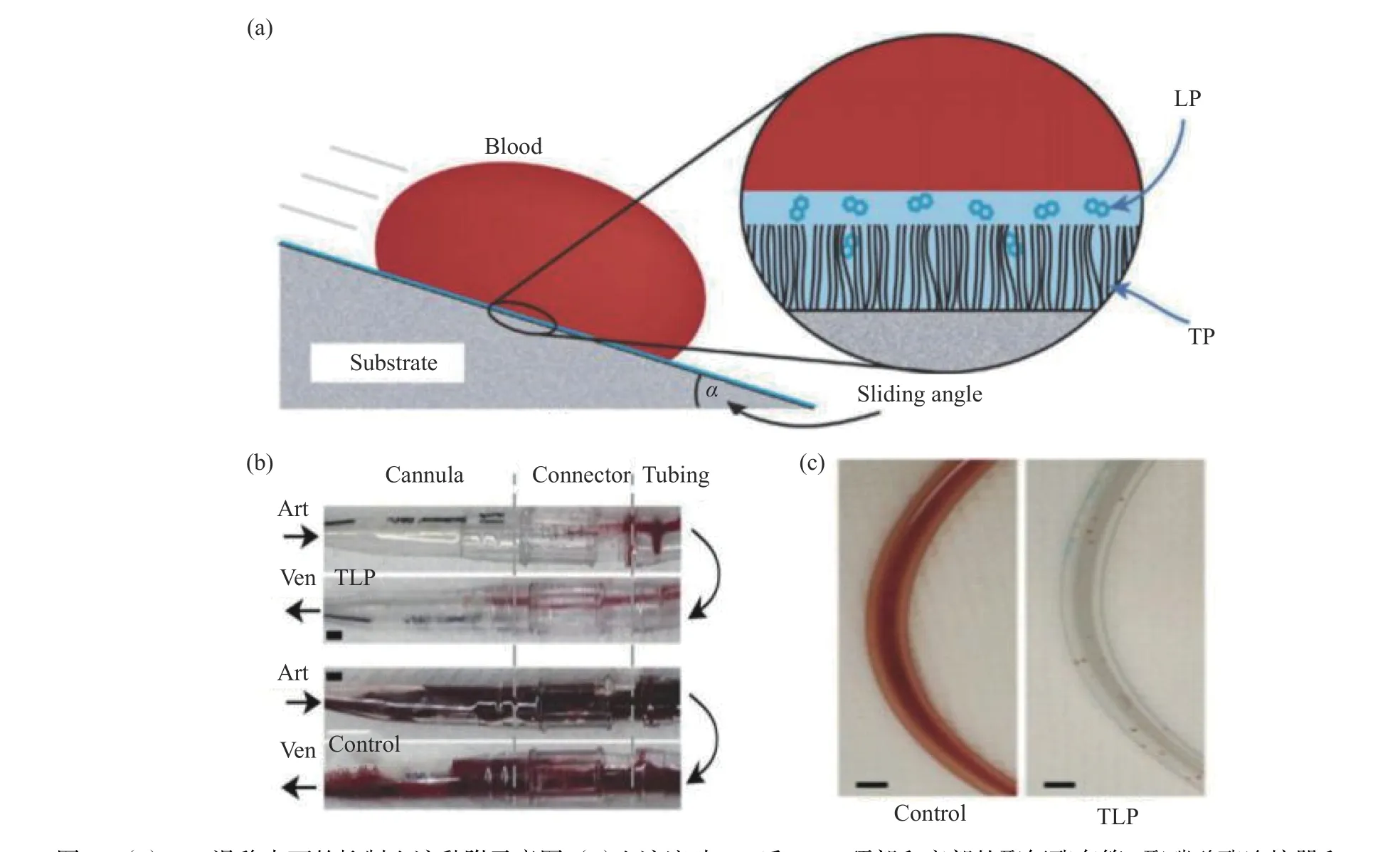
图3 (a)TLP滑移表面的抑制血液黏附示意图;(b)血液流动8 h后,TLP顶部和底部的聚氨酯套管、聚碳酸酯连接器和PVC管血栓流动情况的照片;(c)通入猪血2 min后的对照样品(左)和TLP(右)的心脏灌注管照片[29]Fig.3 (a) Schematic diagram of blood repelling on TLP sliding surface; (b) After 8 h of blood flow, the TLP top and bottom polyurethane cannula, polycarbonate connector and PVC tube thrombus flow photos; (c) Photos of the control (left) and TLP (right) cardiac perfusion tubes after porcine blood was injected for 2 min[29]
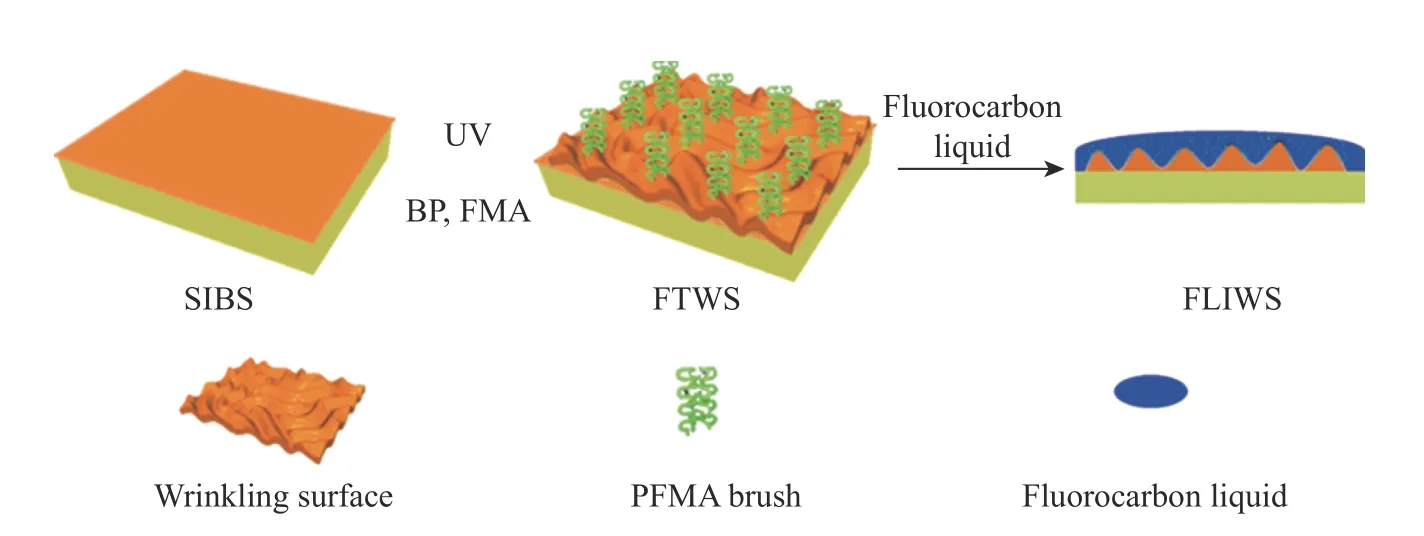
图4 抗凝功能SIBS滑移表面形成过程[35]Fig.4 Formation process of SIBS slip surface with anticoagulation function[35]
2.2.1 肝素钠盐涂层 肝素钠(HS)是一种硫酸氨基葡聚糖钠盐,由不同分子量的糖链组成。其抗凝机制主要通过与凝血酶III(AT-III)结合,增强AT-III对凝血因子的抑制作用,阻止血小板聚集及凝血酶原被激活转变为凝血酶,进而阻碍纤维蛋白原被激活转变成纤维蛋白,从而抑制血栓的形成[36,37]。
Feng等[38]将肝素固定在聚碳酸酯型聚氨酯(PCU)表面,通过在表面接枝PEG形成亲水性钝化层作为间隔臂,该间隔臂能有效减少蛋白质和血小板在PCU表面的黏附并抑制血栓形成,最终制备出了肝素-PEG共价接枝的抗凝涂层。实验证明,PCU薄膜经改性后亲水性和血液相容性显著提高,同时降低了对血小板的黏附。结果表明,生物惰性PEG和生物活性肝素分子协同作用后显著提高了PCU的血液相容性和抗凝性。
Cestari等[39]通过静电纺丝法制备丝素纳米纤维(FS),并在其表面固定HS的方法,使丝素蛋白具有较小的炎症反应和抗凝特性。他们研究了丝素蛋白与肝素之间氢键的形成,证明肝素的固定化是通过丝素蛋白和肝素链之间形成氢键实现的,且能进一步改善血液相容性及抗凝性。
虽然HS抗凝性良好,但由于HS在高分子材料表面固定后生物活性会降低,通常在其表面接枝PEG亲水性钝化层作为间隔臂来提高肝素活性、减少血浆蛋白和血小板的黏附,从而保证其优异的抗凝性能[38,40]。
2.2.2 抗凝药物涂层 具有抗凝机制的药物也可被涂在血液接触器械上以增强抗血栓能力,这些药物包括玉米胰蛋白酶抑制剂(CTI)、血栓调节蛋白(TM)、直接凝血酶抑制剂水蛭素等[5]。CTI、TM和水蛭素都可用于血液接触类医疗器械涂层,CTI是一种从玉米粒中提取的抑制FXIIa的蛋白质,可抑制FXIIa和FXII的自激活,减少血浆蛋白在血液接触类器械表面的沉积。TM是凝血酶的受体,在内皮细胞表面表达,通过调节蛋白复合物结合凝血酶及促进蛋白活化来抑制凝血。水蛭素则是一种小分子蛋白质,通过抑制凝血酶同血小板的结合及血小板受凝血酶刺激后的释放,可达到在血液接触类器械表面的抗凝功能[7,18]。
Qu等[41]将具有生物活性的TM片段包覆在小直径聚氨酯-聚四氟乙烯导管表面,最终得到能有效抑制血栓形成的聚氨酯-聚四氟乙烯涂层。通过用非人灵长类动物模型验证了TM修饰导管的生物活性和生物稳定性,得到稳定的TM涂层并显著减少血小板黏附和活化。结果表明,改性后的聚氨酯-聚四氟乙烯涂层能有效降低血小板活化及蛋白质黏附,具有优异的血液相容性和抗凝性。
虽然TM涂层表面在体外较稳定且能显著降低血小板黏附、活化和血栓形成,但前期处理与保存TM片段及后期合成过程较为繁琐复杂,不易制备[14,41]。
2.2.3 NO涂层 近30年来,NO作为一种重要的信号分子在许多生物过程中被发现,其中包括作为杀菌剂和抗血栓剂的这两种优异性能[38]。其主要是由一氧化氮合酶(NOS)催化氧化L-精氨酸末端胍基中的氮而产生,是正常血管内皮细胞释放的一种舒张血管的重要活性物质,可使血管张力得到调节,维持正常的血液流动[14]。其抗凝机制是:NO经内皮细胞释放后迅速在细胞外液中弥散,并与该受体相结合,激活血小板等靶细胞,促使三磷酸鸟苷环化酶生成环磷酸鸟苷(cGMP),使cGMP的量增加并降低血小板激活所需要的钙离子浓度,从而抑制血小板激活和集聚的功能[42]。
黄楠课题组[43]通过在等离子体聚丙烯酰胺膜(PPAm)的表面胺基上固定凝血酶抑制剂比卢伐定(BLVD)后,再将PPAm浸入甲醇钠的混合溶液同时使用高压反应器通入NO气体,最终得到了具有优异抗凝性能的NO-PPAm涂层。通过体外血小板黏附、纤维蛋白原吸附等一系列实验表明,该涂层显著降低了血小板黏附和活化数量。NO-PPAm涂层制备手段简单安全,具有优异的抗凝性能(如图5所示)。
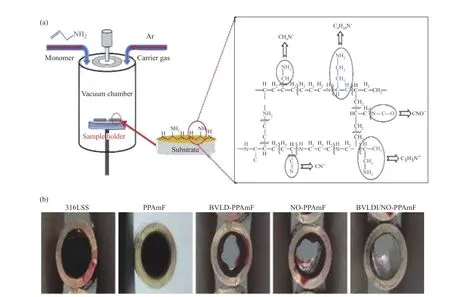
图5 (a)通过丙烯酰胺的脉冲等离子体聚合制备PPAm涂层的示意图;(b)血液循环2 h后样品的横截面图片[45]Fig.5 (a) Schematic diagram of PPAm coating prepared by pulsed plasma polymerization of allylamine; (b) Cross-sectional image of the sample after 2 h of blood circulation[45]
虽然NO作为供体在生物应用中有着良好的抗菌和抗凝性,但其主要缺点就是不稳定易分解且随着时间的推移涂层表面的量逐渐减少。因此,该涂层在长期应用中会失去其抗凝性能[41-43]。
2.3 具有EC特异性生长因子的表面涂层
由动脉、静脉和心脏等组成的血液循环系统称为心血管系统,其中,静脉与动脉一般可以根据组成成分的不同分为3层:外层由成纤维细胞与胶原基质组成,其功能是组成血管的基底并锚定血管的松散结缔组织;中层由I型和III型胶原蛋白及一些蛋白聚糖组成;内皮层(EC)由基膜上的内皮细胞(ECs)、胶原纤维以及平滑肌细胞等组成[44]。内皮由单层内皮细胞组成,这些内皮细胞排列在血管管腔上与血液直接接触,EC在调节炎症和凝块形成中起着至关重要的作用。血管内皮细胞被称为血管的天然内表面,它在各方面都是最好的抗凝表面,其抗凝机制是:带负电荷的ECs可以阻止血小板沉积在内皮表面,并能快速降解血小板自身释放的致聚剂,阻止血小板进一步聚集,从而抑制血栓的形成[45]。
Chen等[46]设计合成了两性离子磺酰胺与丙烯酸的共聚物,并将血管内皮钙黏蛋白(VECad)细胞以化学接枝的手段固定在两性离子-丙烯酸的共聚物链上,通过简单浸涂工艺使其可以稳定地黏附在支架表面,最终得到了两性共聚物的EC抗凝涂层。实验证明,含有VECad负载-两性共聚物修饰的涂层显著降低了血小板黏附和活化的数量,该涂层具有较好的血液相容性和抗凝性。
Zheng等[47]利用ECs对平滑肌细胞(SMCs)的细胞选择性,通过简单浸涂工艺使其可以稳定地黏附在聚四氟乙烯(PTFE)上,最终得到了EC抗凝涂层。由贻贝肽、两性多肽和生物活性肽(REDV和YIGSR)组成了三嵌段功能蛋白,该三嵌段蛋白可在聚四氟乙烯表面形成涂层,所形成的涂层可有效抵抗蛋白质和血小板的黏附,具有较好的抗凝血性(如图6所示)。

图6 三嵌段功能蛋白-聚四氟乙烯涂层示意图[49]Fig.6 Schematic diagram of triblock functional protein-PTFE coating[49]
虽然EC涂层抗凝效果极佳,但在涂层制备前收集和培养ECs的这一过程既昂贵又耗时,因为培养基中产生足够数量的ECs需要长达8周的时间,且在此期间还可能存在被污染的风险[45-47]。
2.4 复合抗凝涂层
复合抗凝涂层是指两种或两种以上不同的物质所构建的涂层[48],如:PEG-HS、生物活性分子-NO等抗凝涂层都属于复合抗凝涂层,其抗凝机制主要是通过两种或两种以上材料协同作用,在高分子材料表面形成复合涂层抑制蛋白质和血小板的黏附与活化,从而达到抗凝的作用。该类涂层由多种材料组成同时具备多种功能,因此颇受青睐[49]。
Lin[50]等将肝素和胶原蛋白通过逐层自组装的方式制备出了肝素-胶原复合膜,该复合膜会紧密包覆在支架内外表面,得到具有抗菌和抗凝双重功能的复合涂层。实验表明,涂层后的支架具有良好的血液相容性且能促进内皮细胞的黏附和增殖。通过肝素-胶原复合膜的改性,可获得具有抗血栓形成性和EC偏好性的支架复合涂层且该涂层在促进血液接触材料的内皮化方面具有较大的潜力。
黄楠课题组[51]将聚氯乙烯(PVC)导管浸泡在金属离子-酚醛/儿茶酚胺的溶液中,金属离子与酚醛/儿茶酚胺会组装成网络结构包覆在PVC导管的内外表面,得到具有抗菌和抗凝双重功能的复合涂层。实验证实,PVC导管表面血小板和细菌的黏附与聚集数量明显少于无涂层样品,且涂层上残留的酚羟基还赋予了表面抗氧化和抗炎活性。金属-酚醛/儿茶酚胺复合涂层不仅具有类似过氧化物酶的催化活性,同时还具有优异的抗菌性能、抗氧化和抗凝血功能。与其他复杂的接枝方法和涂层技术相比,该方法制备简单易于操作,在血液接触类器械中具有广阔的应用前景(如图7所示)。
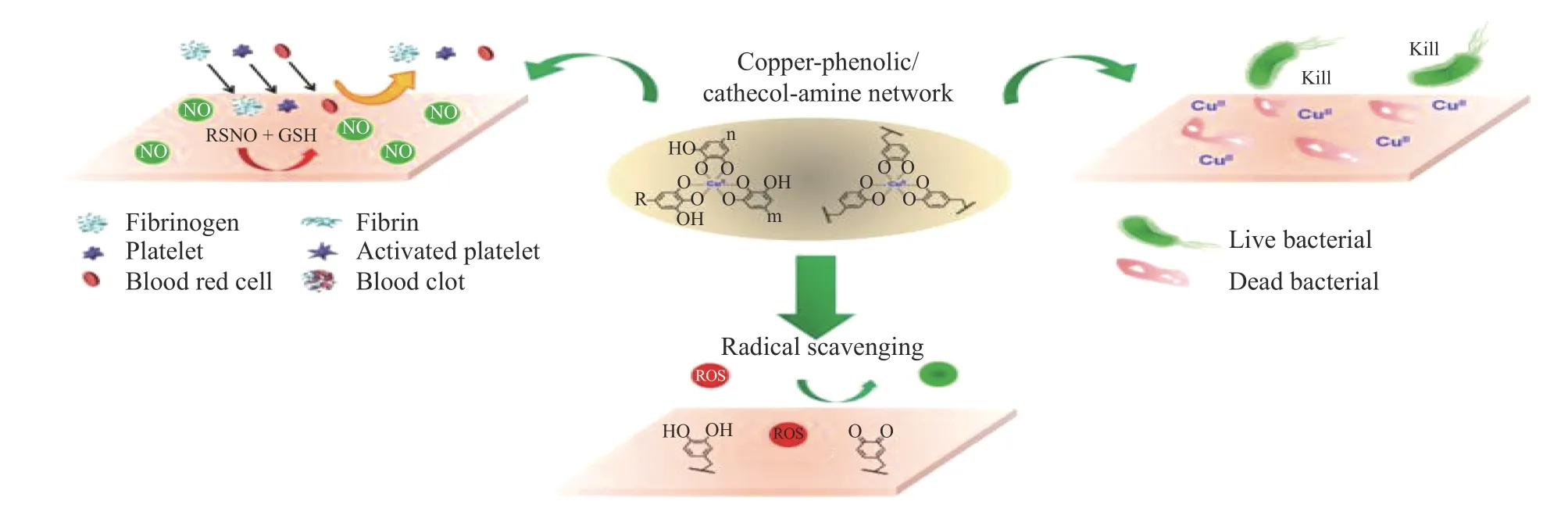
图7 金属-酚醛/儿茶酚胺表面涂层示意图[51]Fig.7 Schematic illustration of metal-phenolic/catecholamine surface coatings[51]
3 展 望
医用高分子材料及器械抗凝血表面构建研究虽取得了一定进展,但目前抗凝血策略仍存在一些不足,亟待在以下3个方面进行突破:(1)材料/器械抗凝表面改性新方法和新技术的建立;(2)材料/器械表面抗凝性能提高的同时,在表面固定的(肝素钠盐、抗凝药物、NO)等生物活性物质以及涂层的稳定性和耐久性对于器械长期应用也十分重要,需要进一步深入探索;(3)加快开发复合型抗凝涂层,如:兼备抗凝血、抗菌等多功能复合涂层。随着人类在生物学、材料学和医学方面的不断进步,期待未来更加高效、廉价和复合型的抗凝血涂层被开发出来。
