一个含有连续氢键的晶态Ni(Ⅱ)-MOF的合成、结构及质子传导性能
2021-04-10李成娟李荣云初芷同刘厚亭王素娜李允伍
李成娟 李荣云 初芷同 刘厚亭 卢 静 王素娜 李允伍
(聊城大学化学化工学院,山东省化学储能与新型电池技术重点实验室,聊城 252059)
0 引 言
近年来,氢燃料电池(HFC)作为一种新型清洁能源因其具有高能量密度、高转换效率、环境友好等优点而受到越来越多的关注[1-3]。质子交换膜(PEM)是燃料电池装置中进行质子转移的组件,是确保电池反应持续进行的重要组成部分之一,其稳定而高效的质子电导率是燃料电池工作效率的决定性因素[4-5]。晶态金属-有机骨架(MOFs)作为一种具有潜在应用价值的新型质子传导材料,因其结构可调性、化学稳定性以及与其他材料复合的可行性而受到越来越多的关注[6-9]。另外,MOFs的易结晶性使得其结构可以被准确地确定,为探索质子传导的结构与性能之间的关系提供可能。因此,越来越多的具有优良质子传导性能的MOFs被合成并报道[10-11]。
目前,人们通常采用3种方法提高MOFs的质子电导率。第一种方法是通过合理的后合成将无机酸(如 H2SO4、H3PO4等)作为客体分子引入 MOFs的多孔框架中,增加材料的酸度[12]。而客体分子的负载通常是通过物理吸附来实现的。客体分子易被浸出,导致材料的质子导电性不稳定。第二种方法是将体积较小的质子载体(如H2O、NH4+、咪唑)作为客体,利用晶体工程原理一步负载到MOFs孔道中[13-15]。这些客体分子或离子可以均匀、稳定地分布在主体框架中。富含质子的客体分子或离子可以增加材料的质子浓度,客体分子或离子之间或与主体骨架之间可以形成连续的氢键。而连续的氢键也是材料发生质子传导的必要条件。因此,通过第二种方法可以得到性能良好、稳定的质子导电材料。但由于适当体积的质子载体种类的限制,第二种方法的应用逐渐减少。第三种方法是利用酸性亲水官能团—COOH、—PO3H、—SO3H等对有机配体进行修饰,以增强材料的酸性、亲水性和形成氢键的机会[16-19]。官能团的位置和数目的可调性使所得到的MOFs质子导电材料更具多样性。所以第三种方法是近年来被最广泛采用的。
众所周知,有机多羧酸配体因其配位能力强、配位方式多样而被广泛应用于构筑MOFs。此外,羧酸基团呈酸性,亲水性强,容易作为氢原子的给体或受体形成氢键,不仅可以作为配位基团,还可以作为修饰官能团。因此,有机多羧酸是构建质子传导MOFs的优良配体[20-22]。柔性的多羧酸配体5,5′-(丁基-1,4-二氧)间苯二甲酸(H4L)的芳环上的4个羧基可呈现丰富多样的配位模式,可与金属离子结合形成稳定的、多样的配位网络。在适当的条件下,多个羧酸基团的羧基氧原子可不完全配位,并参与氢键的形成,提高材料的质子电导率。配体中柔性基团的存在可以在空间上使配体有更多的构象,为合成多样化的配合物结构提供了可能。酚氧原子的存在可提高配体的亲水性,便于材料发生以水为媒介的质子传导。因此,我们选用了H4L为主配体,5-硝基-1,10-邻二氮杂菲(Nphen)为辅助配体,与过渡金属盐Ni(OAc)2在水热条件下反应,成功得到了一个Ni(Ⅱ)-MOF[Ni2(L)(Nphen)2(H2O)4]n(1)。单晶结构分析表明配合物1的晶体结构中含有连续的氢键链,有利于质子传导。电化学交流阻抗分析表明,配合物1与Nafion形成的复合膜表现出了比纯Nafion膜更高的质子传导率。
1 实验部分
1.1 仪器与试剂
H4L购于济南恒化科技有限公司;Nphen购于萨恩化学技术(上海)有限公司;Ni(OAc)2·4H2O购于天津市大茂化学试剂厂。所用化学试剂均为分析纯,实验用水为二次蒸馏水。
所用仪器有红外光谱仪(Nicolet-5700);CHI660D型电化学工作站(上海辰华仪器有限公司)、X射线单晶衍射仪(Agilent Gemini-E)、X射线粉末衍射仪(PXRD,Bruker D8,工作电压为45 kV,电流200 mA,以Cu Kα为辐射源,λ=0.154 2 nm,扫描范围5°≤2θ≤60°)。
1.2 配合物[Ni2(L)(Nphen)2(H2O)4]n(1)的合成
将 Ni(OAc)2·4H2O(9.95 mg,0.04 mmol)、H4L(4.18 mg,0.01 mmol)、Nphen(2.30 mg,0.01 mmol)和10 mL蒸馏水混合。将混合物搅拌5 min后装入反应釜中,120℃下加热3 d,然后以4℃·h-1的速率降温。将反应后的混合物过滤,用蒸馏水多次洗涤,自然干燥,得绿色块状晶体,产率约为35%(按Ni计算)。元素分析按C44H36N6Ni2O18的计算值(%):C 50.08,H 3.41,N 7.97;实验值(%):C 50.91,H 3.53,N 7.09。 红 外 光 谱 (KBr,cm-1):3 419(brs),1 618(w),1 529(w),1 512(w),1 450(m),1 418(m),1 371(s),1 329(w),1 264(s),1 202(w),1 182(w),1 154(w),1 125(m),1 057(s),1 013(w),908(w),881(w),838(s),816(m),780(w),749(w),724(w),710(m),644(w),474(w),427(w)。
1.3 配合物单晶结构的测定
挑选大小合适的配合物1的单晶,在293(2)K下通过Agilent Gemini-E CCD衍射仪,以Cu Kα(λ=0.154 184 nm)为辐射源进行测定。使用Shelxl-18软件进行单晶解析[23],利用直接法解出化合物的最初结构,采用理论加氢的方式对原子进行加氢,然后进行各向同性精修。解析过程中用最小二乘法F2对结构内非氢原子坐标及各向异性参数进行精修。配合物1的晶体数据见表1,部分键长、键角列于表2。

表1 配合物1的晶体学数据Table 1 Crystal and refinement data for complex 1
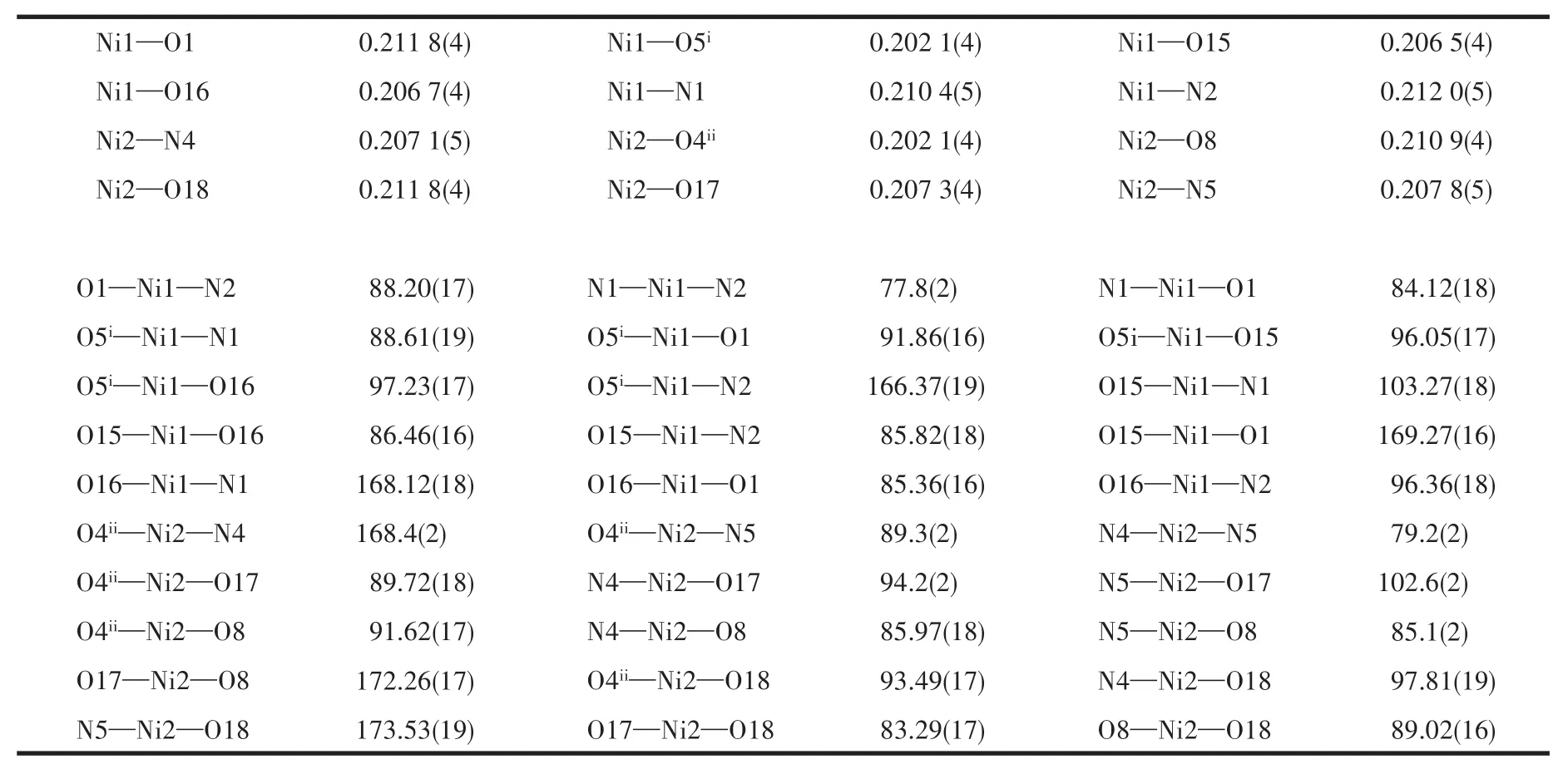
表2 化合物1的主要键长(nm)和键角(°)Table 2 Selected bond lengths(nm)and angles(°)of complex 1
CCDC:2052757。
1.4 质子电导率研究方法
1.4.1 测试系统
使用CHI 660-D电化学工作站对所得化合物的电化学性质进行测试。测试采用三电极体系:工作电极是配位聚合物/Nafion复合膜修饰的玻碳电极,铂片作为参比电极和对电极,用市售的纯净水作为溶剂(电导率为8 µS·cm-1)。
1.4.2 玻碳电极的处理
将玻碳电极在含有0.3µm的Al2O3的湿润麂皮上进行缓慢的打磨处理,用蒸馏水将磨好的电极冲洗干净,在铁氰化钾溶液中进行循环伏安扫描校正,保证每次测量的循环伏安峰电位差在70 mV以下。再用纯净水冲洗干净,并在纯净水中进行阻抗扫描,所有实验尽量保持空电极在0 V条件下的阻值相同。
1.4.3 工作电极的制备
称取球磨好的颗粒度均匀的配位聚合物样品1 mg,加入500µL纯净水,然后超声分散10 min,得到混合均匀的悬浊液。在100µL纯Nafion(质量分数5%)中加入400µL纯净水,充分混合得到Nafion稀释液。分别移取10µL样品悬浊液和10µL Nafion稀释液使其充分混合均匀,取10µL混合液滴在处理好的玻碳电极表面,室温下自然晾干,然后置于60℃的干燥箱中烘干0.5 h。
1.4.4 电导率计算
配合物电导率用公式σ=L/(RS)来计算[24]。σ代表质子电导率;L和S分别代表所测试样品的厚度及横截面积;R是样品的阻值,可以从Nyquist图中得出。
1.4.5 活化能的计算
活化能是通过测试不同温度下的电导率并进行Arrhenius方程的线性拟合获得的。质子的电导率遵循Arrhenius方程[25]:σ=σ0exp[-Ea/(kT)]。Ea表示活化能,σ0是指前因子,k为玻尔兹曼常数(1.38×10-23J·K-1),T为热力学温度。
2 结果与讨论
2.1 配合物1的晶体结构描述

图1 (a)配合物1的配位环境图;(b)Ni(Ⅱ)与L4-配体形成的一维配位链结构;(c)氢键将1D配位链连接形成的2D超分子层;(d)氢键连接2D超分子层形成的3D超分子网络结构;(e)配合物1中的氢键结构Fig.1 (a)Coordination environment of complex 1;(b)1D coordination chain formed by L4-ligands linking Ni(Ⅱ)cations;(c)2D supramolecular layer formed by connecting 1D coordination chains by hydrogen bonds;(d)3D supramolecular network structure formed by hydrogen bonding connecting 2D supramolecular layers;(e)Hydrogen bonding structure in complex 1
配合物1中含有的配位水分子参与形成复杂的氢键。如图1c所示,配位水分子O16与O18分别与同一条配位链内的未配位羧基氧原子O2、O7形成链内氢键 O16—H16A…O2、O18—H18B…O7。每条配位链上的配位水分子O15、O16分别与其相邻链的配位水分子以及未配位羧酸氧原子(O6)形成链间 氢 键 O15—H15A…O16iii、O15—H15B…O6iv和O16—H16B…O6iv。同时配位水分子O17、O18也分别与邻近链的配位水分子及未配位羧酸氧原子(O3)形成链间氢键 O17—H17C…O18v、O18—H18A…O3vi。这些链间氢键将1D配位链沿c轴方向连接形成2D层状结构。2D层中的配位水分子O15、O18也作为氢原子的给体分别与相邻层的未配位的O2、O7形成层间氢键O15—H15A…O2vii、O17—H17A…O7viii。该层间氢键将2D层进一步连接形成3D超分子结构(图1d)。综上分析,来自不同链的配位水分子O15、O16以及未配位的羧基氧原子O2、O6之间形成连续的氢键链,配位水分子O17、O18以及未配位的羧基氧原子O3、O7之间形成六元氢键环,如图1e所示(所有氢键参数参见表3)。配合物1中的晶体结构中存在连续的氢键链,是其发生质子传导行为的有利因素。

表3 配合物1晶体结构中的氢键参数Table 3 Hydrogen bond parameters of complex 1
2.2 配合物1的基本表征
配合物1的红外光谱如图2所示。在3 420 cm-1的宽强吸收峰可归属于配位水分子的νO—H的伸缩振动。1 624~1 377 cm-1的强吸收属于典型的配位羧酸基团的νC=O特征峰。1 730~1 690 cm-1处没有吸收表明有机配体中的所有羧酸基团都脱去质子。红外光谱的研究结果与X射线单晶衍射的分析结果一致。

图2 配合物1的红外光谱图Fig.2 IR spectrum of complex 1
配合物1的PXRD图如图3所示,实验测得的PXRD图与X射线单晶衍射数据的模拟结果一致,说明所得配合物1的固体为纯物质。在研究配合物的质子电导率前,需对配合物的稳定性进行测试。将配合物1分别在室温和80℃的水中浸泡3 d,过滤,晾干,进行PXRD测试。从图3中可以看出,配合物1分别在室温与80℃条件下水中浸泡3 d后它们的PXRD实验衍射峰与模拟峰的位置仍是一一对应的,表明配合物1具有良好的水稳定性。如图4所示,热重分析表明配合物在65~180℃温度范围内失去其配位水分子(测量值6.32%,计算值6.83%),然后配合物在180~300℃围内保持稳定。由此可见,配合物在测试条件下可以保持良好的热稳定性。配合物1良好的水稳定性和热稳定性使它在质子传导测试过程中保持结构稳定,确保得到的质子电导率是可信的,可以准确地反映其质子导电能力。

图3 配合物1的PXRD图Fig.3 PXRD pattern of complex 1
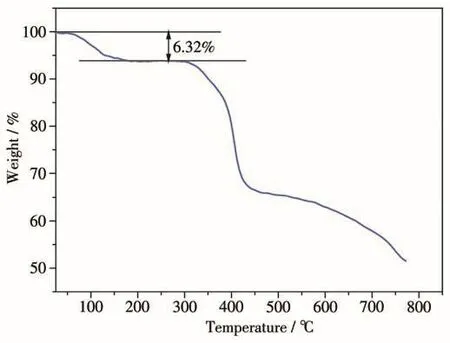
图4 配合物1的TG曲线Fig.4 TG curve of complex 1
2.3 配合物1的质子传导行为
如上所述,在配合物1的晶体结构中存在连续的氢键,有利于质子传导。为了降低固态配合物颗粒间的晶界位阻,更好地反映其质子传导行为,我们将配合物1的颗粒与Nafion混合制作成复合膜1/Nafion。通过复合膜与纯Nafion膜质子电导率的比较来衡量配合物的质子传导行为。这也是近年来被广泛应用于晶态质子导体电导率测量的方法之一[26-28]。
在温度为30℃、扫速为25 mV·s-1条件下分别测试纯Nafion膜和复合膜1/Nafion在水中的循环伏安曲线。图5a为复合膜1/Nafion与纯Nafion膜的循环伏安对比图。从图中可以看出,复合膜的氧化峰位置向负电位移动,还原峰的电流密度明显增大,说明配合物1的掺杂对Nafion膜的质子传导行为有积极的影响。在温度为30℃,不同扫描速率下测试了复合膜在纯净水中的循环伏安曲线。如图5b所示,随着扫描速率不断的增大,氧化峰的电位逐渐向正方向移动,还原峰电位向负方向移动。扫速与氧化还原峰电流密度呈线性关系,表明电极反应为扩散控制,即复合膜的质子转移过程要比扩散过程快。图5c是复合膜修饰的玻碳电极在25 mV·s-1扫速时不同温度下的循环伏安曲线。从循环伏安图中可以看出,随着温度的升高,氧化还原峰电流密度逐渐增大,说明高温有利于质子传导的进行。

图5 (a)纯Nafion膜与复合膜1/Nafion的循环伏安对比图;(b)不同扫速下复合膜1/Nafion的循环伏安图;(c)在25 mV·s-1扫速时不同温度下的复合膜1/Nafion的循环伏安图Fig.5 (a)CV curves of pure Nafion membrane and 1/Nafion composite membrane;(b)CV curves of composite membrane 1/Nafion at different scan rates;(c)CV curves of composite membrane 1/Nafion at different temperatures with scan rate of 25 mV·s-1
测试了频率在1.0×105~1 Hz范围内,开路电压为0 V条件下不同温度时纯Nafion膜与复合膜1/Nafion的交流阻抗图。如图6a和6b所示,随着温度的升高,容抗弧逐渐减小,电阻随着温度的升高逐渐减小。通过电导率的计算公式得出,随着温度的升高电导率逐渐增大。温度为30℃时,复合膜的电导率为0.474µS·cm-1;当温度升到60℃时,电导率为0.804 µS·cm-1(图6d)。与30℃时纯Nafion膜的电导率0.382µS·cm-1相比,掺杂配合物1的复合膜的电导率比纯Nafion膜的高24.08%,因此配合物1的掺杂提高了Nafion膜的质子传导效率。

图6 (a)纯Nafion膜和(b)复合膜1/Nafion在不同温度下的Nyquist曲线;(c)纯Nafion膜和(d)复合膜1/Nafion在不同温度下的电导率图;(e)纯Nafion膜和(f)复合膜1/Nafion的活化能图Fig.6 (a)Nyquist curves of pure Nafion membrane and(b)1/Nafion composite membrane at different temperatures;Proton conductivities of(c)Nafion membrane and(d)1/Nafion composite membrane at different temperatures;Active energy of(e)Nafion membrane and(f)1/Nafion composite membrane
研究表明,质子在固态导体中的传输主要有2种形式[11]:一种是Grotthuss式传导,相邻的质子载体之间通过氢键的断裂与再形成将质子传输,该种模式的传导活化能一般小于0.4 eV;另一种是Vehicular式传导,载体带着质子在通道内扩散,传导活化能一般大于0.4 eV。在人们无法确定质子传输形式的情况下,通常通过质子传导活化能的计算判断材料的质子传导机制。质子传导活化能与质子传导率之间遵循Arrhenius关系式[29]。因此以ln(σT)对1/T作图,即可从直线斜率求得复合膜的质子传导活化能。由图6f可见,复合膜的质子传导行为较好地遵循Arrhenius关系式。通过拟合直线的斜率计算得出复合膜1/Nafion的活化能Ea为0.169 eV,数值低于0.4 eV,说明这是Grotthuss机制的质子转移过程。
3 结 论
选用柔性多羧酸有机配体H4L为主配体、具有亲水性硝基的刚性Nphen为辅助配体与过渡金属Ni(Ⅱ)在水热条件下构筑了一个晶态Ni-MOF[Ni2(L)(Nphen)2(H2O)4]n(1)。单晶结构分析表明,该配合物中有机多羧酸配体的4个羧基全部脱去质子,将Ni(Ⅱ)链接形成一维配位链,配位水分子与未配位的羧基氧原子之间的氢键作用将配位链进一步连接形成3D超分子结构。结构中连续的氢键结构为该配合物的质子传导行为提供了必要条件。电化学分析表明,配合物1的掺杂能够明显提高Nafion膜的质子传导率。对配合物的红外、X射线粉末衍射、热重研究表明配合物1具有良好的水稳定性和热稳定性,能够在质子传导过程中保持性能的稳定,有望应用于固态质子导体领域。
