水淹持续胁迫对湿地松光合特性及生理生化的影响
2021-04-10沈雅飞程瑞梅肖文发王丽君
郭 燕,沈雅飞,2,程瑞梅,2*,肖文发,2,杨 邵,王丽君
(1. 中国林业科学研究院森林生态环境与保护研究所,国家林业和草原局森林生态环境重点实验室,北京 100091;2. 南京林业大学,南方现代林业协同创新中心,江苏 南京 210037)
三峡大坝于2009 年竣工,旨在控制洪水、方便航行、供水和发电[1-2]。根据大坝“蓄水清排浊”方案,其6-9 月为低水位运行期(坝前145 m 高程低水位为下限);9 月至来年5 月为高水位运行期,期间整个消落带被全部淹没(坝前175 m 高程征地线为上限)。因此,与我国自然河岸带的“夏季淹没、冬季干旱”特征不同,三峡水库消落带具有“夏季干旱、冬季淹没”的特点[3]。目前,在三峡水位正常运行下,三峡库区消落带已经历了很长时间的反季节性的“水淹-干旱-水淹”的影响,这是干扰河岸带植物生长的主要因素。消落带植被所面临的水文状况复杂,其夏季受干旱胁迫时长超过1 个月,同时,植物在经历夏季很长时间的干旱胁迫后,就会面对接踵而至的长达5 个月的水淹胁迫,这在一定程度上为植被恢复筛选适生物种带来了更加严峻的挑战。自蓄水以后,由于植物对非季节性水淹逆境的不适应性,目前已导致三峡库区消落带植被出现严重退化现象,这直接干扰了河岸生境的结构和功能;同时,三峡库区消落带属于“自然-经济-社会”的复合系统,对外界干扰非常敏感,目前除面临严峻的生态环境问题外,还面临流行性疫情多发等经济社会问题。有研究指出,三峡库区秭归段消落带受反季节运行模式影响,其冬季淹水、夏季干旱的特殊干湿交替生境使不同土层土壤的酸碱度、淋溶程度、可挥发硫化物等理化性质和环境参数产生变异,从而影响了土壤中各类型重金属的迁移转化规律,通过污染评价可得其所在消落带土壤大多受重金属铁、锰复合型污染[4]。
湿地松(Pinus elliottiiEngelmann)是松科松属的一种常绿乔木,原产地树高达30 m,胸径90 cm;树皮灰褐色或暗红褐色;枝条生长3~4 轮·a-1;针叶深绿色,2~3 针一束并存,有气孔线;球果窄卵圆形或圆锥形;种子卵圆形,种翅易脱落;常适生于低山丘陵地带,耐水湿,生长势常比同地区的马尾松(P. massonianaLambert)或黑松(P.thunbergiiParlatore)好,很少受松毛虫危害;对气温适应性较强,能忍耐40℃的绝对高温和-20℃的绝对低温;在中性以至强酸性红壤丘陵地以及表土50~60 cm 以下铁结核层和沙黏土地均生长良好,而在低洼沼泽地边缘尤佳,但也较耐旱,在干旱贫瘠低山丘陵能旺盛生长;抗风力强,其根系可耐海水灌溉,但针叶不能抗盐分的侵染,为最喜光树种,极不耐阴,分布极广泛;在中国北纬32°以南的平原,向阳低山均可栽培,可作为经济树种,也可作为风景园林和水土保持林[5]。目前,国内外对湿地松展开了包括生物学特征、光合特性、施肥状态下的生长反应等相关研究[6-11]。三峡水库水位运营特性使消落带周期性处于“干旱-水淹交替”的生境,为探索三峡水库消落带实际“干旱-水淹交替”生境下湿地松的耐受性能,揭示其变化规律,本研究以2 年生适生植物湿地松为研究对象,通过模拟消落带“夏季干旱-冬季淹水”的实际生境环境,研究在特定生境条件下湿地松的光合性能及生理生化特性的变化规律,探索前期干旱胁迫是否会增加植物对后期水淹胁迫的敏感性等科学问题,为三峡水库消落带植被恢复奠定基础。
1 研究区域自然概况
本研究区域位于湖北省秭归县茅坪镇,紧邻三峡库区(30°38′14″~31°11′31″ N,110°00′04″~110°18′41″ E),属亚热带大陆性季风气候区,气候温暖湿润,四季分明;地质岩层以花岗岩为主,研究区域土壤类型以黄壤土和黄棕壤为主,土壤厚度约40 cm。≥ 10℃积温5 723.6℃,年均气温19.0℃。年均降水量1 100.0 mm,年均相对湿度78%。
图1 三峡库区消落带位置示意图Fig. 1 Diagram of the location of the Hydro-Fluctuation Belt in the TGRA
2 研究方法
2.1 试验材料及试验设计
试验在湖北秭归长江三峡库区森林生态系统国家定位观测研究站进行(30°53′ N, 110°54′ E, 海拔296 m,图1)。2017 年6 月初,将从湖北荆门彭场林场购买的生长基本一致的湿地松幼苗统一栽入塑料花盆中(直径32 cm,高22 cm),每盆1 株(栽种土壤为5.0 kg当地沙壤土),将2 年生湿地松盆栽植株放入搭建好的遮阳棚中缓苗,恢复生长后将其放置在选定空地上进行相同光照和水分管理,并提前半个月使各处理组达到所设定干旱状态。2017 年8 月初进行前期干旱模拟,采取单因素随机区组设计。试验模拟三峡水库当年8 月至次年5 月消落带水位波动的消涨规律。前期45 d 模拟干旱胁迫组设置为:(1)对照组(CK),正常水分灌溉(一般保持田间持水量的60%~63%,质量法);(2)轻度干旱组(T1),每5 d 浇水1 次;(3)中度干旱组(T2),每10 d 浇水1 次。待干旱胁迫试验结束后,供试湿地松幼苗恢复正常生长后,进行5 个月的冬季淹水胁迫试验。具体操作如下:将供试幼苗统一放置在一个水池中(分3 个小方形,一侧长2.5 m,深度分别为1.8、0.8、0.5 m)。冬季淹水胁迫试验设置为:(1)对照组(CK),非淹水处理,同上;(2)根淹组1(原轻度干旱组)、根淹组3(原中度干旱组),淹水至土壤表面以上约5 cm 处;(3)全淹组2(原轻度干旱组)、全淹组4(原中度干旱组),淹水至植物上方5 cm 处。冬季淹水胁迫试验期间,水池每隔1 周换1 次水,气温为5~27℃,相对湿度为54%~82%。从试验处理之日起,选取中上部枝条顶端向下3~4 cm 以下生长健壮的成熟功能针叶,分别于第0、7、15、30、45、60、120、150 d 进行光合及生理生化指标测定,其中,在测定全淹组植株叶片前,均将植株提前移出水面并用纸巾或者棉布擦干,选取原则与其他组保持一致。
2.2 试验指标测定
2.2.1 光合指标的测定 在晴朗天气的上午9:00-11:30 进行测定[5]。选取植株完好的健康成熟功能叶,利用光合仪(Li-6 400 XT 便携式光合测定仪2×3 红蓝光源叶室),在饱和光强下完成光诱导,稳定后测定针叶内气体交换参数,包括光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr),每组测定3 株,每株测定3 次,取平均值[12]。测定时设定光合有效辐射为1 000 μmol·m-2·s-1,相对湿度为60%~70%,叶室温度为20℃,CO2用提前制作好的大塑料瓶吸收3 m 高空稳定的CO2浓度,浓度为400~410 μmol·mol-1[12]。
2.2.2 生理生化指标的测定 试验中,样品膜质过氧化物及超氧化物歧化酶(SOD)等粗酶液的提取参照 Grace 等的方法,稍作修改后测定[13-14]。可溶性蛋白含量采用考马斯亮蓝 G-250 染色法测定[13]。SOD 活性采用NBT 法(氮蓝四唑比色法),稍作修改后测定[13];过氧化氢酶(CAT) 活性采用红外分光光度计法测定[13];过氧化物酶(POD) 活性采用愈创木酚法测定[13];丙二醛(MDA) 含量测定采用硫代巴比妥酸法测定[13]。
2.3 数据处理与分析
采用Microsoft Excel 2016 和SPSS17.0 软件进行数据统计分析。使用one-way ANOVA 来揭示持续水淹程度对湿地松幼苗光合及生理生化的影响,并运用Turkey 检验法进行多重比较。运用绘图软件Origin 8.6 制图。
3 结果与分析
3.1 湿地松幼苗光合指标的变化
图2 表明:水淹胁迫能显著影响湿地松幼苗的净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr)。经方差分析发现,随着水淹程度的增加,湿地松光合气体交换的生理响应特性在不同水淹处理组之间的表现各异(图2A~D)。随水淹时间的增加,根淹组1、全淹组2 和根淹组3、全淹组4 处理组Pn逐渐下降;至水淹结束,根淹组1、全淹组2、根淹组3 和全淹组4 的Pn与初始值相比,分别下降30.9%、33.0%、51.9%、62.3%(图2A)。
不同水淹胁迫组的Gs随时间的变化与Pn基本一致,全淹组(2、4 组)植株的Gs自水淹15 d 后明显低于对照植株,且随着水淹时间的增加,Gs逐渐降低;而根淹组(1、3 组)植株的Gs直到胁迫时间达到30 d 后才明显低于对照组。至水淹胁迫结束,全淹组4、根淹组3、全淹组2、根淹组1 的Gs分别比对照植株降低了55.7%、44.2%和64.3%、44.4%(图2B)。
由图2C 可知:水淹胁迫严重影响了湿地松针叶的Ci,从水淹胁迫开始,湿地松针叶的Ci随着水淹时间的增加逐渐降低;在水淹胁迫达到45 d前,不同淹水组Ci变化不大;但水淹45 d 后,不同淹水组的Ci表现为根淹组1 > 全淹组2 > 根淹组3 > 全淹组4。
在水淹胁迫45 d 时,根淹组1、全淹组2 和根淹组3 幼苗的Tr均受水淹胁迫影响差异不大,但随水淹胁迫时间的延长,根淹组3 和全淹组4 植株的Tr出现了大幅下降,至水淹150 d时,根淹组3和全淹组4 植株的Tr比对照植株分别降低了65.5%和74.0%,而根淹组1 在整个水淹胁迫过程中Tr均维持在正常水平;全淹组2 植株的Tr比对照植株的降低了39.5%(图2D)。
3.2 湿地松幼苗生理生化指标的变化
由图3A 可知:水淹处理初期,湿地松针叶内的蛋白质含量呈波动上升趋势,但随水淹时间的增加而下降;至水淹处理60 d 时,除根淹组1 外,其他处理组的蛋白质含量均达到最大值,与初始值相比分别增加了14.7%、66.2%、32.5%、18.9%;至水淹结束,不同淹水处理组中蛋白质含量下降,大小表现为:全淹组4 > 全淹组2 > 根淹组3 > 根淹组1。
不同水淹处理7 ~15 d 时,根淹组1、根淹组3 和全淹组2 湿地松幼苗针叶中的SOD 活性变化较大,全淹组4 的SOD 活性变化较稳定;水淹30 d时,根淹组1、3 的SOD 活性达到最高,分别为915.21、924.73 μmol·g-1,而全淹组4 的SOD 活性最低,为592.53 μmol·g-1(图3B)。
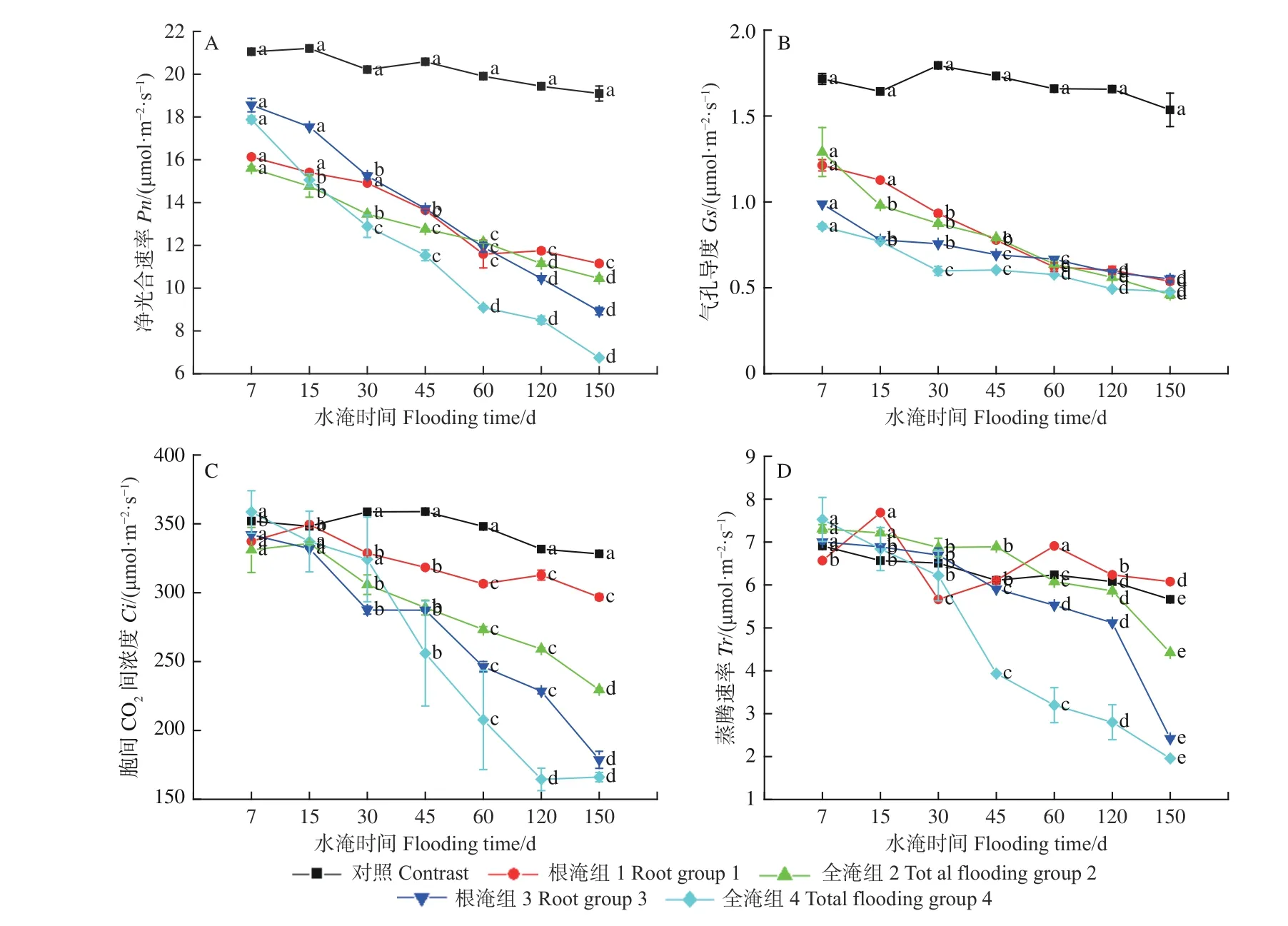
图2 不同淹水条件下湿地松的净光合速率(Pn)、气孔导度(Gs)、胞间CO2 浓度(Ci)和蒸腾速率(Tr)随时间的变化Fig. 2 Time-dependent changes of Pn, Gs, Ci and Tr of Pinus elliottii under different flooding conditions
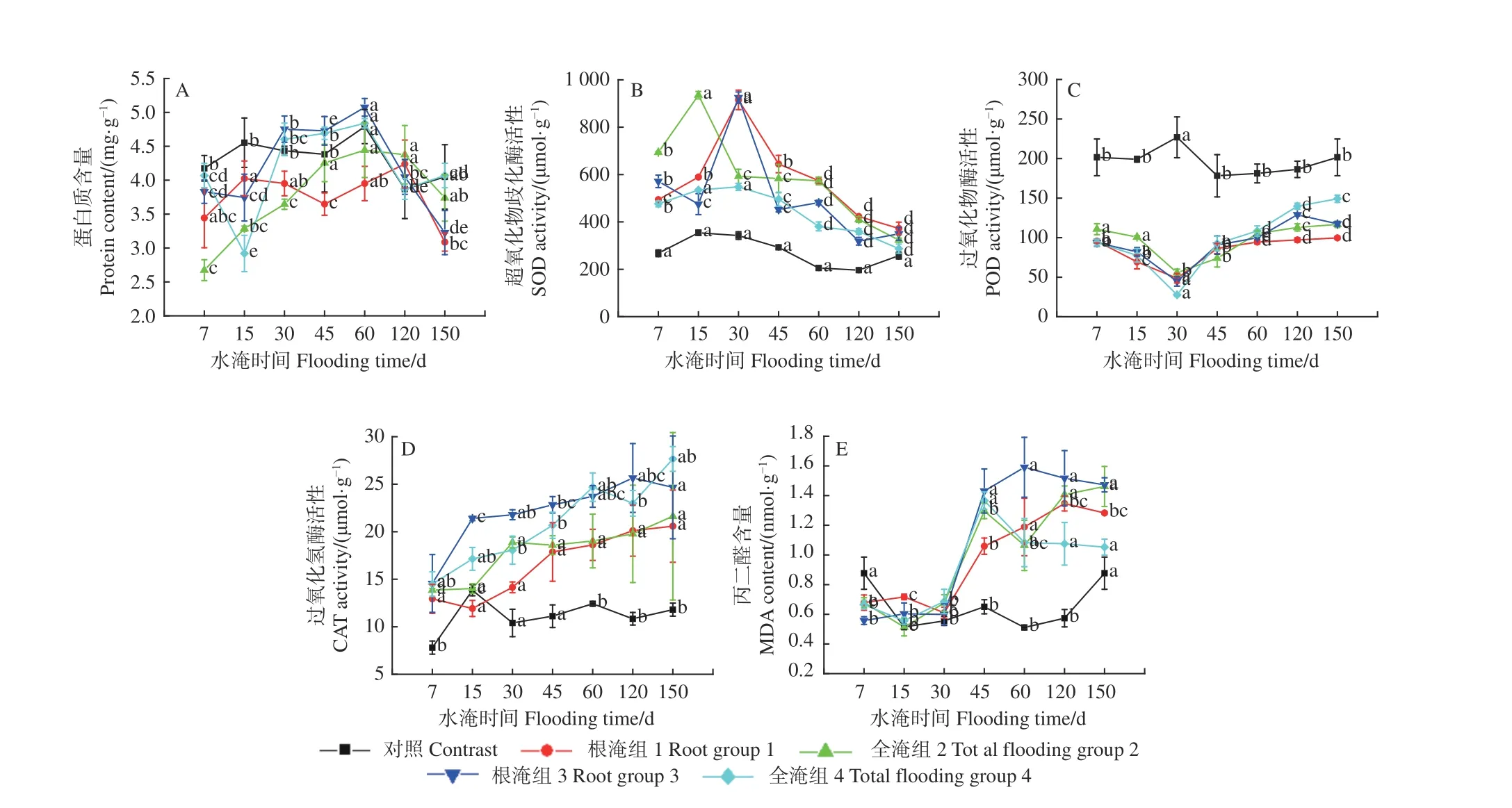
图3 不同淹水条件下湿地松的蛋白质含量、SOD、POD、CAT 和MDA 随时间的变化Fig. 3 Changes of protein content, SOD, POD, CAT and MDA with time under different flooding conditions in Pinus elliottii
水淹前,对照组的POD 活性明显高于其他处理组,但随着水淹时间的增加,各处理组针叶中的POD 活性变化差异不大;在水淹胁迫30 d时,根淹组1、全淹组2、根淹组3 和全淹组4 的POD 活性均达到最低,分别为58.679、55.606、64.681、27.784 μmol·g-1。除对照组外,对于同一处理,随水淹时间的增加,POD 活性呈先降低后增加的趋势(图3C)。
不同水淹下,在经历不同胁迫时间后,湿地松针叶中的CAT 活性差异不明显;在水淹胁迫45 d后,根淹组3 和全淹组4 的CAT 活性与对照组相比差异显著;随着水淹时间的增加,水淹组的CAT 活性均呈现出增加后逐渐稳定的趋势。试验结束后,根淹组1、全淹组2、根淹组3、全淹组4 的CAT 活性相比初始值分别增大了59.1%、56.1%、69.4%、90.1%(图3D)。
不同水淹处理组湿地松幼苗在7、15 、30 d 时的MDA 含量变化均差异不明显;随着水淹时间的增加,至水淹45 d 时,MDA 含量变化规律为根淹组3 > 全淹组4 > 全淹组2 > 根淹组1 > 对照组。在前期轻度干旱下,根淹组1 和全淹组2 植株在水淹45 d 前并没有明显变化,但在水淹45 d 后,全淹组2 与根淹组1 的MDA 含量差异显著(P< 0.05);在前期中度干旱下,根淹组3 和全淹组4 植株在水淹45 d 前变化不明显,但在水淹45 d 后,根淹组的MDA 含量明显高于全淹组含量。随着水淹时间的增加,对照组湿地松针叶中的MDA 含量呈先降低后逐渐增大至最初水平;根淹组1、全淹组2、根淹组3 和全淹组4 针叶中的MDA 含量分别在水淹120、150、60、45 d 达到最大值,分别为1.346、1.461、1.591、1.366 μmol·g-1(图3E)。
4 讨论
4.1 冬季水淹胁迫对湿地松光合指标的影响
不同水淹胁迫下,植物的净光合速率可作为检验应试树种对于水淹胁迫下光合生理生态响应能力的核心表征因子[15-17]。Pezeshki 等[18]曾提出“耐淹能力较强的树种在水淹初期净光合速率会有所下降,后期将逐步趋于稳定状态”,即对于一部分树种而言,植物会在遭受水淹后的几小时到几天时间内由于氧气的缺乏而明显降低其净光合作用[19-20],但随着水淹时间的延长,耐淹树种通常通过发酵作用来保持其能量需求,一般其Gs、Pn的变化规律保持一致,即:在水淹初期,植物气孔缩小,吸收CO2能力减弱,植物由于光合相关酶底物减少而降低光合作用[21-22],但随胁迫时间增加,其自身产生适应,使得光合作用逐渐恢复或稳定[23],从而使植物净光合作用逐渐恢复至正常水平或达到相对稳定状态;而非耐淹性物种则由于不适应这种水淹胁迫环境使自身光合作用下降,最终导致其死亡。因此,植物的恢复能力因物种类别、水淹胁迫强弱及水淹持续时间的不同而呈现出不同的响应变化。在本研究中,经过150 d 的水淹胁迫后,根淹组1、全淹组2、根淹组3 和全淹组4 湿地松的Pn分别比初始值下降30.9%、33.0%、51.9%、62.3%;根淹组1 和全淹组2 植物的净光合速率随着时间增加逐渐呈现出“下降-平缓”的趋势,但根淹组3 和全淹组4 植株的净光合速率处于一直下降的趋势。出现上述现象的原因主要是由于湿地松对不同程度水淹胁迫环境的适应策略及耐受性不同。在水淹过程中,根淹组1 和全淹组2 植物试图通过茎的伸长“逃离”水淹环境,由于茎的伸长生长过程中细胞的分裂及新细胞壁的生成需要大量的能量和碳水化合物的供给,因此,植株需要提高或维持稳定的光合速率[24],这与衣英华等[25]对枫杨(Pterocarya stenoptera)进行的淹水胁迫研究结果类似。而根淹组3 和全淹组4 的植物由于前期干旱胁迫所造成的植物各方面的损伤,使其对全淹环境的耐受力下降,可能无法长期适应全淹及根淹环境。
气孔的开放与关闭影响着植物蒸腾作用的强弱。植物气孔关闭,植物对CO2的获取量减少,植物进行光合作用所需光合酶底物减少,Pn降低[26]。Farquhar 等[26]提出衡量植物Pn下降的2 个指标:Ci和气孔限制值(Ls)(Ls=1-(Ci/Ca)。如果Pn和Ci同时下降,Ls上升,说明Pn降低主要是由于气孔限制引起的;如果Pn下降,而Ci上升,则表明Pn降低主要是由于非气孔限制所致[27]。本研究中,湿地松随着水淹时间的增加,各水淹胁迫组湿地松的Pn和Ci下降,而Ls随着水淹时间的增加先增加后降低再增加,这可以说明湿地松Pn下降的主要决定因素前期是由气孔因素决定的;而后期则大多由非气孔因素所决定。这与前期学者对消落带适生植物中华蚊母树[28]等研究结果一致。这也表明气孔关闭是植物最早对水淹作出的响应之一;随水淹胁迫程度加深,植物开始受非气孔因素的限制。另外,还有研究表明,植物与土壤之间的水力导度下降将会与根系缺氧一样,也会引起植物Pn和Gs降低[29],但在本研究中,湿地松受到水淹胁迫后的植物根系和土壤之间的水力导度是否下降有待于进一步的验证。
4.2 冬季水淹胁迫对湿地松生理生化指标的影响
可溶性蛋白一定程度上可保护酶活性同时维持植物组织细胞膜的正常结构和功能。有研究指出,受水淹影响,植株内蛋白质的合成过程会受阻[30]。本研究显示,根淹组植株可溶性蛋白在淹水阶段大多与对照组差异不显著,表明植株在部分水淹环境下蛋白质的合成基本不受抑制;而全淹组的湿地松针叶内可溶性蛋白含量在淹水初期(水淹60 d)出现了显著的增加,而在水淹后期逐渐下降,可能是由于全淹植物受胁迫程度更大,积累的高浓度可溶性蛋白可一定条件下维持细胞较低的渗透势,提高植株耐淹性,进而减轻植物受损害程度,这可能是湿地松为适应水淹胁迫环境而产生的一种自身适应性。
植株为抵御淹水胁迫下过多活性氧自由基对自身正常生命活动造成的伤害,形成了一整套复杂的抗氧化酶系统,可以清除体内多余的活性氧自由基(ROS),使其产生与清除达到动态平衡,从而维持植物正常呼吸作用[31]。Fadzilla 等[32]、Yang 等[33]以及吴寒[34]研究指出,“SOD 是植物体内防御自由基毒害的一种关键酶”。因此,植物体内的过氧化氢酶、过氧化物酶以及超氧化物歧化酶等协同作用可以减轻这些过量自由基的存在对植物细胞膜的伤害[35]。国内很多学者对消落带适生植物等研究表明:耐淹植物均可通过提高体内抗氧化酶活性减轻过多自由基对自身产生的伤害[22,29,36-39]。本次对不同淹水胁迫处理下湿地松的抗氧化酶活性进行研究得出:在水淹7 d,湿地松体内SOD 活性并没有显著改变,而在水淹7~15 d 变化较大,这可能是由于前期湿地松体内的非酶促抗氧化系统发挥了重要作用,而随胁迫程度加剧,植物开始通过提高植物体内SOD、CAT 和POD 活性减轻对植株的伤害。
自由基伤害学说已成为学者用于研究植物在逆境条件下细胞毒害机理的有效途径[40]。MDA 可与细胞内的蛋白质、核酸等大分子发生反应,使蛋白质和核酸变性,影响细胞的结构和功能,最终导致细胞死亡[41]。本试验中对湿地松针叶中的MDA 含量测定得出:不同淹水处理下,湿地松在水淹30 d内MDA 含量均与对照组相比差异不显著,体现了湿地松对于短期淹水具有较强的适应性,但随水淹时间的延长,湿地松针叶中的MDA 含量显著增加并逐渐稳定在一定水平,包括本试验在内的多个对消落带适生植物的研究中均发现这种现象[36,40-41]。总之,湿地松在面对双重胁迫下,不同胁迫因子之间发生了或协同或拮抗作用。
5 结论
本研究中,湿地松幼苗在模拟夏季干旱-冬季淹水的交替生境变化条件下具有一定的适应性,但模拟试验在水体温度与成分、水体流动性(溶解氧含量等)、浑浊度(光线可透性)、土壤结构与养分条件以及光照等环境条件方面很难与消落带实际生境变化完全匹配,因此,植物的生理代谢活动等模拟试验结果是否与实际生境植物的表现一致,还需要后续实地调查进行验证。因此,本课题组会在后期通过建立消落带长期监测固定样地或者示范区,以求探究植物在原始生境环境下的适应机制以及抗逆性。
