亲环蛋白A在口腔鳞状细胞癌组织中的表达及对细胞增殖和侵袭的影响
2021-04-09夏晓杨方飞刘燕车超柯锦娟姜胜军
夏晓杨 方飞 刘燕 车超 柯锦娟 姜胜军
1.湖北省中西医结合医院口腔科,武汉430015;2.武汉大学人民医院口腔科,武汉430060
口腔鳞状细胞癌(oral squamous cell carcino‐ma,OSCC)作为头颈部常见的恶性肿瘤,病因多样、机制复杂,近年来发病率呈升高趋势[1]。虽然现有的临床治疗手段不断进步,但患者预后依然改善有限,5年总体生存率维持在50%[2]。研究[3]指出,早期淋巴结转移和复发是影响患者预后的主要因素。因此,深入研究影响OSCC转移及复发的相关机制或敏感基因,对指导患者诊疗及改善预后有重要价值。亲环蛋白A(cyclophilin A,Cy‐PA)作为亲环素蛋白家族成员,与细胞装配、折叠、运输及免疫炎症调节等密切相关[4],其可能发挥癌基因的作用而参与肿瘤发生,与肿瘤细胞转录、凋亡及侵袭转移等密切相关[5]。本研究分析了OSCC 组织中CyPA 蛋白表达,探讨其与临床指标的相关性,以及与OSCC细胞增殖和侵袭的关系。
1 材料和方法
1.1 临床资料
选取湖北省中西医结合医院口腔科2015 年2月—2018 年2 月接受手术治疗且临床资料完整的OSCC 患者77 例,均为原发病例且术前未行放化疗,术后病理学检查证实为OSCC。其中,男性46例,女性31 例,年龄34~76 岁,平均年龄(57.6±11.3)岁。按照第七版美国癌症联合委员会和国际抗癌联盟TNM 分期标准:T1期19 例,T2期23 例,T3期21例,T4期14例;临床分期:Ⅰ期17例,Ⅱ期15例,Ⅲ期27例,Ⅳ期18例;分化程度:中低分化42 例,高分化35 例;发生淋巴结转移36 例。本研究通过医院伦理委员会批准,所有患者均知情同意。
1.2 主要试剂和设备
免疫组化试剂盒及配套试剂(上海碧云天生物技术有限公司),兔抗人CyPA 多克隆抗体(Ab‐cam 公司,美国),SCC-25 细胞系(ATCC 公司,美国),胰蛋白酶、胎牛血清和DMEM 培养液(Gibco 公司,美国),总RNA 提取试剂(Trizol法)、Lipofectamine 2000 转染试剂(Invitrogen 公司,美国),逆转录和聚合酶链反应(polymerase chain reaction,PCR)扩增试剂(大连宝生物工程有限公司),甲基噻唑基四唑(methyl thiazolyl tet‐razolium,MTT)液、二甲基亚砜(dimethyl sulf‐oxide,DMSO)(Sigma 公司,美国),Transwell小室(Corning 公司,美国),实时荧光定量PCR仪(Roche 公司,瑞士),凝胶电泳分析系统(Bio-Rad 公司,美国)。CyPA 干扰序列及阴性对照序列由上海吉玛制药技术有限公司设计合成,CyPA和内参引物由上海生工生物公司设计合成。
1.3 方法
1.3.1 免疫组化法检测OSCC 和癌旁组织中CyPA蛋白表达 采用免疫组化SP 法,取OSCC 和癌旁组织石蜡标本,连续切片(厚度为4 μm),二甲苯脱蜡至水,PBS 冲洗3 次,加入3%过氧化氢反应15 min,PBS冲洗,置于枸缘酸钠缓冲液中高压高温行抗原修复,PBS 冲洗3 次,加入一抗兔抗人CyPA 多克隆抗体(稀释比例1∶800),4 ℃过夜孵育,PBS 冲洗3 次,加入二抗,室温下培养120 min,PBS冲洗3次,DAB 显色,苏木精复染,脱水、透明、封片、观察。高倍镜下观察,随机取5 个高倍视野,CyPA 蛋白主要表达于细胞浆,根据染色强度和阳性细胞比例判定结果[6],具体如下。1)染色强度:不着色、淡黄色、棕黄色和黄褐色分别赋予0、1、2 和3 分;2)阳性细胞比例:阳性细胞比例<5%、5%~25%、26%~50%、51%~75%、>75%分别赋予0、1、2、3和4分;3)将染色强度和阳性细胞比例得分相加,<1 分为阴性(-),≥1分为阳性(+)。
1.3.2 细胞培养及分组 用含10%胎牛血清的DMEM培养液培养SCC-25细胞,培养条件:37 ℃、5%CO2、饱和湿度。待细胞丰度达80%以上时,胰酶消化,传代。按Lipofectamine 2000 转染试剂说明对对数生长期细胞进行分组转染。1)CyPA 干扰序列组:转染CyPA 小分子RNA 干扰(siRNA) 序列5,-GATCCGTGGTGACTTCACACGCCATAATTCAAGAGATTATGGCGTGTGAAGTCACCATTTTTTC-3,;2)阴性对照组:转染阴性对照序列5,-AAGAGAAAAAGCGAAGAGCCA-3,;3)空白组:仅加入无血清培养液。
1.3.3 实时荧光定量PCR 技术检测细胞中CyPA mRNA 表达 转染后,各组培养48 h,加入胰酶及细胞裂解液,Trizol 法提取总RNA,检测总RNA纯度,按逆转录试剂盒说明完成逆转录,使用实时荧光定量PCR 仪对引物体系扩增,CyPA 上游引物序列:5,-CCACCGTGTTCTTCGACATCACG-3,,下游引物序列:5,-GCTCCTCTTGCCATTCCTGACCC-3,;磷酸甘油醛脱氢酶(glyceraldehyde phos‐phate dehydrogenase,GAPDH)上游引物序列:5,-CGTCTTCACCACCATGGAGAAGGC-3,;下游引物序列:5,-AAGGCCATGCCAGTGAGCTTCCC-3,。PCR 条件:94 ℃2 min,94 ℃30 s,57 ℃30 s,72 ℃30 s,连续循环38次,每个样品设6个复孔。采用2-△△Ct法获得各组细胞中CyPA mRNA 相对表达量[7]。
1.3.4 Western blot 法检测细胞中CyPA 蛋白表达转染后,各组培养48 h,加入胰酶及细胞裂解液,提取总蛋白,按照BCA试剂盒说明检测蛋白浓度。取50 μg 总蛋白行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gelelectrophoresis,SDS-PAGE),电转至聚偏氟乙烯膜,脱脂奶粉封闭120 min,然后将一抗按1∶1 000稀释后加入,4 ℃过夜孵育,加入二抗,室温反应60 min,加入发光试剂,以GAPDH 为内参获得CyPA蛋白相对表达量。
1.3.5 细胞增殖实验 1)MTT 法:用胰酶对各转染组细胞消化,接种于96孔板,密度为每孔2×104个,继续培养。分别于24、48、72 和96 h 时,向各孔加入MTT 液20 μL,培养5 h,加入DMSO 200 μL,振荡均匀,置酶标仪于490 nm 波长处检测其光密度(optical density,OD)值,用以反映细胞增殖能力[8]。2)平板集落形成实验:取各组转染培养24 h 细胞,胰酶消化,离心重悬,接种于6 孔板,密度为每孔1×103个,尽量让细胞在板底分布均匀,培养箱中培养,出现克隆斑时,弃培养液,PBS 冲洗1 次,甲醛固定,结晶紫染色,晾干、拍照。
1.3.6 细胞侵袭实验 用无血清DMEM培养液稀释Matrigel 基质胶,将稀释液包被Transwell 小室上室。用胰酶对各组转染后48 h 细胞消化,离心,使用无血清培养液重悬(每毫升1×106个),取200 μL 细胞悬液,置于小室上室,将含10%胎牛血清的培养液600 μL 加入下室,恒温培养24 h,取小室,弃培养液,PBS 冲洗3 次,多聚甲醛固定,1%结晶紫染色,用棉签将散落细胞轻轻除去,高倍镜下观察细胞穿膜情况。重复实验3次[9-10]。
1.4 统计学方法
采用SPSS 21.0 软件对实验结果进行分析,计数资料采用率值表示,两组资料间比较使用χ2检验,多组间比较采用单因素方差分析和LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 CyPA蛋白在OSCC和癌旁组织中表达
CyPA蛋白在OSCC组织中阳性表达率为76.62%(59/77),癌旁组织中为29.87%(23/77),差异有统计学意义(χ2=33.805,P=0.000)(图1)。
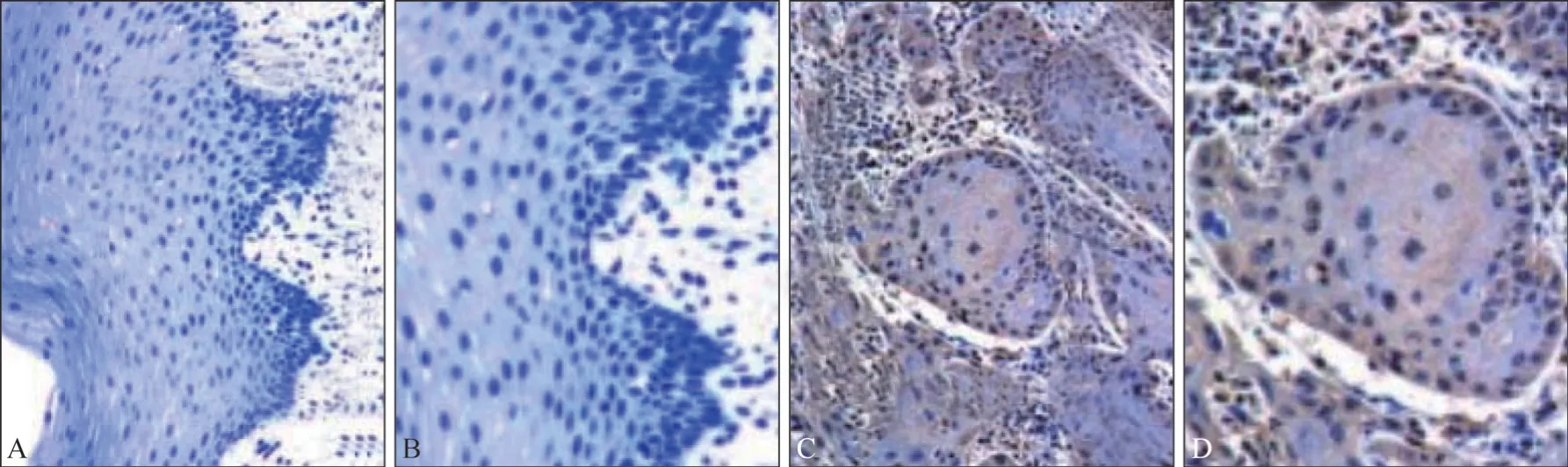
图1 OSCC和癌旁组织中CyPA蛋白的表达 免疫组化染色Fig 1 The expressions of CyPA protein in OSCC and adjacent tissues immunohistochemical staining
2.2 CyPA蛋白在OSCC不同临床指标间表达差异
CyPA 蛋白在不同性别和年龄间的表达差异无统计学意义(P>0.05),CyPA 蛋白在T3+T4期、Ⅲ+Ⅳ期、中低分化和发生淋巴结转移组织中的阳性表达率升高,差异有统计学意义(P<0.05)(表1)。
2.3 3组细胞中CyPA mRNA和蛋白表达
CyPA 干扰序列组、阴性对照组和空白组细胞中CyPA mRNA 相对表达量分别为0.21±0.10、1.03±0.07 和1.02±0.04,差异有统计学意义(F=254.394,P<0.001)。阴性对照组和空白组细胞中CyPA mRNA 相对表达量差异无统计学意义(P=0.754),CyPA干扰序列组细胞中CyPA mRNA相对表达量低于其他两组(P<0.05)(图2)。
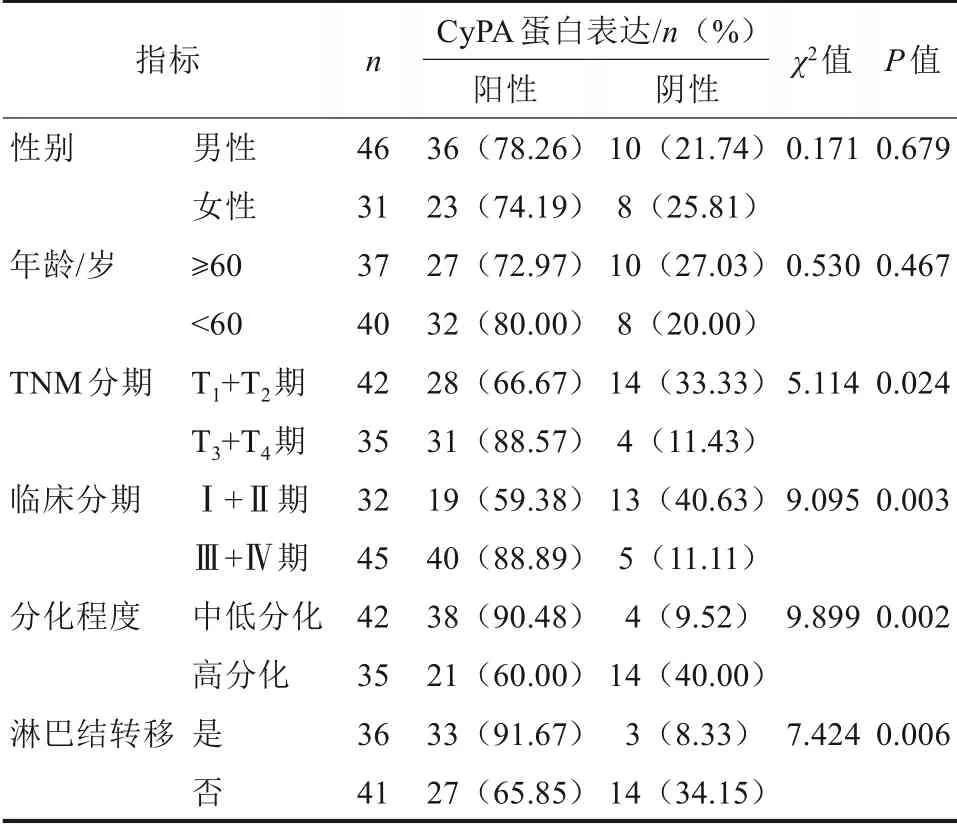
表1 CyPA蛋白在OSCC不同临床指标间表达差异Tab 1 The differences of the expressions of CyPA protein among different clinical indicators of OSCC

图2 实时荧光定量PCR检测3组细胞中CyPA基因表达Fig 2 Real-time fluorescence quantitative PCR was used to de‐tect the expressions of CyPA gene of cells in three groups
CyPA 干扰序列组、阴性对照组和空白组细胞中CyPA 蛋白相对表达量分别为0.38±0.09、0.76±0.08 和0.86±0.11,差异有统计学意义(F=42.286,P<0.001)。阴性对照组和空白组细胞中CyPA 蛋白相对表达量差异无统计学意义(P=0.079),CyPA干扰序列组细胞中CyPA 蛋白相对表达量低于阴性对照组和空白组(P<0.05)(图3)。
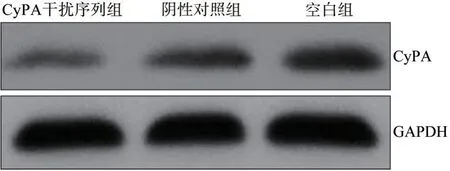
图3 Western blot法检测3组细胞中CyPA蛋白表达Fig 3 Western blot was used to detect the expressions of CyPA protein of cells in three groups
2.4 3组细胞增殖能力
MTT 实验结果显示,CyPA 干扰序列组24、48、72和96 h细胞OD值低于阴性对照组和空白组(P<0.05),阴性对照组和空白组24、48、72和96 h细胞OD 值差异无统计学意义(P=0.582、0.660、0.598、0.226),具体见表2。平板集落形成实验结果显示,CyPA 干扰序列组、阴性对照组和空白组细胞集落数分别为(66.38±4.00)、(174.44±5.82)和(170.30±7.03) 个,差异有统计学意义(F=679.742,P<0.001),CyPA 干扰序列组细胞集落数低于阴性对照组和空白组,差异有统计学意义(P<0.05),阴性对照组和空白组细胞集落数差异无统计学意义(P=0.232)(图4)。
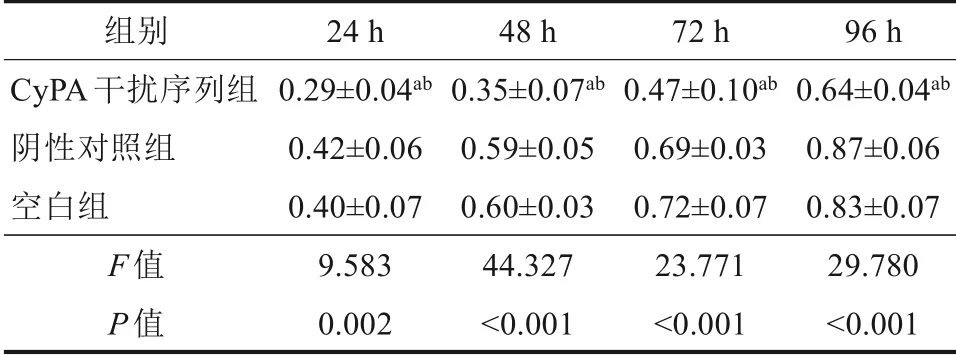
表2 3组细胞不同时点增殖能力比较Tab 2 Comparison on the proliferation ability of cells in the three groups at different time points

图4 平板集落形成实验检测3组细胞增殖能力Fig 4 Plate colony formation test was used to detect the proliferation ability of cells in three groups
2.5 3组细胞侵袭能力
Transwell 实验结果显示,CyPA 干扰序列组、阴性对照组和空白组侵袭细胞数分别为(81.14±8.81)、(117.61±5.57)和(122.59±6.27)个,差异有统计学意义(F=62.337,P=0.000),侵袭细胞数在阴性对照组和空白组差异无统计学意义(P=0.238),CyPA 干扰序列组侵袭细胞数低于阴性对照组和空白组(P<0.05)(图5)。
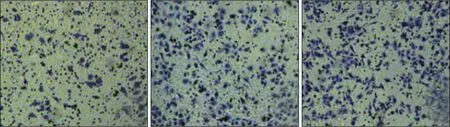
图5 Transwell实验检测3组细胞侵袭能力 结晶紫 ×200Fig 5 Transwell test was used to detect the invasion ability of cells in 3 groups crystal violet ×200
3 讨论
近年来,OSCC发病率呈升高趋势,由于口腔颌面部机械运动频繁、血流丰富、淋巴结引流广泛,易于肿瘤扩散转移[11],OSCC 患者早期便可出现转移,已成为影响患者预后的重要危险因素[12]。研究[13]表明,OSCC 转移和侵袭是一个涉及众多基因激活或失活、多步骤、多阶段的演化过程。Cy‐PA 是存在于各类细胞中的亲环素蛋白家族成员[14],其可能发挥促癌基因功能而参与了多种肿瘤发生进展过程[15]。有研究[16]指出,CyPA 促进了非小细胞肺癌转移。与早期胃癌细胞增殖及移植瘤生长有关[17]。亦有研究[18]指出,CyPA 在口腔黏膜下纤维化表达上调,可能是潜在生物标志物和治疗靶标。但CyPA 在OSCC 组织中表达如何,鲜有报道。本研究中CyPA 蛋白在OSCC 组织中呈高表达,可能发挥癌基因功能促进了OSCC 发生。同时,结果显示,TNM 分期T3+T4期、临床分期Ⅲ+Ⅳ期、中低分化和发生淋巴结转移组织中CyPA 蛋白阳性表达率升高,进一步说明CyPA 蛋白可能参与了OSCC进展及恶性化过程。
本研究中CyPA干扰序列组细胞中CyPA mRNA和蛋白相对表达量明显降低,提示SCC-25 细胞中CyPA mRNA 表达被成功抑制。有研究[19]指出,CyPA 对细胞周期具有调控作用,可通过调控细胞周期而参与细胞增殖及凋亡。本研究结果显示,CyPA 干扰序列组24、48、72 和96 h 细胞OD 值低于阴性对照组和空白组,且细胞集落数减少,这些结果说明抑制SCC-25 细胞中CyPA mRNA 表达水平,可有效抑制细胞增殖能力,提示CyPA 可能参与了SCC-25细胞增殖过程。有研究[20]指出,Cy‐PA 表达上可促进癌细胞迁移。本研究中CyPA 干扰序列组侵袭细胞数低于阴性对照组和空白组,说明下调SCC-25 细胞中CyPA mRNA 表达水平,可抑制细胞侵袭能力,提示CyPA 基因可能参与了SCC-25细胞侵袭过程。
综上所述,CyPA 蛋白在OSCC 组织中呈高表达,与肿瘤发生和进展密切相关,下调SCC-25 细胞中CyPA 基因表达,可抑制细胞增殖和侵袭能力,为开展机制研究及基因靶向治疗提供新的方向。
利益冲突声明:作者声明本文无利益冲突。
