拟南芥ULTRAPETALA1基因功能的研究进展
2021-04-09杨天越田京京宋静云王雪RalfMllerXing邢倩
杨天越田京京宋静云王雪RalfMüller-Xing邢倩
(1.东北盐碱植被恢复与重建教育部重点实验室(东北林业大学),黑龙江 哈尔滨 150040;2.东北林业大学生命科学学院,黑龙江 哈尔滨 150040)
2001年Fletcher等人最早报道ULTRAPETALA1(ULT1)基因[1]。ULT1植株会产生额外的花器官;而且花序分生组织更大[1]。ULT1的cDNA全长2.4kb,编码了一个含有32个氨基酸B-box类和98个氨基酸SAND结构域的小蛋白[2]。Carles等人通过亚细胞定位发现ULT1在核和细胞质中都有表达[2]。ULT1属于三胸蛋白复合体(Trithorax Group,TrxG)[3],三胸蛋白复合体(TrxG)是表观遗传修饰因子,通过激活基因表达在真核发育中发挥关键作用,对植物TrxG因子的功能还有待进一步深入研究[4]。ULT1似乎具有表观遗传分子开关的特征,通过TrxG和多梳蛋白(Polycomb Group,PcG)复合物调节抑制和激活过程[5]。ULT1和ULT2在茎尖分生组织、花序和花分生组织、发育中的雄蕊、心皮和胚珠中协同表达[2,4]。ULT基因在物种进化中相对保守,ULT基因除了已知的调控根、茎、叶和花的发育之外,还调控果实的发育和成熟[6]。本文综述了ULT1基因在拟南芥分生组织、叶和花发育等方面发挥的功能。
1 ULT1与CLAVATA在茎尖分生组织中的调控关系
高等植物分生组织是细胞增殖和器官分化的中心[7]。在植物发育过程中,对茎和花分生组织大小的调控是通过多因子复杂信号网络来实现的[8]。有研究发现,ULT1突变体典型的表型是分生组织较大从而导致花器官增多,其中在萼片和花瓣数量上的增加明显[1]。ULT1在调控拟南芥茎和花分生组织细胞积累中是必需的[1]。
CLV1控制茎尖分生组织(Shoot apical meristem,SAM)大小[9]。clv1和clv3的突变体导致茎尖分生组织增大和束状茎的形成[10]。在ult1 clv1-4和ult1 clv3-2双突变体中,SAM表型变得更加明显;当植物抽薹时,ult1-1 clv1-4和ult1-1 clv3-2植物的分生组织极度丛生;与clv1-4和clv3-2花序相比,双突变体花序分生组织的宽度超过两倍;ult1与clv1和clv3突变之间的这种强协同作用揭示了ULT1在CLV路径上控制SAM的大小具有冗余性;由于SAM细胞在clv1和clv3突变植株的整个生命过程中逐渐积累,这些表型表明ULT1可能在发育早期,即在ult1突变植物中首次检测到表型的阶段之前,在限制分生组织增殖上起作用[1]。
2 ULT1与KAN参与叶轴极性的调控
在自然界中,广泛的叶片特征,包括大小和形状,使高等植物能够适应不相同的自然环境和栖息地[11]。ULT1调节拟南芥的多种发育过程,在叶发育中也有作用。
在拟南芥中,叶沿其近—远轴(背—腹)轴极化,正—背面叶片极性的建立导致正面(顶部)和背面(底部)域内不同组织的发育[12]。叶的正面富含毛状体,而背面表皮是无光泽的灰绿色[12]。拟南芥叶片的远轴同一性主要由KANADI(KAN)和激素响应因子(AUXIN RESPONSE FACTOR,ARF)转录因子家族调控[13]。叶轴极化,在拟南芥中,这种差异在前2个莲座叶中尤为明显,其近轴面上有毛状体(叶毛),但在远轴面上没有[13]。
KAN是调节拟南芥器官极性的因子[13,14]。KAN突变在前2片叶上产生远轴毛状体。KAN对于叶的远轴同源性是必需的[13]。在形态学水平上,叶片形态发生过程中细胞的早期膨大和增殖与伸长之间协调配合密切相关[15]。野生型和ult1莲座叶都由一个几乎平的叶片组成,该叶片沿着正面和背面之间的界面向外生长[3]。相比之下,kan1幼苗的第1轮莲座叶以直立的姿态出现,并在整个发育过程中保持杯状,这是由于其部分正面化导致的[13]。已经表明,这种表型是近轴栅栏叶肉细胞横截面积减少的结果,伴随着远轴海绵状叶肉细胞横截面积和数量的增加[13]。ult1 kan1植物的一个显著特征是抑制kan1正面化的叶表型,幼苗显示出与野生型植物难以区分的平叶[16]。
在中脉,野生型和ult1-2叶在正面都含有多层较小的叶绿体致密的栅栏叶肉细胞,在背面含有多层较大的更圆的海绵状叶肉细胞[12]。此外,远轴细胞在中脉下方呈U形排列,而近轴中脉上方形成直的行[12]。然而,在kan1幼苗中,叶底部区域的细胞更小,叶绿体更致密,类似于正面细胞,并且失去了U形弯曲。在ult1-2 kan1中,叶片不对称得到恢复,正面的栅栏叶肉细胞和背面的海绵状叶肉细胞与野生型叶片非常相似。这些结果证实了ULT1活性是kan1正面化的叶片极性缺陷所必需的,并且表明ULT1和KAN1通过建立内部细胞层的不对称性,对叶片的近—远轴方向起相反作用[12]。
ULT1还可以与转录因子KAN1互作,影响花形态发育[16]。基因ULT1和基因KANADI1(KAN1)沿着2个不同的极性轴组织拟南芥雌蕊群,表明ULT1活性是kan1正面极性缺陷所必需的。ULT1和KAN1反向调节正—背面轴;通过促进雌蕊群中的基底细胞命运来建立顶端—基底极性[16]。2014年Monfared等人发现,ult1荚果含有相当比例的败育胚珠[4]。kan突变最初被认为是在心皮中指定远轴同一性crabs claw(crc)突变花表型的增强子[17]。ULT1在作用于顶—基部雌蕊轴的模式上和KAN1是冗余的。由于花柱组织扩张,kan1和ult1 kan1雌蕊期可见异位生长。异位外生体由花柱和柱头组织组成,表明KAN1和ULT1共同限制了启动子在雌蕊顶端的活性。也说明ULT1和KAN1促进雌蕊群的基本极性[16]。
3 ULT1参与花发育的分子调控途径
花由未分化的细胞群发育而来,从顶端分生组织的侧翼生长出来;细胞在花原基中分裂然后在适当的地方分化成花器官[18,19]。作为植物的生殖器官,花的典型结构由4个基础部分组成,即花瓣、萼片、雌蕊和雄蕊。花发育过程一般分为3个阶段,即成花诱导、花的发端和花器官发育[20]。花的形态建成和开花是由复杂的转录因子和染色质因子的基因调控网络控制的[21]。ULT1的突变影响花形态和开花时间,在花发育调控网络中具有重要作用[1]。
3.1 在花分生组织中,ULT1与AGAMOUS、WUSCHEL、UIF1的调控关系
花的分生组织是花序分生组织在花向生殖生长转变完成后发展而来,在产生一定数量的花器官后终止[22]。
AGAMOUS(AG)编码的转录因子属于一类MADS结构域家族蛋白[23]。WUS-AG负反馈回路限制了花分生组织细胞的增殖[24,25]。AG在调节个体花发育的后半部分中起到至关重要的作用,表现在调控花柱和心皮的发育和调控花朵发育的终止[26]。在拟南芥中,ULT1通过及时激活花同源基因AG,终止花分生组织中心的分生细胞活性[1]。ULT1在花分生组织的早期表达[2],并且需要在花发育的适当阶段激活AG表达,从而成为花分生组织终止途径的关键因子[3]。在水稻中,ULT1的过表达(35S∷OsULT1)同样影响水稻花分生组织的正常分化[27]。
WUSCHEL(WUS)是Homeobox转录因子[28]。WUS在这些分生组织内部的组织中心细胞中表达[28-30]。对拟南芥的遗传分析表明,WUS基因在整个发育过程中对分生组织命运的调控起着关键作用;WUS基因的突变导致茎和花分生组织不能够自我维持[31]。WUS表达和分生组织维持在花发育期间终止,以允许组织分化,并且该过程依赖于AG活性;在花分生组织中,还需要WUS诱导其自身阻遏物AG的表达[24,32]。AG抑制WUS是在花发育过程中适当时间点终止分生细胞活性的必要条件,从而使花组织中心的细胞分化为心皮[22]。AG在花发育早期阶段(阶段3)表达,而WUS在AG花发育中期阶段(阶段6)终止表达[33]。
在开花后,由于分生组织活性降低,wus突变体植株产生异常的花序和花[29,31]。wus花含不多于4个萼片和花瓣,不会形成心皮。ult1 wus双突变体可含有6或7个萼片和花瓣。在ult1花中观察到的萼片和花瓣数目的增加部分独立于WUS[34]。ULT1的突变一定程度上抑制了wus植株茎和花分生组织表型;然而,在花组织中心,WUS上位于ULT1。wus花组织比野生型小,但ult-1与之相反。ult1花分生组织中WUS被抑制自身转录的过程被延迟;ULT1通过WUS-AG暂时性反馈回路负调节WUS以保证花分生组织发育成花各部分器官,并且在ult-1花器官确定性部分丧失依赖于WUS活性[34]。大部分wus植物在没有开花的情况下终止了发育,然而ult1-1 wus植物在其基部形成分生组织细胞,表明ult1突变体恢复了wus花序分生组织的一些功能[34]。
通过酵母文库筛选到与ULT1相互作用的因子ULT1 INTERACTING FACTOR 1(UIF1)。UIF1为与ULT1相互作用的一种因子[35]。通过去除ULT1的B-box like motif和UIF1的N-terminus的酵母双杂实验,表明UIF1可以与ULT1蛋白相互作用,ULT1 B-box和UIF1 N端是这种相互作用所必需的[35]。UIF1在以下组织中均有表达:根、幼苗、花序、花,在幼苗和花序中表达水平最高,与ULT1相似[35]。ULT1和UIF1表达模式在花器官中重叠,特别是在雄蕊和心皮中[35]。UIF1和ULT1在花的形态发生过程中具有重叠的功能。UIF1调节花的形态,控制器官数量,类似于ULT1[35]。此外,UIF1调节花中的其它特征,如细胞命运和器官确定性[35]。在额外的萼片和花瓣表型方面,uif1 ult1和ult1突变表型之间没有显著差异,表明UIF1和ULT1在调节花被器官数量的相同途径中起作用[35]。
在花分生组织发育过程中,UIF1可为ULT1在WUS等靶位点提供DNA结合特异性,其包含的Myb结构域为特定的DNA结合域[36]。UIF1蛋白表现出转录抑制因子活性,UIF1具有DNA结合活性并与WUS调控元件特异结合[35]。UIF1功能丧失导致类似于ult1突变体的表型,如产生更多的花器官;提供了遗传和分子证据,UIF1在WUS启动子区拥有DNA结合位点,此外在AG序列中发现了3个UIF1结合位点。uif1突变体花产生额外器官,可见ULT1与UIF1通过彼此相互作用,直接抑制WUS表达,在花组织稳态中发挥作用[35]。
3.2 ULT1与ATX1作用影响花器官发育的表达模式
ARABIDOPSIS HOMOLOG OF TRITHORAX 1(ATX1)是拟南芥三胸腔同源蛋白[37],ATX1的SET结构域具有将甲基从供体转移到组蛋白H3赖氨酸4残基的能力,是染色质激活因子[37-39]。拟南芥基因ATX1可以调控花器官的发育,在花器官的发育、空间排列、形态等形成过程中表达[37];atx1-1纯合突变植株表现出明显的形态表型是其比野生型晚开花5~6d,伴有矮花茎和小花的表型,未开放的花蕾在雄蕊和雌蕊发育过程中都表现出异常[37]。
ATX1对几种花的同源基因表达有积极和特异的影响,其中在维持正常的AG表达水平、拮抗CURLYLEAF(CLF)的抑制活性中是必需的[3,37,39]。CURLY LEAF(CLF)是一种组蛋白甲基转移酶,是多梳抑制蛋白(polycomb repressor complex2,PRC2)的核心组成部分,其通过催化组蛋白27位赖氨酸三甲基化(H3K27me3)来抑制靶基因的转录[40,41]。植株clf纯合突变表型为小莲座叶,叶子上卷,早花以及由于未能稳定抑制花特异性基因,如植物组织中转录因子AG和APETALA3(AP3),导致的花器官同源转换,CLF一直被认为是控制叶和花形态所必需的[41,42]。clf-28在营养器官和生殖器官中表现出多种发育缺陷,如生物量减少、荚果减少或缩短、种子数减少,clf-28种子大于野生型种子[43]。功能缺失clf植株和35S∷ULT1表型与35S∷AG植株相似,在叶片和花朵中异位表达AG和AP3;由此看出,ULT1限制了CLF在AG和AP3等靶基因位点沉积H3K27me3的能力,从而充当PcG的抗抑制因子[3]。
ULT1和ATX1属于TrxG蛋白复合体[3]。ULT1通过与ATX1相互作用直接激活花组织中心AG的表达,导致靶位点组蛋白3第27位赖氨酸的三甲基标记(H3K27me3,抑制染色质标记)减少,从而影响花发育[3,44,45]。ATX1与ULT1的互作在花发育中的重要性也是不可忽视的。
4 ULT1在根中参与调节细胞分裂和生长素信号
ULT1在根中也有表达[2]。ULT1参与根分生组织龛(Root Stem Cell Niches,RSCN)维持所需的调节网络新组分,其中SCN是维持周围分生组织不分化的静态中心(Quiescent Center,QC)分裂组织细胞[46,47]。生长素信号维持QC的特征[48]。
与野生型植物不同的是,ult1-3突变体的SCN表现出不规则的形态,包括位于QC下方、和侧根冠/表皮分生组织的明显组织破坏;表明ULT1参与调控QC细胞分裂和维持SCN形态[49]。在ult1-3突变根中观察到的QC细胞分裂的增加,表明ult1对于限制QC细胞中的细胞分裂速率是必要的[49]。
据报道,ULT1和ATX1在SAM中可以相互作用,ULT1参与ATX1催化H3K4me3[3,50]。在拟南芥根尖分生组织(Root Apical Meristem,RAM)中,ULT1在不同于ATX1的机制中发挥作用[49]。atx1-1突变体植物的初生根比野生型植物的短,因为atx1调节细胞增殖和从细胞增殖到细胞伸长的转变过程[51]。ult1-3中的根长度不受影响。atx1-3 ult1-3双突变体表现为atx1-3单突变体的表型,根系比野生型(Wild Type,WT)短。此外,双突变体的RAM皮层细胞数和细胞长度与atx1-3单突变体相似。因此,这种表型是由于ATX1功能的缺失,这表明ULT1似乎不与ATX1一同调节RAM细胞增殖或初生根长度[49]。
然而,双突变体植株的小柱分生组织(ColumellaStem Cells,CSCs)更靠近ult1-3没有细胞层的表型;在分化的小柱细胞层数上(Differentiated ColumellaCells,DCCs),atx1-3 ult1-3双突变体似乎具有介于单突变体之间的中间表型。对比单突变体和双突变体,无论是在RAM还是在SCN中,都表明ULT1和ATX1在根发育的不同过程中独立起作用。ATX1似乎对调节近端分生组织更重要,而ULT1似乎在远端中起作用,特别是在CSC分化的调节中。虽然ATX1和ULT1对DCC层的形成都是必要的,但作用方式不同:ATX1似乎促进了DCC层的形成,而ULT1似乎限制了DCC层的形成[49]。
Ornelas-Ayala等人研究ult1-3突变体是否在SCN的生长素反应中有缺陷,发现在根尖中生长素集中于QC区[49];在QC和小柱细胞中,ult1-3的表达水平都降低了[49]。可见,ULT1对静态中心细胞分裂率和根尖生长素信号都有调节作用[49]。同时,ULT1调节小柱分生组织分化[49]。
此外,2018年Xu等人发现ULT1在种子萌发过程中在维持染色质的完整性以实现表观遗传沉默上发挥作用,调节幼苗中种子基因的表达,而且ATX1、EMF1、ULT1 3个基因功能同时丧失导致幼苗根系肿胀[50]。
5 ULT1参与胁迫调控过程
生物胁迫是指对植物生存与发育不利的生物因素,如病害、虫害、杂草等。而非生物胁迫是指非生物因素对植物不利的影响,如干旱、盐碱、矿物质等。在生长发育中,灵活性是响应胁迫生存的必要条件。植物通过执行一个信号响应网络来维持这种灵活性,使其能够快速地重新规划自身的发育、生理和新陈代谢,以应对环境胁迫[52]。
5.1 ULT1与EMF1响应盐胁迫反应
EMF1优先同参与生物和非生物胁迫反应的基因结合[53]。并且发现盐会增加这2种盐反应基因的转录水平[54]。在盐胁迫下,EMF1的根比野生型和ult1-3的根更长,表明EMF1幼苗比野生型和ult1-3幼苗更耐盐[54]。与野生型和ult1-3根长度相比,EMF1 ult1-3根长度的适度变化表明:ult1-3突变的引入,EMF1幼苗在耐盐性上的生长优势被削弱。野生型、ult1-3、EMF1 ult1-3植物通过盐处理表现出的茎生长抑制强于EMF1的生长抑制。因此,EMF1植物的幼苗和成体生长都更耐盐,并且这种耐盐性由于ult1-3突变的引入而降低[54]。
为了阐明EMF1介导的盐响应的分子机制,经盐处理,与野生型植物相比,在EMF1中进一步增加了盐响应基因的转录水平[54]。ult1-3中盐响应基因转录水平高于野生型植物,对EMF1和EMF1ult1-3植物之间的转录水平的比较表明,ult1-3的引入大大降低了EMF1植物中盐响应基因的转录水平[54]。去除ULT1活性,恢复了EMF1植物中这些基因的失调,这与EMF1 ult1植物的耐盐性降低到接近野生型和ult1-3植物的水平一致。ULT1和EMF1共同响应盐胁迫[54]。
由于其固着的性质,植物在其一生中可能面临来自不断变化的环境条件的各种非生物胁迫。TrxG和PcG因子对非生物胁迫反应的贡献尚不清楚。然而,H3K4me3标记在某些应激反应基因上的富集与由环境胁迫如干旱和热诱导的细胞记忆系统有关,前者涉及TrxG因子ATX1[55]。目前唯一描述的ULT1与非生物胁迫反应的关系是证明ult1-3等位基因可以减弱EMF1活性降低的植物的耐盐表型[54]。在ult1-3植物中观察到的非生物胁迫应答基因转录水平的变化是否足以赋予可量化的表型仍是一个未解决的问题。需要进一步的分子和生理分析来确定ULT1在这些基本生物过程中的作用。
5.2 ULT1调控胁迫响应基因
ULT1影响生理和代谢途径中的基因转录以及发育途径胁迫响应基因和防御响应基因富集,如在硫代葡萄糖苷代谢途径的基因,揭示了ULT1在调控生物和非生物响应途径中先前所未知的作用[48]。在ult1-3中,对刺激的响应过多,包括内源性激素反应以及非生物和生物胁迫反应[48]。植物也不断受到动物、昆虫和各种病原体的威胁,发现ULT1调节许多参与生物应激途径的基因。ULT1在调节诱导的以及先天的植物防御反应中具有迄今未知的作用,特别是在营养期[56]。此外,除了在发育中起作用的FLOWERING LOCUS C(FLC)和CRC基因外,几乎所有ULT1调控的转录因子都参与了非生物和/或生物胁迫反应[57]。可见,ULT1在胁迫方面值得进一步研究。ULT1参与调控多种途径和表型。表1介绍了拟南芥中参与ULT1作用相关基因的功能,为后续研究提供依据。
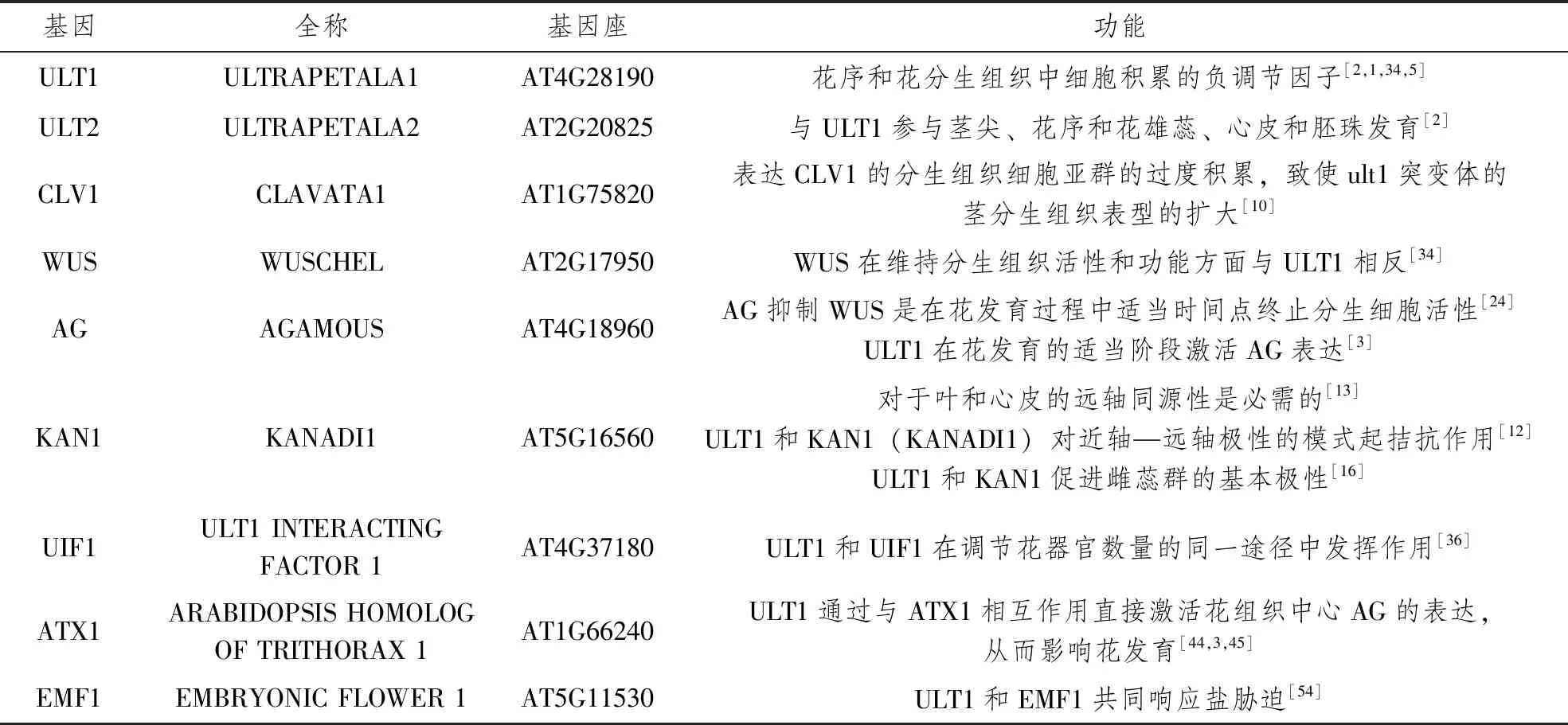
表1 拟南芥中与ULT1相关的基因的功能
6 总结与展望
对ULT1的研究主要集中在分生组织和花发育方面,其负调节分生组织的积累,通过与因子作用调节花发育。ULT1功能仍有许多方面待进一步研究:在ULT1表观遗传学修饰方面,已有报道ULT1与ATX1、UIF1、KAN1等调控发育,植物生长发育过程中普遍受到表观遗传的调控,迄今为止,已经开展了多种植物表观遗传现象的研究,ULT1作为TrxG因子,在拟南芥生命周期中,ULT1与具有不同表达模式的转录因子如UIF1和KAN相关联,说明ULT1可能同样在多个蛋白质复合物中发挥作用,对不同过程进行阶段性和组织特异性调控,ULT1与PcG调控网络还需进一步研究;植物生长发育受内在调节机制影响也受外在环境的影响,如温度、光照等协调作用进行调控,ULT1是否也被调控;ULT1基因功能的缺失没有十分明显的叶表型,其是否影响叶生长激素的含量;在根和种子方面,有关ULT1研究报道相对较少。
任何研究都需要有一些实用的价值,拟南芥作为模式植物有其生长周期短的特点,加快了研究进程,为其它作物的研究奠定了基础。到目前为止,国内外学者在水稻、玉米、杨树、葡萄等植物中得到ULT1的同源基因。关注理论研究的同时,要侧重在农业生产中对优质种选育的实用价值等方面的研究。随着美好生活到来,花卉观赏也成为人们热衷的,该基因在花发育中功能的研究也为园艺花卉开发提供新可能。
