山东省8 566例新的药品不良反应报告分析
2021-04-08刘宝生周秀丽宫凯凯
刘宝生 周秀丽 宫凯凯


摘 要 目的:了解山東省新的药品不良反应(ADR)发生的现状及特点,为保障患者用药安全提供参考。方法:调取2019年10月-2020年3月上报至山东省ADR监测中心自发呈报系统新的ADR报告的相关数据,对报告类型、上报机构、报告人职业和患者性别、年龄、药物类型、累及器官/系统、临床表现等情况进行统计分析。结果与结论:共筛选出新的ADR报告8 566例,占有效ADR的10.81%;其中新的一般的ADR有7 961例(占92.94%),新的严重的ADR有605例(占7.06%)。新的ADR中,上报机构以医疗机构(占98.42%)为主,报告人职业以医师(占78.44%)为主;女性(4 860例)略多于男性(3 698例),45岁及以上人群(占70.00%)居多;静脉滴注(占47.67%)为主要给药途径。新的ADR怀疑药品排名前5位的药品类别依次为中药制剂(34.50%)、抗微生物药物(13.75%)、循环系统用药(11.41%)、神经系统用药(6.39%)、血液系统药物(4.81%),分别涉及517、91、64、53、50个品种,其中左氧氟沙星注射液致新的严重的ADR数量最多(24例)。新的一般的ADR主要累及胃肠系统、皮肤及其附件,临床表现为恶心、呕吐、皮疹等;新的严重的ADR主要造成全身性损害,临床表现为过敏性休克、胸闷、寒战等。建议临床加强对中药制剂、抗微生物药物、循环系统用药等药物的ADR监测,保障患者临床用药安全。
关键词 山东省;新的;药品不良反应;报告分析;用药安全
ABSTRACT OBJECTIVE: To investigate the occurrence and characteristics of new adverse drug reactions (ADR) in Shandong province, so as to provide reference for the safety of drug use in the clinic. METHODS: The data of new ADR reports were collected from Spontaneous Reporting System of Shandong ADR Monitoring Center during Oct. 2019 to Mar. 2020. Those reports were analyzed statistically in respects of report types, reporting institution, reporters occupation, gender and age of patients, drug type, organs/systems involved, clinical manifestations. RESULTS & CONCLUSIONS: A total of 8 566 new ADR reports were screened out, accounting for 10.81% of the effective ADRs. Among them, there were 7 961 new and general ADR (92.94%) and 605 new and serious ADRs (7.06%). For the new ADR, the reporting institutions were mainly medical institutions (98.42%), and the reporters occupation were mainly doctors (78.44%). Female (4 860 cases) was slightly more than male (3 698 cases); most of them were 45 years old and above (70.00%), and intravenous drip (47.67%) was the main route of administration. The top five ADR suspected drugs were TCM preparations (34.50%), anti-microbials (13.75%), circulatory system drugs (11.41%), nervous system drugs (6.39%) and blood system drugs (4.81%), involving 517, 91, 64, 53, 50 types, respectively, among which Levofloxacin injection caused the most serious ADR (24 cases). The new and general ADR mainly involved gastrointestinal system, skin and its appendant; their clinical manifestations were nausea, vomiting, rash, etc. New and serious ADR mainly caused systemic damage; their clinical manifestations were anaphylactic shock, chest tightness and shivering, etc. It is suggested to strengthen the ADR monitoring of TCM preparations, anti-microbials, circulatory system drugs and other drugs, so as to ensure the safety of clinical drug use.
KEYWORDS Shandong province; New; Adverse drug reactions; Report analysis; Safety of drug use
药品不良反应(ADR)监测工作是药品上市后安全监管的重要支撑,其目的是及时发现、控制药品安全风险。根据国家药品监督管理局发布的数据显示,我国ADR上报数量从1999年至2019年呈逐年上升趋势,其中新的和严重的ADR一直是ADR监测评价工作的重点内容[1]。为了解山东省新的ADR发生的现状及特点,笔者对2019年10月-2020年3月上报至山东省ADR监测中心自发呈报系统的新的ADR报告进行数据汇总和分析,旨在为保障患者用药安全提供参考。
1 资料与方法
1.1 资料来源
调取2019年10月1日-2020年3月31日山东省ADR监测中心自发呈报系统收集到的新的ADR报告的相关数据,筛选关联性评价为“肯定”“很可能”“可能”的ADR报告。
1.2 评价标准
2011年7月1日起施行的《药品不良反应报告和监测管理办法》[2]对新的ADR、一般的ADR和严重的ADR都作了明确的规定,其中新的ADR是指药品说明书中未载明的ADR;药品说明书中已有描述,但ADR发生的性质、程度、后果或者频率与药品说明书描述不一致或者更严重的,按照新的ADR处理;一般的ADR是指严重程度为轻、中度的ADR;严重的ADR是指可引起以下损害之一的ADR:(1)死亡,(2)危及生命,(3)致癌、致畸、致出生缺陷,(4)导致严重的或者永久的人体伤残或器官损害,(5)导致住院或者住院时间延长,(6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的ADR。
ADR报告累及器官/系统分类参照《世界卫生组织药品不良反应术语集》,当同一报告涉及多种临床表现时,只统计主要临床表现。
药品分类统计以国家ADR数据库的药品分类方法为基础,参考《新编药物学(第17版)》进行分类[3]。不同厂家生产的同一通用名(包括不同剂型)的药品记为同一品种。
1.3 数据处理
采用Excel 2010软件和手工检索方式对纳入的新的(包括新的一般的、新的严重的)ADR报告的报告类型、上报机构、报告人职业和患者年龄、性别、ADR关联性及转归情况、怀疑药品的剂型和给药途径、怀疑药品的种类及分布情况、重点监控药品、ADR累及器官/系统和临床表现等项目进行统计、分析。
2 結果
2.1 ADR基本信息
2.1.1 ADR报告类型 山东省ADR监测中心2019年10月-2020年3月共收集有效(即填写完整)ADR报告79 255例,其中新的ADR报告8 566例(占10.81%)。新的ADR报告中,一般的ADR有7 961例(占92.94%)、严重的ADR有605例(占7.06%)。
2.1.2 上报机构及报告人职业 8 566例新的ADR报告中,医疗机构共上报8 431例(占98.42%),为新的ADR报告的上报主体;经营企业共上报131例,个人共上报4例,分别占1.53%、0.05%。报告人职业分布为医师、护士、药师、监测员及其他。其中,医师共上报6 719例(占78.44%),为新的ADR报告的上报主体;药师共上报1 020例,护士共上报667例,监测员共上报6例,其他职业人员(如药企质管员、医务科科员)共上报154例,分别占11.91%、7.79%、0.07%、1.80%。
2.2 患者基本情况
8 566例新的ADR报告中,除8例报告未说明性别外,其余8 558例报告中女性4 860例、男性3 698例。新的ADR在不同年龄段均有分布,其中以45岁及以上人群为主,占70.00%,详见表1。
2.3 ADR关联性和患者转归
8 566例新的ADR报告中,关联性评价“肯定”的有381例,“很可能”的有1 945例,“可能”的有6 240例,分别占4.45%、22.71%、72.85%。患者治愈的有4 688例,占54.73%;好转的有3 789例,占44.23%;未好转的有22例,占0.26%;结果不详的有67例,占0.78%。
2.4 ADR的给药途径
8 566例新的ADR报告涉及的给药途径主要包括静脉滴注4 083例(占47.67%)、口服3 531例(占41.22%)、静脉注射196例(占2.29%)、肌内注射147例(占1.72%)、局部外用107例(占1.25%)等,详见表2。
2.5 ADR怀疑药品类别
8 566例新的ADR报告怀疑药品共涉及17类、1 158个品种。其中,新的ADR涉及药品类别排名前5位的依次为中药制剂(2 955例,占34.50%)、抗微生物药物(1 178例,占13.75%)、循环系统用药(977例,占11.41%)、神经系统用药(547例,占6.39%)、血液系统药物(412例,占4.81%),分别涉及517、91、64、53、50个品种,详见表3。
2.6 ADR高频药品类别的药品分布
由表3结果显示,中药制剂、抗微生物药物、循环系统用药和神经系统用药导致新的ADR数量较多,所以进一步分析其药品分布情况。由于中药制剂说明书中安全性描述不完善,所以本研究对其新的一般的、新的严重的ADR的药品分布进行分析。后3种药品的说明书安全性描述较完善,所以仅对其新的严重的ADR的药品分布进行分析。
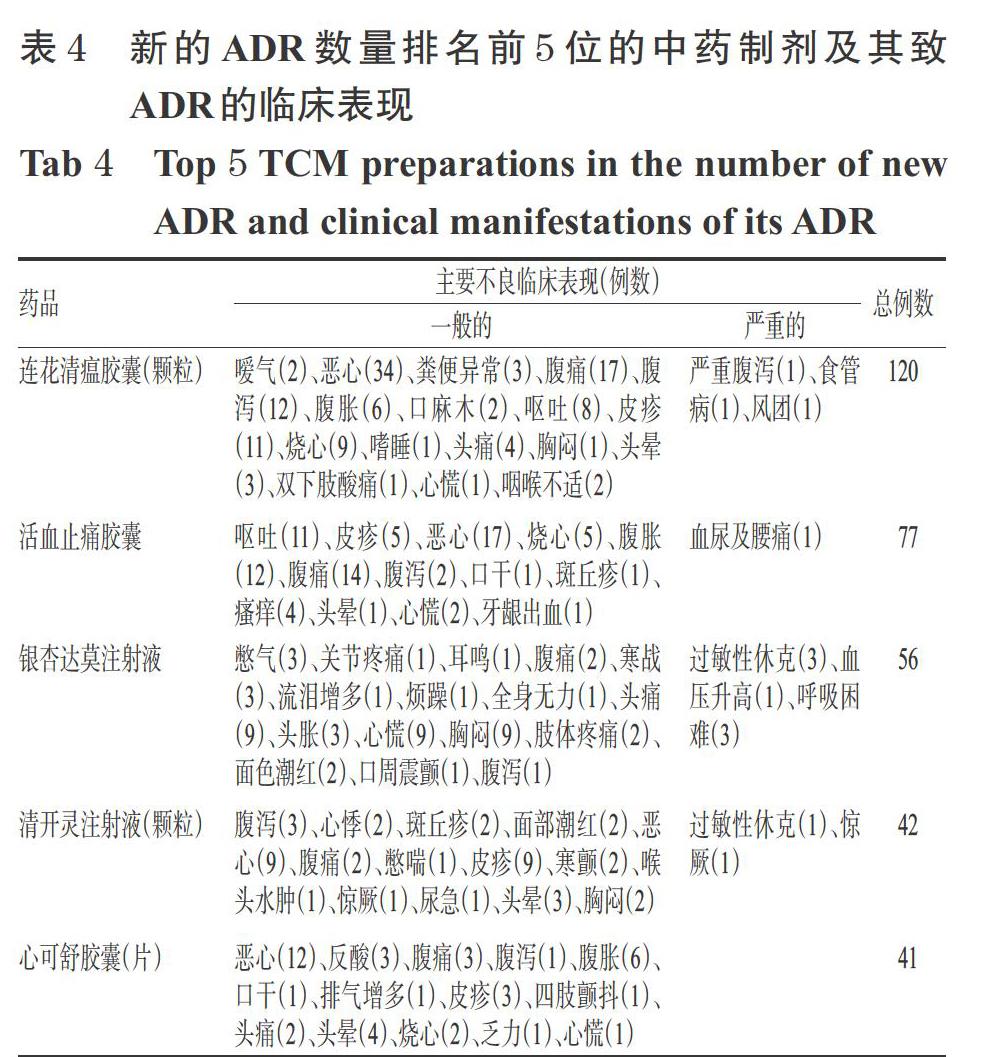
2.6.1 中药制剂 2 955例中药制剂的新的ADR报告共涉及517个品种。在新的ADR怀疑药品类别和数量排名中,中药制剂均位于首位,其中新的ADR数量排名前5位的药品依次为连花清瘟胶囊(颗粒)、活血止痛胶囊、银杏达莫注射液、清开灵注射液(颗粒)、心可舒胶囊(片),分别有120、77、56、42、41例,主要不良临床表现见表4。
2 955例报告中,新的一般的ADR有2 838例(占96.04%),主要累及器官/系统包括胃肠道系统、皮肤及其附件、神经系统,大部分经及时停药后均可自愈。新的严重的ADR有117例(占3.96%),主要为全身性损害;其怀疑药品剂型包括注射剂型(69例)、口服剂型(41例)、外用剂型(7例),其中ADR数量排名前5位的药品依次为参麦注射液(11例)、银杏达莫注射液(7例)、丹参注射液(6例)、醒腦静注射液(6例)、血塞通注射液(4例)。
2.6.2 抗微生物药物 1 178例抗微生物药物的新的ADR报告共涉及91个品种。在新的ADR怀疑化学药品中,抗微生物药物为首位,其ADR数量排名前10位的药品依次为左氧氟沙星(207例)、头孢曲松钠(73例)、阿奇霉素(70例)、克林霉素(67例)、哌拉西林钠他唑巴坦钠(56例)、头孢呋辛(49例)、头孢哌酮钠舒巴坦钠(40例)、头孢唑林钠(35例)、阿莫西林克拉维酸钾(32例)、甲硝唑(31例)。
1 178例报告中,新的一般的ADR有1 056例(占89.64%),主要累及器官/系统包括胃肠道系统和神经系统,大部分经及时停药后均可以自愈。新的严重的ADR有122例(占10.36%),主要包括全身性损害、神经系统损害和呼吸系统损害;其药品剂型包括注射剂型(114例)、口服剂型(7例)、滴眼剂(1例),其中数量排名前5位的药品依次为左氧氟沙星注射液(24例)、注射用头孢曲松钠(15例)、注射用哌拉西林钠他唑巴坦钠(11例)、注射用头孢呋辛钠(6例)、注射用阿奇霉素(6例),主要不良临床表现见表5。
2.6.3 循环系统用药 977例循环系统用药的新的ADR报告共涉及64个品种,剂型以注射剂型为主(673例),其次为口服剂型(304例)。致新的ADR数量排名前10位的药品依次为注射用环磷腺苷葡胺(122例)、硝苯地平片(缓释片)(87例)、单硝酸异山梨酯注射液(片)(81例)、川芎嗪注射液(63例)、注射用葛根素(62例)、倍他司汀注射液(片)(55例)、七叶皂苷钠注射液(53例)、己酮可可碱注射液(50例)、丹参酮ⅡA磺酸钠注射液(36例)、注射用阿魏酸钠(26例)。
977例报告中,新的一般的ADR有897例(占91.81%),主要累及器官/系统包括胃肠道系统、皮肤及其附件,大部分经及时停药后均可自愈。新的严重的ADR有80例(占8.19%),主要包括全身性损害和心血管系统损害;其怀疑药品剂型包括注射剂型(67例)、口服剂型(13例),其中数量排名前5位的药品依次为注射用环磷腺苷葡胺(23例)、川芎嗪注射液(8例)、注射用葛根素(7例)、单硝酸异山梨酯注射液(6例)、注射用倍他司汀(6例),主要不良临床表现见表6。
2.6.4 神经系统用药 547例神经系统用药的新的ADR报告共涉及53个品种,剂型以注射剂型为主(432例),有少量口服制剂(115例)。致新的ADR数量排名前10位的药品依次为天麻素注射液(97例)、注射用吡拉西坦(67例)、注射用乙酰谷酰胺(61例)、硫辛酸注射液(49例)、胞磷胆碱钠注射液(片)(41例)、硫酸镁注射液(36例)、盐酸氟桂利嗪胶囊(14例)、三磷酸胞苷二钠注射液(13例)、丁苯酞注射液(胶囊)(11例)、奥氮平片(10例)。
547例报告中,新的一般的ADR有488例(占89.21%),主要累及器官/系统包括胃肠道系统、皮肤及其附件,大部分经及时停药后均可自愈。新的严重的ADR有59例(占10.79%),主要包括全身性损害和神经系统损害;其怀疑药品剂型包括注射剂型(44例)、口服制剂(15例),其中数量排名前5位的药品依次为天麻素注射液(10例)、胞磷胆碱钠注射液(片)(7例)、三磷酸胞苷二钠注射液(7例)、吡拉西坦注射液(6例)、注射用乙酰谷酰胺(3例),主要不良临床表现见表7。
3 讨论
3.1 ADR基本情况分析
在8 566例新的ADR报告中,上报机构以医疗机构为主,报告人职业以医师为主,新的一般的为主要类型,大多数ADR虽经停药后无需特殊处理即可自愈,但会在一定程度上影响患者的用药依从性。总的来看,发生新的ADR的女性患者略多于男性。有研究指出,药物在体内的吸收、分布、代谢和排泄这4个过程均有显著的性别差异,这可能是女性ADR例数多于男性的原因之一[4]。本研究发现,各年龄段患者均可能发生新的ADR,其中45~64岁年龄段发生例数最多,其次为65岁及以上年龄段,这可能与中老年人脏器结构及生理功能衰退,从而导致药物代谢及机体对药物的反应性等发生变化有关[5-6]。在给药途径分布的分析中,笔者发现静脉滴注及口服为导致新的ADR的主要给药途径,与国家药品监督管理局发布的2019年度国家ADR监测年度报告基本相符[1]。但与以往相关报道[1,7]不同的是,本研究发现中药制剂为导致新的ADR的主要药品,其次为抗微生物药物。笔者查看中药制剂的药品说明书发现,其ADR及禁忌证等安全性描述较少,临床使用时可供医师参考的资料有限,这可能是该类制剂易诱发药品说明书中未记载的ADR的原因之一[8]。建议在使用中药制剂时,药师一定要做好用药监护与用药教育,尤其在使用中药注射剂时,严禁其与其它药物配伍使用,一旦发生ADR应及时停药并根据症状严重程度给予对症处理;此外,建议中药制剂生产企业根据上市后的安全性再评价结果及时补充ADR和禁忌证等相关安全数据,完善药品说明书,促进中药制剂的安全使用。
3.2 中药制剂致ADR分析
从新的ADR数量排序来看,前5位中药制剂主要为清热解毒类和活血化瘀类,以口服剂型为主,其中连花清瘟胶囊(颗粒)引发新的ADR占比最高,该药主要用于治疗流行性感冒(属热毒袭肺证),是呼吸系统疾病治疗中常用的复方制剂。本研究数据提取时间集中在冬、春季节,是呼吸道疾病的高发期,连花清瘟胶囊(颗粒)用量增加,从而导致其ADR占比也随之升高。连花清瘟胶囊(颗粒)引发的新的严重的ADR较少见,以新的一般的ADR为主要类型,由于其为口服给药,故胃肠道系统为其ADR主要累及器官/系统。引发新的严重的ADR中药制剂主要为活血化瘀类注射剂,例如参麦注射液、银杏达莫注射液等,该类药物成分较复杂且稳定性较差,当其进入血液循环后易引起全身性损害的发生[9],主要临床表现为过敏性休克、呼吸困难等。因为过敏性休克大多为速发型,所以建议密切观察患者给药后30 min内,尤其是前5 min内的反应,一旦出现过敏性休克相关症状应及时停药并做好急救准备[10-11]。
3.3 抗微生物药物致ADR分析
抗微生物药物是ADR监测工作关注的重点[1]。本研究发现,抗微生物药物致新的ADR的数量次于中药制剂,位居第2位,但引起新的严重的ADR数量却居首位,且以注射剂型为主。这可能与该类药物的广泛应用有关,同时也提示其可能存在不合理使用的现象。其中,引发新的ADR数量最多的药品是左氧氟沙星,该药不需皮试,抗菌谱广且作用强,故应用广泛[12];左氧氟沙星为浓度依赖型抗菌药物,其杀菌作用主要取决于峰浓度,目前主要推崇大剂量每日1次或2次给药,且应用的单剂量有增大的趋势,这可能会进一步增加其ADR发生率、发生强度以及细菌耐药率[13]。对于抗微生物药物临床使用的不合理现象,需要临床科室、药学部门和行政部门共同加强管理,规范抗微生物药物的使用,避免滥用和不合理使用,以防严重ADR的发生。
3.4 循环系统和神经系统用药致ADR分析
本研究发现,在循环系统和神经系统用药中引发新的ADR较多的药品除单硝酸异山梨酯为心血管疾病治疗的一线药物外,其余均为心脑血管相关疾病中常用的辅助用药,其药理作用主要为扩张血管、改善微循环及营养神经。新的ADR人群以45岁及以上的中老年人(70.00%)为主,这可能与其广泛使用扩张血管、改善微循环以及营养神经类药物有关[14-15]。此外,心血管疾病患者通常联用多种药物,联合用药虽可有效提高患者的临床治疗效果,但不合理的联合用药也会增加ADR的发生风险[16]。循環系统和神经系统用药中引发新的严重的ADR药品均为注射剂为主,主要造成全身性损害等,临床表现包括高热、寒战、呼吸困难、低血压等。这无疑增加了基础疾病较多的老年人的用药风险。药师建议在老年患者使用心脑血管辅助治疗药物时,临床医师应充分考虑其生理特点,遵循个体化用药、处方精简、剂量与给药途径适宜等合理用药原则,同时加强用药监护力度,减少ADR的发生、保障临床用药安全。
综上所述,2019年10月-2020年3月山东省新的ADR发生特点主要表现为:女性患者略多于男性,45岁及以上者为主要涉及人群,以静脉滴注为主;新的ADR怀疑药品以中药制剂为主,新的严重的ADR怀疑药品以抗微生物药物为主;新的一般的ADR主要累及胃肠道系统、皮肤及其附件,临床表现为恶心、呕吐、皮疹等,新的严重的ADR主要造成全身性损害,临床表现为过敏性休克、胸闷、寒战等。
参考文献
[ 1 ] 国家药品监督管理局.国家药品不良反应监测年度报告:2019年[EB/OL].(2020-04-13)[2020-09-20]. https://www.nmpa.gov.cn/xxgk/yjjsh/ypblfytb/20200413094901811.html.
[ 2 ] 卫生部.药品不良反应报告和监测管理办法[S/OL].(2011-05-04)[2020-09-20]. http://www.gov.cn/gongbao/con-tent/2011/content_2004739.htm.
[ 3 ] 陈新谦,金有豫,汤光.新编药物学[M]. 17版.北京:人民卫生出版社,2011:34-939.
[ 4 ] 牟永晓,曹云超.性别差异对药物作用影响的研究进展[J].吉林医药学院学报,2017,38(1):69-71.
[ 5 ] CHISAKI Y,AOJI S,YANO Y. Analysis of adverse drug reaction risk in elderly patients using the Japanese adverse drug event repor(JADER)database[J]. Biol Pharm Bull,2017,40(6):824-829.
[ 6 ] 邹林珂,闫峻峰,兰姗,等. 2013-2019年四川省老年患者药品不良反应的回顾性分析[J].中国药房,2020,31(22):2757-2762.
[ 7 ] 徐帆,张云玲.我院2013-2014年151例新的药品不良反应报告分析[J].中国药房,2015,26(32):4510-4512.
[ 8 ] 李上馨.北京市药品生产企业中药不良反应数据分析:2009-2013年[D].北京:北京中医药大学,2016.
[ 9 ] 靳梦亚,李志远,曹俊岭,等. 2016-2019年北京中医药大学东方医院中药注射剂致药品不良反应报告分析与探究[J].中国医院用药评价与分析,2020,20(8):1009- 1012.
[10] 朱晓峰,谢天红. 58例银杏达莫注射液不良反应分析[J].浙江实用医学,2014,19(3):220-221.
[11] 张明,杨洋,叶伟军,等.参麦注射液致过敏性休克文献分析[J].中国药物应用与监测,2019,16(3):165-167.
[12] 邢铁清,杨震华,王文娟.盐酸左氧氟沙星氯化钠注射液引起的不良反应分析[J].中国药物与临床,2017,17(6):916-918.
[13] 金朝辉,樊新星,钟光德,等.左氧氟沙星不合理应用的危害与建议[J].中国药房,2007,18(17):1281-1283.
[14] WINDHABER T,KOULA MI,NTZANI E,et al. Educational strategies to train healthcare professionals across the education continuum on the process of frailty prevention and frailty management:a systematic review[J]. Aging Clin Exp Res,2018,30(12):1409-1415.
[15] 樊凡,杨翠,王庆松.衰弱与老年心脑血管疾病关系的研究进展[J].中华老年心脑血管病杂志,2019,21(2):207-210.
[16] 肖剑光.心血管疾病联合用药中不良反应以及合理用药探讨[J].心血管病防治知识,2019,9(12):52-53.
(收稿日期:2020-10-16 修回日期:2021-01-20)
(编辑:邹丽娟)
