愈疡胶囊对细菌感染皮炎模型大鼠的抗炎作用及对TLR/NF-κB通路的影响
2021-04-08罗伦才童妍张兴国陈礴钟振东
罗伦才 童妍 张兴国 陈礴 钟振东


摘 要 目的:研究愈疡胶囊对细菌感染皮炎模型大鼠的抗炎作用及对Toll样受体/核因子κB(TLR/NF-κB)通路的影响。方法:采用肉汤稀释法测定愈疡胶囊对金黄色葡萄球菌的最低抑菌浓度(MIC)和最低杀菌浓度(MBC)。将50只大鼠随机分为模型组、阳性对照组(阿莫西林克拉维酸钾,以阿莫西林计120 mg/kg)和愈疡胶囊高、中、低剂量组(根据MIC设定),每组10只。以金黄色葡萄球菌感染大鼠烧伤皮肤构建细菌感染皮炎模型。造模成功24 h后,各药物组大鼠灌胃相应药物,模型组大鼠灌胃等体积生理盐水,每日1次,连续7 d。计算给药第1、3、5、7天各组大鼠皮肤愈合率并记录创面结痂、脱痂、愈合情况;使用酶联免疫吸附试验法检测皮肤组织中白细胞介素1β(IL-1β)、IL-6、IL-10、腫瘤坏死因子α(TNF-α)、羟脯氨酸(HYP)、胶原蛋白Ⅰ(Col Ⅰ)、Col Ⅲ的含量;使用苏木精-伊红染色法观察皮肤组织形态学变化,并使用透射电子显微镜观察超微结构;采用Western blotting法检测皮肤组织中Toll样受体2(TLR2)、TLR4与磷酸化-NF-κB-p65(p-NF-κB p65)蛋白表达水平。结果:愈疡胶囊的MIC与MBC分别为25 mg/mL和50 mg/mL,愈疡胶囊高、中、低剂量组分别设为600、300、150 mg/kg。与模型组比较,愈疡胶囊高、中剂量组大鼠给药3 d后伤处皮肤出现结痂,给药5~7 d后部分大鼠伤处出现脱痂;阳性对照组和愈疡胶囊高、中剂量组大鼠各时间点的皮肤愈合率均显著升高,IL-1β、IL-6、IL-10、TNF-α含量和病理评分以及TLR2、TLR4、p-NF-κB p65蛋白表达水平均显著降低(P<0.05或P<0.01),皮肤组织炎细胞浸润等病理改变好转;阳性对照组和愈疡胶囊高剂量组大鼠的HYP、Col Ⅰ、Col Ⅲ含量均显著升高(P<0.05或P<0.01)。而阳性对照组和愈疡胶囊高、中剂量组上述指标差异大多无统计学意义(P>0.05)。结论:愈疡胶囊可促进细菌感染皮炎模型大鼠皮肤愈合,具有一定的抗炎作用,其机制可能与抑制TLR/NF-κB信号通路、减少炎症反应有关。
关键词 愈疡胶囊;细菌感染;感染性皮炎;Toll样受体/核因子κB信号通路;抑菌抗炎;大鼠
ABSTRACT OBJECTIVE: To study the anti-inflammatory effects of Yuyang capsule on bacterial dermatitis model rats and its effect on TLR/NF-κB pathway. METHODS: Minimum inhibition concentration (MIC) and minimal bactericidal concentration (MBC) of Yuyang capsule against Staphylococcus aureus were determined by microdilution test. Totally 50 SD rats were randomly divided into model group, positive control group (amoxicillin and clavulanate potassium, 120 mg/kg as amoxicillin), Yuyang capsules high-dose, medium-dose and low-dose groups (according to MIC), with 10 rats in each group. The model of bacterial dermatitis was established by using the burned skin of rats infected with S. aureus. 24 h after modeling, administration groups were intragastrically given the corresponding drug, and model group was intragastrically given the same amount of normal saline, once a day, for consecutive 7 days. The skin healing rate was calculated on the 1st, 3rd, 5th and 7th day of administration, and the scab formation, decrustation and healing were recorded. The contents of IL-1β, IL-6, IL-10, TNF-α, hydroxyproline (HYP), collagen Ⅰ (Col Ⅰ) and Col Ⅲ in skin tissue were detected by ELISA. Morphology changes of skin tissues were observed by HE staining. The ultrastructure was observed by transmission electron microscope. Protein expression of TLR2, TLR4 and p-NF-κB p65 were detected by Western blotting assay. RESULTS: MIC and MBC of Yuyang capsule were 25 mg/mL and 50 mg/mL, respectively. Dose of Yuyang capsules high-dose, medium-dose and low-dose groups were set at 600, 300, 150 mg/kg. Compared with model group, scab appeared on the injured skin 3 days after administration in Yuyang capsule high-dose and medium-dose groups, and decrustation appeared on the injured skin of part mice 5-7 days after administration; the skin healing rate of the positive control group, Yuyang capsule high-dose and medium-dose groups were all significantly increased at each time point. The contents of IL-1β, IL-6, IL-10 and TNF-α, pathological score, protein expression of TLR2, TLR4 and p-NF-κB p65 were decreased significantly (P<0.05 or P<0.01); the pathological changes such as inflammatory cell infiltration in skin tissue were improved. The contents of HYP, Col Ⅰ and Col Ⅲ were increased significantly in positive control group and Yuyang capsule high-dose group (P<0.05 or P<0.01). There was no statistical significance in most above indexes in positive control group, Yuyang capsule high-dose and medium-dose groups (P>0.05). CONCLUSIONS: Yuyang capsule can promote skin healing of bacterial dermatitis model rats and shows certain anti-inflammatory effects; the mechanism may be related to inhibiting TLR/NF-κB signaling pathway and reducing inflammatory response.
KEYWORDS Yuyang capsules; Bacterial infection; Infectious dermatitis; TLR/NF-κB signaling pathway; Antibacterial and anti-inflammatory; Rat
金黄色葡萄球菌Staphylococcus aureus是一种革兰氏阳性菌,常在人前鼻孔和皮肤中定植,是绝大多数皮肤和软组织感染的主要病原体[1]。金黄色葡萄球菌可导致多种感染,是造成慢性创面皮肤伤口感染的主要原因之一,也是引起术后感染性并发症的关键[2]。目前临床治疗金黄色葡萄球菌感染主要以抗生素为主,但存在细菌耐药的风险[3]。因此,寻找新的有效的抗菌制剂就变得十分重要。
愈疡胶囊是凉山彝族自治州第二人民医院独具特色的院内制剂之一,其主要成分为山药与蜂蜡,主要功效为生肌、敛疮、散结、止痛,临床多用于治疗溃疡性口腔炎、乳腺增生、卵巢囊肿等症。临床实践显示,在60例卵巢囊肿患者中,愈疡胶囊治疗的总有效率达到90%[4];药效学与毒理学实验表明,该药能通过调节大鼠体内激素分泌水平来改善乳腺增生,且长期用药未见明显毒性反应[5]。根据我院临床治疗经验与笔者前期预实验结果表明,愈疡胶囊具有抗菌消炎等作用,但该制剂发挥上述作用的具体机制尚不明确。
Toll样受体/核因子κB(TLR/NF-κB)通路是经典的炎症通路,细菌等病原微生物感染可导致该通路的激活,诱导炎症因子的释放,从而促进炎症反应的发生,这也是创面皮肤伤口愈合缓慢的原因之一[6-7]。基于此,本文研究了愈疡胶囊对细菌感染皮炎模型大鼠的抗炎作用及对TLR/NF-κB通路的影响,旨在为扩大愈疡胶囊的临床应用、促进相关药物研发提供实验依据。
1 材料
1.1 主要仪器
本研究所用主要仪器有:SpectraMAX Plus384型酶标仪[美谷分子仪器(上海)有限公司]、PHY-Ⅲ型病理组织漂烘仪(常州市中威电子仪器有限公司)、DHP-9012型电热细菌培养箱(上海一恒科学仪器有限公司)、BA400 Digital型数码三目摄像显微镜(麦克奥迪实业集团有限公司)、JEM-1400 PLUS型透射电子显微镜(日本JEOL公司)、优普超纯水制造系统(成都超纯科技有限公司)、DZKW-4型电子恒温水浴锅(北京中兴伟业仪器有限公司)、JY200C型电泳仪和JY-SCZ4+型垂直电泳槽(北京君意东方电泳设备有限公司)、5200型化学发光凝胶成像仪(上海天能科技有限公司)、THZ-98A恒温振荡器(上海一恒科学仪器有限公司)。
1.2 主要药品与试剂
愈疡胶囊[批号190901,川药制字Z200800943,规格0.45 g/粒(1 g药粉相当于原生药1.5 g)]由凉山彝族自治州第二人民医院制备,阿莫西林克拉维酸钾(14 ∶ 1)干混悬剂[批号190315,规格600 mg(阿莫西林) ∶ 42.9 mg(克拉维酸)]购自上海海虹实业(集团)巢湖今辰药业有限公司,大鼠白细胞介素1β(IL-1β)、IL-6、IL-10、肿瘤坏死因子α(TNF-α)、羟脯氨酸(HYP)、胶原蛋白Ⅰ(Col Ⅰ)、Col Ⅲ酶联免疫吸附测定(ELISA)试剂盒(批号ZC- 36391、ZC-36404、ZC-36379、ZC-37624、ZC-37113、ZC- 36122、ZC-36009)均购自上海茁彩生物科技有限公司,兔TLR2单克隆抗体、兔TLR4多克隆抗体、兔磷酸化-NF-κB p65(p-NF-κB p65)多克隆抗体、生物素化山羊抗兔免疫球蛋白G(IgG)二抗均购自艾博抗(上海)贸易有限公司,兔β-肌动蛋白(β-actin)单克隆抗体购自武汉爱博泰克生物科技有限公司,ECL发光试剂盒(批号KF001)购自安诺伦(北京)生物科技有限公司,5×十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)蛋白上样缓冲液(批号AR1112-10)购自博士德生物工程有限公司;20×TBST缓冲液(批号28360)购自赛默飞世尔科技(中国)有限公司;MH肉汤购自广州环凯微生物科技有限公司,牛肉膏蛋白胨琼脂培养基购自杭州微生物试剂有限公司,苏木精染液和伊红染液均购自武汉赛维尔生物技术有限公司;其余试剂均为分析纯或实验室常用规格,水为超纯水。
1.3 动物
SPF级SD大鼠,雌雄各半,体质量(230±20) g,由成都达硕实验动物有限公司提供,动物生产许可证号为SCXK(川)2020-030。
1.4 菌株
金黄色葡萄球菌购自中国普通微生物菌种保藏管理中心。
2 方法
2.1 菌懸液的制备
在净化工作台中,将金黄色葡萄球菌接种到牛肉膏蛋白胨琼脂培养基上,于37 ℃、5%CO2培养箱中倒置培养18 h进行复苏。取出复苏后的细菌,挑选单个菌落至MH肉汤中,于37 ℃、150 r/min条件下培养12 h。取上述细菌适量,使用无菌生理盐水制成1.5×108 CFU/mL的菌悬液,再用MH肉汤稀释至1×106 CFU/mL,并于30 min内完成后续接种。
2.2 受试药液的制备
取愈疡胶囊微粉10 g,溶于无菌生理盐水100 mL中,制成质量浓度为100 mg/mL的药液,作为最大浓度;再用无菌生理盐水倍比稀释成50.00、25.00、12.50、6.25、3.12、1.56、0.78、0.39 mg/mL的药液,备用。
2.3 最低抑菌浓度(MIC)和最低杀菌浓度(MBC)的测定
参照文献[8]采用肉汤稀释法进行测定。取“2.2”项下各质量浓度的受试药液,按180 μL/孔加入至经消毒处理过的96孔板中(每质量浓度设置3个复孔),随后按20 μL/孔加入“2.1”项下菌悬液。同时,设置阳性对照孔(只加入菌悬液20 μL)、阴性对照孔(只加入MH肉汤20 μL)、空白对照孔(只加入无菌生理盐水20 μL),各设置3个复孔。将96孔板置于37 ℃培养箱中培养18 h后取出,以肉眼和显微镜观察,并以显微镜下无明显细菌生长的孔所对应的药液质量浓度为MIC。取肉眼观察无细菌生长的菌液各0.1 mL移种至不含药物的牛肉膏蛋白胨琼脂培养基上,于37 ℃培养箱中培养18 h,以培养基中菌落计数少于5个的孔对应的药液质量浓度作为MBC。
2.4 分组与造模
将50只大鼠随机分成5组,即模型组、阳性对照组(阿莫西林克拉维酸钾,以阿莫西林计120 mg/kg,按每日成人临床常用剂量换算)和愈疡胶囊高、中、低剂量组(以1倍MIC换算剂量作为中剂量,以2倍中剂量和1/2中剂量分别作为高、低剂量),每组10只。造模前24 h,用8%硫化钠溶液脱去大鼠背部被毛;造模时,各组大鼠腹腔注射3%戊巴比妥钠溶液(20 mL/kg)进行麻醉,将20 g砝码烧红,冷却10 s后贴于大鼠背部,烫伤10 s,伤处涂抹金黄色葡萄球菌溶液(浓度为1×106 CFU/mL,溶剂为生理盐水)1 mL,待其自然均匀分布,以患处出现大量黄、白色脓液,溃疡,红肿为细菌感染性皮炎模型复制成功标志。
2.5 药物干预
造模成功24 h后,模型组大鼠灌胃等体积生理盐水,各干预组大鼠灌胃对应药物(20 mL/kg),每日1次,连续7 d。末次给药后,同“2.4”项下方法麻醉后,处死大鼠,收集伤处皮肤组织,部分组织于-80 ℃下保存,剩余组织在4%多聚甲醛-2%戊二醛固定液中固定,分别用于相关指标检测、表征和形态学观察。
2.6 大鼠皮肤组织表征观察
观察各组大鼠给药第1、3、5、7 天时的一般体征和积脓、红肿、溃疡等表现,肉眼观察伤口结痂、脱痂和愈合等情况,同时利用描绘创面的透明硫酸纸面积计算创面愈合率:创面愈合率(%)=(原始创面面积-未愈合创面面积)/原始创面面积。
2.7 大鼠皮肤组织中炎症因子和纤维蛋白含量测定
取冻存的皮肤组织适量,按照ELISA试剂盒说明书操作,使用酶标仪于450 nm波长处测定光密度(OD)值并计算各组大鼠皮肤组织中IL-1β、IL-6、IL-10、TNF-α、HYP、Col Ⅰ、Col Ⅲ的含量。
2.8 大鼠皮肤组织形态学观察
参考文献[9]方法,取固定好的皮肤组织适量,经包埋后切片,使用苏木精-伊红(HE)染料进行染色,在数码三目摄像显微镜下观察,评价各组大鼠皮肤组织形态学变化。病理评分标准:正常组织,无明显损伤,记0分。表皮层鳞状上皮层次仅局部超过2~3层,略有增厚;真皮层浅层有少量的炎细胞浸润;可见少量坏死区域及肉芽组织,符合上述任一项者,记1分。表皮层鳞状上皮层次明显增厚;真皮层下均有中等量炎细胞浸润;真皮层可见局灶坏死区域及肉芽组织,符合上述任一项者,记2分。表皮层鳞状广泛增厚并使黏膜凹凸不平;真皮层大量广泛的炎细胞浸润;真皮层可见大量坏死区域及肉芽组织,符合上述任一项者,记3分[9]。
2.9 大鼠皮肤组织超微结构观察
取固定好的皮肤组织适量,使用透射电子显微镜观察各组大鼠成纤维细胞分布排列情况,胶原纤维分布排列情况、紧密程度,上皮细胞排列分布情况、结构是否完好。
2.10 大鼠皮肤组织中TLR2、TLR4、p-NF-κB p65蛋白表达水平测定
采用Western blotting法进行测定。取冻存的皮肤组织适量,进行裂解、蛋白提取和定量。取蛋白样本,与上样缓冲液混合,煮沸10 min进行蛋白变性;取变性蛋白进行SDS-PAGE,转膜、封闭,经1×TBST漂洗1遍后,分别加入TLR2、TLR4、p-NF-κB p65一抗(稀释比例均为1 ∶ 800)以及β-actin抗体(稀释比例为1 ∶ 1 000),于4 ℃孵育过夜;加入生物素化山羊抗兔IgG二抗(稀释比例为1 ∶ 5 000),在室温下孵育2 h;经1×TBST漂洗3遍后,以ECL显色,运用化学发光凝胶成像仪成像,采用Image-Pro Plus 6.0图像软件进行分析,以β-actin作为内参,将目标蛋白与内参的灰度值比值作为目标蛋白的相对表达量,并以模型组为标准进行归一化处理。上述试验重复3次。
2.11 统计学方法
使用SPSS 25.0软件对数据进行统计分析。数据以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05表示差异有统计学意义。
3 结果
3.1 愈疡胶囊对金黄色葡萄球菌的MIC与MBC
愈疡胶囊对金黄色葡萄球菌的MIC为25 mg/mL,MBC为50 mg/mL;后续实验中,愈疡胶囊高、中、低剂量组给药剂量分别设为600、300、150 mg/kg。
3.2 愈疡胶囊对细菌感染皮炎模型大鼠皮膚组织表征的影响
与模型组比较,给药第1、3、5、7 天时,阳性对照组和愈疡胶囊高、中剂量组大鼠伤处皮肤组织红肿、化脓情况较轻,伤口结痂程度高,愈合速度快,愈合率均显著升高(P<0.05或P<0.01)。其中,给药3 d愈疡胶囊高、中剂量组大鼠伤处皮肤部分出现结痂情况,红肿消失;给药5~7 d愈疡胶囊高、中剂量组部分大鼠伤处出现脱痂。愈疡胶囊低剂量组大鼠仅给药第7天时愈合率显著升高(P<0.05)。与愈疡胶囊低剂量组比较,除愈疡胶囊中剂量组大鼠给药第1天的愈合率差异无统计学意义(P>0.05)外,其余各时间点阳性对照组和愈疡胶囊高、中剂量组大鼠的皮肤愈合率均显著升高(P<0.01)。与阳性对照组比较,愈疡胶囊高、中剂量组大鼠各时间点的皮肤愈合率差异均无统计学意义(P>0.05),详见表1。
3.3 愈疡胶囊对细菌感染皮炎模型大鼠皮肤组织中炎症因子含量的影响
与模型组比较,阳性对照组和愈疡胶囊高、中、低剂量组大鼠皮肤组织中IL-10、TNF-α含量,阳性对照组与愈疡胶囊高、中剂量组大鼠皮肤组织中IL-1β含量以及阳性对照组与愈疡胶囊高剂量组大鼠皮肤组织中IL-6含量均显著降低(P<0.05或P<0.01)。与愈疡胶囊低剂量组比较,阳性对照组大鼠皮肤组织中IL-1β、IL-6、IL-10、TNF-α含量以及愈疡胶囊高剂量组大鼠皮肤组织中IL-1β、TNF-α含量均显著降低(P<0.05或P<0.01)。与阳性对照组比较,愈疡胶囊高、中剂量组大鼠皮肤组织中上述4个炎症因子含量差异均无统计学意义(P>0.05),详见表2。
3.4 愈疡胶囊对细菌感染皮炎模型大鼠皮肤组织中纤维蛋白含量的影响
与模型组比较,阳性对照组和愈疡胶囊高剂量组大鼠皮肤组织中HYP、Col Ⅰ、Col Ⅲ含量均显著升高(P<0.05或P<0.01)。与愈疡胶囊低剂量组比较,阳性对照组大鼠皮肤组织中HYP、Col Ⅰ、Col Ⅲ含量以及愈疡胶囊高剂量组大鼠皮肤组织中HYP含量均显著升高(P<0.05或P<0.01)。与阳性对照组比较,愈疡胶囊高、中剂量组大鼠皮肤组织中上述3个纤维蛋白含量差异均无统计学意义(P>0.05),详见表3。
3.5 愈疡胶囊对细菌感染皮炎模型大鼠皮肤组织形态学变化的影响
与模型组比较,阳性对照组和愈疡胶囊高剂量组大鼠皮肤组织中可见较多纤维组织增生及少量炎细胞浸润,主要以核呈卵圆形或长椭圆形的成纤维细胞增生为主,少量核呈长梭形,胞质较少,间质可见少量中性粒细胞和淋巴细胞等炎细胞浸润,未见其他明显病变;愈疡胶囊中、低剂量组大鼠皮肤组织均出现部分区域损伤,真皮内层可见炎细胞浸润,主要以中性粒细胞和淋巴细胞为主,个别损伤处表皮明显增厚,少量成纤维细胞增生,其中低剂量组大鼠炎细胞浸润更严重,详见图1(图中, 为成纤维细胞, 为细胞碎片,为炎细胞)。
与模型组比较,阳性对照组和愈疡胶囊高、中剂量组大鼠的病理评分均显著降低(P<0.01)。与愈疡胶囊低剂量组比较,阳性对照组和愈疡胶囊高、中剂量组大鼠病理评分均显著降低(P<0.05或P<0.01)。与阳性对照组比较,愈疡胶囊高、中剂量组大鼠皮肤组织病理评分差异均无统计学意义(P>0.05),详见表4。
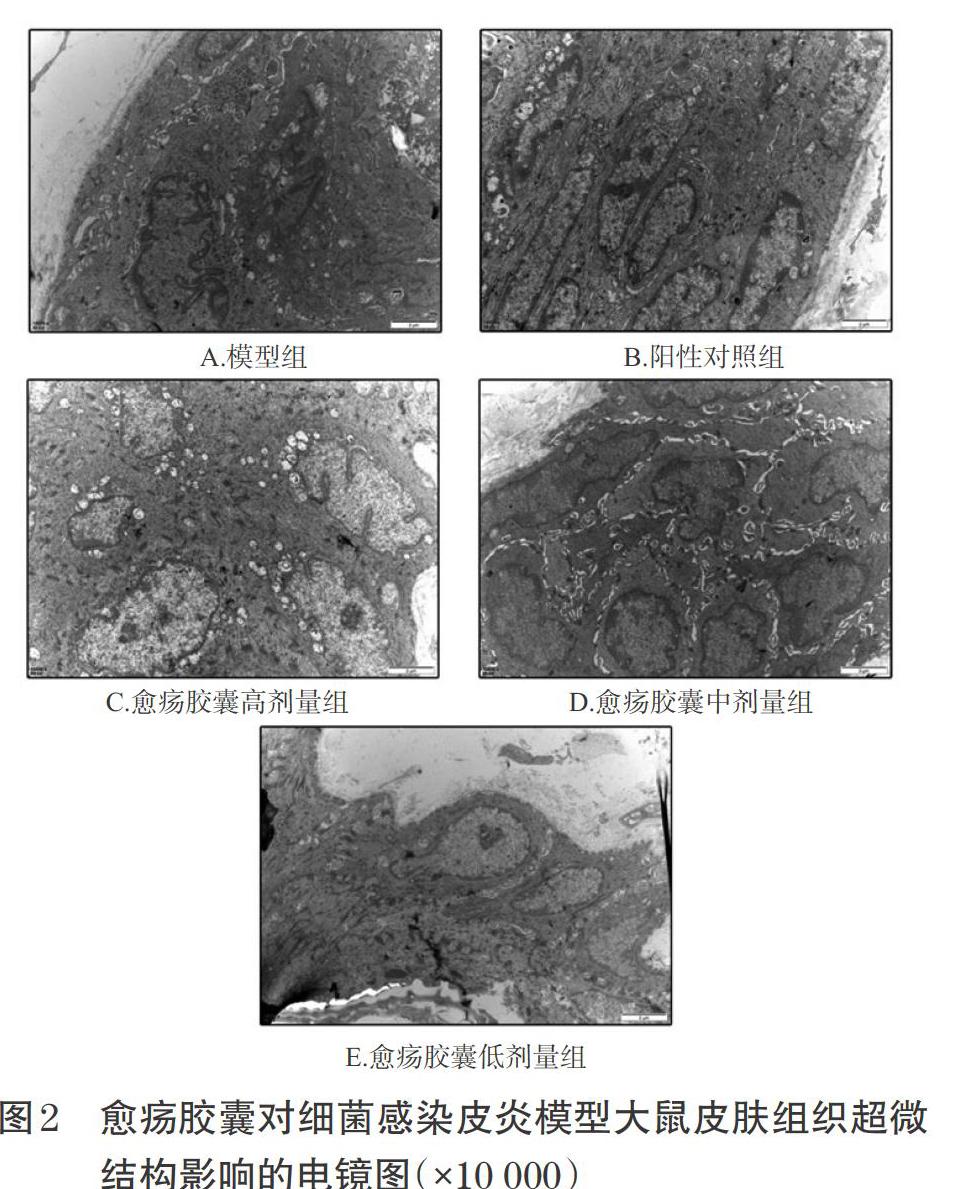
3.6 愈疡胶囊对细菌感染皮炎模型大鼠皮肤组织超微结构的影响
模型组大鼠皮肤组织中成纤维细胞生成少,排列紊乱,大部分细胞内质网数量少,细胞结构模糊,胞核变形甚至溶解消失;阳性对照组大鼠皮肤组织中成纤维细胞生成较多,排列整齐,且核多呈长梭形,细胞内微丝较多;愈疡胶囊高、中剂量组大鼠皮肤组织中成纤维细胞生成较多,结构较完整,细胞边缘可见微丝;愈疡胶囊低剂量组大鼠皮肤组织中可见纤维细胞增生,数量较少,细胞结构不明显,排列紊乱,详见图2。
3.7 愈疡胶囊对细菌感染皮炎模型大鼠皮肤组织中TLR2、TLR4、p-NF-κB p65蛋白表达水平的影响
与模型组比较,阳性对照组和愈疡胶囊高、中、低剂量组大鼠皮肤组织中TLR2、TLR4、p-NF-κB p65蛋白的表達水平均显著降低(P<0.05或P<0.01)。与愈疡胶囊低剂量组比较,阳性对照组和愈疡胶囊高、中剂量组大鼠皮肤组织中TLR2、TLR4(除愈疡胶囊中剂量组外)、p-NF-κB p65蛋白的表达水平均显著降低(P<0.05或P<0.01)。与阳性对照组比较,愈疡胶囊高剂量组大鼠皮肤组织中上述3个蛋白的表达水平差异均无统计学意义(P>0.05),愈疡胶囊中剂量组大鼠皮肤组织中上述3个蛋白的表达水平均显著升高(P<0.05),详见图3、表5。
4 讨论
皮肤损伤愈合的过程可分为4个阶段,即止血阶段、炎症阶段、增殖阶段和重塑阶段[10]。损伤皮肤组织在血管收缩和止血后立即在伤口处产生炎细胞以消除病原体和细胞碎片,随后通过角质形成细胞、成纤维细胞向伤口的迁移以及血管生成来实现肉芽组织的增殖[11]。近年来,抗生素是细菌性感染疾病的治疗首选,但抗生素的毒副作用相当大,严重者可造成患者耳聋等[12];同时,若长期使用抗生素,易造成患者体内菌群失调,诱导多重耐药的条件致病菌、真菌的二重感染,增加治疗难度[13]。具有抑菌作用的中药复方或单方制剂因其不良反应相对较轻且不易产生耐药等优点逐渐受到学者的关注。已有研究表明,中药及其提取物(人参、桂皮、丹参等)可通过刺激血管生成和胶原合成而作为创伤修复的治疗剂[14]。因此,开发有效抑菌的中药已成为相关研究的热点之一。
金黄色葡萄球菌是人类皮肤感染中最常见的病原体,也是院内伤口感染的主要原因[15]。金黄色葡萄球菌可分泌毒力因子和毒素,以帮助病原体逃避宿主的免疫系统,导致重复慢性感染、长期炎症和感染伤口延迟愈合[16]。为了确定愈疡胶囊的抑菌能力,本研究选用金黄色葡萄球菌为研究对象,首先测定了该药的体外抑菌能力,用于确定其体内实验剂量。结果,愈疡胶囊对金黄色葡萄球菌的MIC为25 mg/mL,MBC为50 mg/mL;由MIC最终确定体内实验的高、中、低剂量分别为600、300、150 mg/kg。
评价皮肤感染与损伤程度的一个重要指标就是观察伤处皮肤表征,根据其是否出现红肿、化脓、溃疡等症状评价模型是否复制成功,并以此评价药物的作用效果。在本研究中笔者发现,给药第1、3、5、7天时,愈疡胶囊高、中剂量组大鼠皮肤愈合率均显著高于模型组,愈疡胶囊低剂量组大鼠仅在给药第7天时的皮肤愈合率显著高于模型组,愈疡胶囊高剂量组大鼠给药第1、3、7天时的皮肤愈合率有高于阳性对照组的趋势。
皮肤组织中细胞的生成情况与细胞结构的变化可以直观地反应皮肤愈合的程度,使用透射电镜可以清楚地观察细胞类型与细胞结构。HE染色结果显示,模型组大鼠真皮及皮下组织均有不同程度坏死、出血,纤维组织增生,炎细胞浸润等系列病理改变,而阳性对照组和愈疡胶囊高剂量组大鼠病变程度明显好转,中、低剂量组大鼠病变好转程度不及阳性对照组和高剂量组。经过电镜观察发现,模型组大鼠大部分上皮细胞与纤维细胞的结构被破坏,而新生的纤维细胞非常少,且排列紊乱,这跟细菌感染有密切关联[17]。在使用愈疡胶囊7 d后,损伤的纤维细胞明显得到修复,坏死的细胞得到补充,上皮细胞开始形成并分化,构成基本的皮肤组织。这说明愈疡胶囊能诱导成纤维细胞与上皮细胞的形成,加快皮肤组织修复的速度。
损伤的皮肤容易被金黄色葡萄球菌入侵,造成化脓性感染,通过病原相关的分子模式和毒素激活多重促炎信号级联,在局部和全身都引发强烈的炎症反应[18]。据报道,角质形成细胞可产生促炎细胞因子,包括IL-1α、IL-1β、IL-6、IL-8和TNF-α等[19]。IL-1β是一个强有力的炎性细胞因子,当细胞损伤时,被炎性小体激活,从宿主细胞中被释放出来,帮助调节各种免疫反应[20-21]。在本研究中发现,与模型组比较,阳性对照组与愈疡胶囊高、中剂量组大鼠皮肤组织中IL-1β含量显著降低,提示感染程度减轻,皮肤愈合加快[22]。与此同时,皮肤屏障被破坏后,细胞中IL-6、IL-10、TNF-α均可促进伤口的炎症反应[23]。本研究中发现,与模型组比较,阳性对照组大鼠皮肤组织中IL-6、IL-10、TNF-α含量和愈疡胶囊高剂量组大鼠皮肤组织中TNF-α含量均显著降低,提示愈疡胶囊能减轻因感染引起的炎症反应。
在皮肤愈合的过程中,细胞外基质的重建十分重要,而在这个阶段,成纤维蛋白与胶原纤维含量的多少会对皮肤的修复起到关键作用[24]。HYP主要存在于皮肤、结缔组织等地方,可反映胶原蛋白的含量[25]。ColⅠ和ColⅢ均是构成皮肤组织的主要胶原成分,可协助创面修复,促进皮肤愈合[26]。本研究中发现,与模型组比较,阳性对照组和愈疡胶囊高剂量组大鼠HYP、ColⅠ和ColⅢ含量均显著升高,提示愈疡胶囊能加快大鼠皮肤修复。
感染性皮炎所涉及的炎症通路非常复杂,其中TLR/NF-κB就是一条经典通路[6-7]。TLR2是金黄色葡萄球菌细胞壁成分的信号受体,同时还可作为其他常见细菌结构模式的信号受体[23]。TLR4主要存在于淋巴组织中,由单核细胞和巨噬细胞以及T、B淋巴细胞表达[27]。TLR家族可激活NF-κB过度释放促炎细胞因子,引发炎症。本研究发现,与模型组比较,阳性对照组和愈疡胶囊高、中、低剂量组大鼠皮肤组织中TLR2、TLR4、p-NF-κB p65蛋白表达水平均显著降低,提示愈疡胶囊能抑制TLR/NF-κB炎症通路,使皮肤感染过程中炎症因子的释放减少,促进皮肤愈合。
阿莫西林克拉维酸钾是一种常用的口服广谱抗菌药,但是也存在明显的缺点,长期使用广谱抗菌药会是细菌耐药概率增加[28]。本研究发现,600 mg/kg的愈疡胶囊和120 mg/kg的阿莫西林能在大鼠体内产生相当的抗炎效果,对胶原蛋白的生成与细胞修复效果均无明显差异,而300 mg/kg愈疡胶囊虽然也有抗炎效果,但效果不及阿莫西林。此外,在剂量高于阿莫西林克拉维酸钾5倍的情况下,600 mg/kg的愈疡胶囊也未导致大鼠出现明显的不良反应,进一步说明愈疡胶囊的毒性较低,但其具体作用机制还需后期进一步研究。
综上所述,愈疡胶囊可促进细菌感染皮炎模型大鼠皮肤愈合,具有一定的抗炎作用,其机制可能与抑制TLR/NF-κB信号通路、减少炎症反应有关。
参考文献
[ 1 ] 蓝素桂,李治蓉,苏爱秋,等.金黄色葡萄球菌抗生素耐药研究进展[J].食品与发酵工业,2021. DOI:10.13995/j.cnki.11-1802/ts.025945.
[ 2 ] NA M,MOHAMMAD M,FEI Y,et al. Lack of receptor for advanced glycation end products leads to less severe staphylococcal skin infection but more skin abscesses and prolonged wound healing[J]. J Infect Dis,2018,218(5):791-800.
[ 3 ] 曹珍,薛璇玑,张新新,等.临床常见耐药细菌及其天然抗生素增效剂的研究进展[J].中草药,2020,51(22):5868-5876.
[ 4 ] 罗伦才,罗昆蓉.愈疡胶囊治疗卵巢囊肿60例[J].中国实验方剂学杂志,2012,18(15):318-320.
[ 5 ] 罗伦才,季小平,张仲林,等.愈疡胶囊毒理作用研究[J].中国中医基础医学杂志,2012,18(1):105-107.
[ 6 ] 楊世勇,何毅,宋大强,等.基于TLR4/NF-κB途径的白藜芦醇减轻LPS致小鼠急性肺损伤的机制研究[J].中国药房,2020,31(9):1034-1039.
[ 7 ] 李建功,孙文熙,刘家玥,等.基于TLR4/MyD88/NF-κB信号通路研究黄连素对小鼠巨噬细胞极化的干预作用[J].中国药房,2020,31(15):1804-1809.
[ 8 ] 赵凌旭,王蕾.中药黄檗对金黄色葡萄球菌体外抑菌效果的初步研究[J].检验医学,2015,30(9):886-889.
[ 9 ] 郇科,白博,白晓智,等.大鼠深Ⅱ度烫伤合并创面感染模型的构建[J].中国感染控制杂志,2018,17(10):866-871.
[10] CUI MD,PAN ZH,PAN LQ. Danggui buxue extract-loaded liposomes in thermosensitive gel enhance in vivo dermal wound healing via activation of the VEGF/PI3K/Akt and TGF-β/Smads signaling pathway[J]. Evid Based Complement Alternat Med,2017. DOI:10.1155/2017/8407249.
[11] YADAV E,SINGH D,YADAV P,et al. Antioxidant and anti-inflammatory properties of Prosopis cineraria based phenolic rich ointment in wound healing[J]. Biomed Pharmacother,2018. DOI:10.1016/j.biopha.2018.09.180.
[12] 许桓,唐春雷,范为正.氨基糖苷类抗生素的研究进展[J].中国新药杂志,2019,28(15):1828-1835.
[13] 钟艾玲,田敏,刘艳全,等.氨基糖苷类抗生素的耐药机制研究进展[J].中国抗生素杂志,2019,44(4):401-405.
[14] MAJEWSKA I,GENDASZEWSKA-DARMACH E. Proangiogenic activity of plant extracts in accelerating wound healing:a new face of old phytomedicines[J]. Acta Biochim Pol,2011,58(4):449-60.
[15] THANGAMANI S,YOUNIS W,SELEEM MN. Repurposing ebselen for treatment of multidrug-resistant staphylococcal infections[J]. Sci Rep,2015. DOI:10.1038/srep11596.
[16] THANGAMANI S,MOHAMMAD H,ABUSHAHBA MF,et al. Repurposing auranofin for the treatment of cutaneous staphylococcal infections[J]. Int J Antimicrob Agents,2016,47(3):195-201.
[17] MOHAMMED AR,ALAA ES,MOHAMED AR,et al.Promising antimicrobial activities of oil and silver nanoparticles obtained from Melaleuca alternifolia leaves against selected skin-infecting pathogens[J]. J Herb Med,2020. DOI:10.1016/j.hermed.2019.100289.
[18] KITUR K,WACHTEL S,BROWN A,et al. Necroptosis promotes staphylococcus aureus clearance by inhibiting excessive inflammatory signaling[J]. Cell Rep,2016,16(8):2219-2230.
[19] 熊丽丹,唐洁,李利.白果内酯和银杏内酯B对过氧化氢诱导人角质形成细胞氧化损伤的保护作用[J].日用化学工业,2019,49(8):531-536.
[20] FLAHERTY RA,DONAHUE DL,CAROTHERS KE,et al. Neutralization of streptolysin s-dependent and independent inflammatory cytokine IL-1β activity reduces patho- logy during early group A streptococcal skin infection[J].Front Cell Infect Microbiol,2018. DOI:10.3389/fcimb.2018.00211.
[21] VALDERRAMA JA,RIESTRA AM,GAO NJ,et al.Group A streptococcal M protein activates the NLRP3 inflammasome[J]. Nat Microbiol,2017,2(10):1425-1434.
[22] HONG SW,KIM MR,LEE EY,et al. Extracellular vesicles derived from Staphylococcus aureus induce atopic dermatitis-like skin inflammation[J]. Allergy,2011,66(3):351-359.
[23] TATIYA-APHIRADEE N,CHATUPHONPRASERT W,JARUKAMJORN K. Anti-inflammatory effect of Garci- nia mangostana Linn.pericarp extract in methicillin-resistant Staphylococcus aureus-induced superficial skin infection in mice[J]. Biomed Pharmacother,2019. DOI:10.1016/j.biopha.2018.12.142.
[24] 郭家棋,郭敏慧,孔松芝,等.積雪草苷-海藻酸钠修复贴的制备及其创伤修复作用研究[J].中草药,2020,51(19):4934-4942.
[25] 邬涛,刘颖,陈勤.烧伤膏对小鼠皮肤烫伤创面愈合的修复作用研究[J].激光生物学报,2017,26(4):367-372.
[26] 赵鑫,石新,陈贝,等.负压封闭引流技术对大鼠急性创面愈合过程中Ⅰ/Ⅲ型胶原比例变化的影响[J].中国组织工程研究,2020,24(32):5122-5127.
[27] YANG M,XU J,YU J,et al. Anti-inflammatory effects of 1,25-dihydroxyvitamin D3 in monocytes cultured in serum from patients with type 2 diabetes mellitus and diabe- tic nephropathy with uremia via Toll-like receptor 4 and nuclear factor-κB p65[J]. Mol Med Rep,2015,12(6):8215-8222.
[28] 陈红红,蔡红,谭华.阿莫西林克拉维酸钾亚最低杀菌浓度体外诱导细菌耐药试验研究[J].当代医学,2017,23(36):24-27.
(收稿日期:2020-11-05 修回日期:2021-01-08)
(编辑:邹丽娟)
