miR-146a-5p 抑制TRAF6/NF-кB 信号通路影响滋养细胞的炎症反应
2021-04-08陈芳荣吴栋才陈小菊
陈芳荣,吴栋才,陈小菊
(海南省人民医院,海南医学院附属海南医院产科,海南 海口570311)
子痫前期(preeclampsia,PE)是妊娠期特有的综合征,影响3%~5%的孕妇,并以水肿、高血压和蛋白尿为特征,是造成孕产妇和新生儿死亡的主要原因之一[1]。子痫前期是孕产妇和围产儿死亡的重要原因。子痫前期本质上是异质的,其差异表现在疾病时机、临床症状、器官损害的严重程度、母婴结局和并发症上[2]。
PE 的病因和确切的发病机制尚不完全清楚。有研究表明,妊娠过程中炎症反应和血管内皮细胞损伤等与子痫前期密切相关[3]。子痫前期与促炎的环境有关,其中细胞因子在介质中起重要作用[4]。研究已发现,子痫前期患者中的炎症细胞,被激活并分泌大量炎症细胞因子,例如白细胞介素(Inter⁃leukin,IL)-1β、IL-6、IL-8 和 肿 瘤 坏 死 因 子-a(Tu⁃mor necrosis factor-a,TNF-α)[5]。这些细胞因子导致子痫前期的病理特征。子痫前期有关的炎性反应甚至可能发生在没有微生物感染的情况下,被称为无菌性炎症[6]。
microRNA(miRNA)是长度为19~25 个核苷酸的短RNA 分子,可在转录后调节基因表达[7]。目前,许多研究表明,miRNAs 参与了胎盘发育过程中滋养层细胞的生长、侵袭和新生血管的调节[8]。miR-146a 是最早被发现参与天然免疫的调控因子,它是一个典型的多功能miRNA,在炎症、免疫、肿瘤等人体多种生理病理过程中发挥重要作用[9]。
通过生物信息学预测,肿瘤坏死因子受体相关因子6(TNF receptorassociated factor 6,TRAF6)是miR-146a-5p 的下游靶基因之一。本课题组研究发现,抑制miR-146a-5p 表达后可上调TRAF6 表达,增强JEG-3 细胞增殖、侵袭及迁移能力[10]。
研究已发现,miR-146a 可调控TRAF6 来调节NF-κB 的活性在糖尿病相关微血管并发症中发挥作用[11]。笔者前期研究发现,miR-146a 在滋养细胞中异常表达[12],子痫前期组胎盘组织中NF-κB p65阳性率明显高于正常组[13]。但miR-146a 能否通过调节TRAF6/NF-κB 信号通路影响子痫前期的炎症反应还有待研究。本文以JEG-3 细胞作为研究对象,以脂多糖(LPS)干预JEG-3 细胞制作子痫前期滋养细胞模型,通过检测各组JEG-3 细胞中的TRAF6 及NF-κB 和表达水平及相关炎症因子的变化及其意义,探讨miR-146a-5p 在子痫前期中的抗炎作用及作用机制,为深入研究子痫前期发病机制及临床靶向治疗提供理论依据。
1 材料与方法
1.1 细胞株和试剂
人绒毛膜癌细胞株JEG-3 来源于国家细胞资源共享平台;control(对照组)、LPS 组、miR-146a-5p mimic 组、miR-146a-5p inhibitor 组 均 购 自 上 海 吉 凯基因公司,LPS 购自美国Sigma 公司,从细胞或组织中提取总RNA,使用RNA 提取试剂盒购自美国Qiagen 公司,RNA 逆转录试剂盒购自美国Qiagen公司,DMEM 培养基购自美国Hyclone 公司(含100 U/mL 青 霉 素、100 μg/mL 链 霉 素 和10% 胎 牛 血清),胎牛血清(FBS)购自美国Gibico 公司。胰蛋白酶购自美国Genview 公司,逆转录试剂盒及qRTPCR 试剂盒购自美国ABI 公司;Trizol、脂质体2000(LipofectamineTM2000)、BAC 试剂盒购自美国Invit⁃rogen 公司。
1.2 通过QPCR 实验技术定量检测基因表达量
按照试剂盒操作说明,使用TRizol 试剂从细胞中提取总RNA,并使用反转录试剂盒进行逆转录合成cDNA 合成。以cDNA 模板按Real-PCR 试剂盒进行PCR 扩增。反应条件为预变性95℃3 min,变性95℃15 s,退火60℃30 s,延伸60℃30 s,扩增40 个循环。60℃60 s、95℃15 s 生成熔解曲线。实验 结 果 目 的 基 因 的 定 量 分 析 采 用2-△△CT法 计 算[14]。所有引物均由上海生物技术有限公司设计和合成,引 物 序 列 为(5′-3′):miR-146a-5p:Forward,5′-GGG GTG AGA ACT GAA TTC CAT-3′and re⁃verse,5′-CAG TGC GTG TCG TGG AGT-3′;TRAF6:Forward,5′-CTA TTC ACC AGT TAG AGG-3′and reverse,5′-GCT CAC TTA CAT ACA TAC T-3′;NF-κB:Forward,5′-TCA AGA TCT GCC GAC TGA AC -3′and reverse,5-CCT CTT TCT GCA CCT TGT CA-3′;β-actin(hu⁃man):Forward,5-TGG CAC CCA GCA CAA TGA A-3′and reverse,5-CTA AGT CAT AGT CCG CCT AGA AGC A-3′。
1.3 Western blot 实验
利用蛋白质裂解液(RIPA)将各组细胞裂解,从不同的实验组细胞定量使用BCA 试剂盒(武汉博斯特武汉生物科技有限公司)。然后,等量的蛋白质(30 μg)分离了10%聚丙烯酰胺凝胶电泳(PAGE)(武汉博斯特生物技术有限公司)在100 V 下2 h,然后转移到PVDF 膜上在100 V 下持续1 h。然后,用5%脱脂牛奶在1× TBST 缓冲液中,印迹为与抗TRAF6 在4℃下孵育过夜和抗NF-κB 抗体(均来自美国Abcam 公司,1∶1 000 稀释)以及抗β-actin 抗体(美国Becton,1∶3 000)作为内部控制。然后用1X TBST 洗涤,印迹在室温下孵育HRP 共轭二抗的温度2 h。洗涤后,用ECL 化学发光试剂,并用凝胶成像定量蛋白条带的灰度值使用Image J 软件[15]。
1.4 统计学处理
采用GraphPad Prism 6.0 软件进行统计学分析,计量资料采用均数±标准差(±s)表示,2 组间比较采用非配对t 检验,多组间比较采用单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 QPCR 检测miR146a-5p 在JEG-3 细胞中的相对表达量
JEG-3 细 胞 转 染miR-146a mimic 后,miR-146a-5p 过表达效果显著增加(P<0.05),说明转染成功,提示可进行下一步实验。见表1。
表1 转染后4组JEG-3细胞中miR-146a-5p表达水平的比较(±s)Tab 1 Comparison of miR-146a-5p expression levels in JEG-3 cells after transfection(±s)
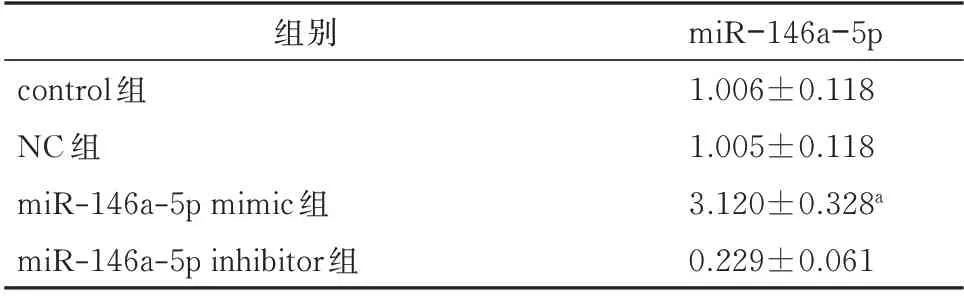
表1 转染后4组JEG-3细胞中miR-146a-5p表达水平的比较(±s)Tab 1 Comparison of miR-146a-5p expression levels in JEG-3 cells after transfection(±s)
注:与对照组比较,aP<0.05。
组别control 组NC 组miR-146a-5p mimic 组miR-146a-5p inhibitor 组miR-146a-5p 1.006±0.118 1.005±0.118 3.120±0.328a 0.229±0.061
2.2 转染后LPS 组JEG-3 细胞中miR-146a-5p 表达水平的比较
经脂多糖(LPS)诱导后,对照组与LPS 组miR-146a-5p 表 达 量 分 别 为(0.401±0.019)、(0.790±0.033)。
LPS 诱导的JEG-3 细胞中miR-146a-5p 的表达量明显增加,差异均具有统计学意义(P<0.05)。
2.3 QPCR 实验技术定量检测各组JEG-3 细胞中IL-1β、IL-6、IL-8、TNF-α 的mRNA 表达水平
与对照组比较,转染miR-146a mimic 后IL-1β、IL-6、IL-8、TNF-α 的mRNA 表达水平明显下降(P<0.05),而转染miR-146a inhibitor 后IL-1β、IL-6、IL-8、TNF-α的mRNA 表达水平明显增加(P<0.05),LPS 组介于miR-146a mimic 组和miR-146a inhibitor组之间(P<0.05)。差异均有统计学意义(P<0.05)。见表2。
表2 转染后5 组JEG-3 细胞中IL-1β、IL-6、IL-8、TNF-α 的mRNA 表达水平的比较(±s)Tab 2 Comparison of mRNA expression levels of IL-1β,IL-6,IL-8 and TNF-α in JEG-3 cells after transfection(±s)
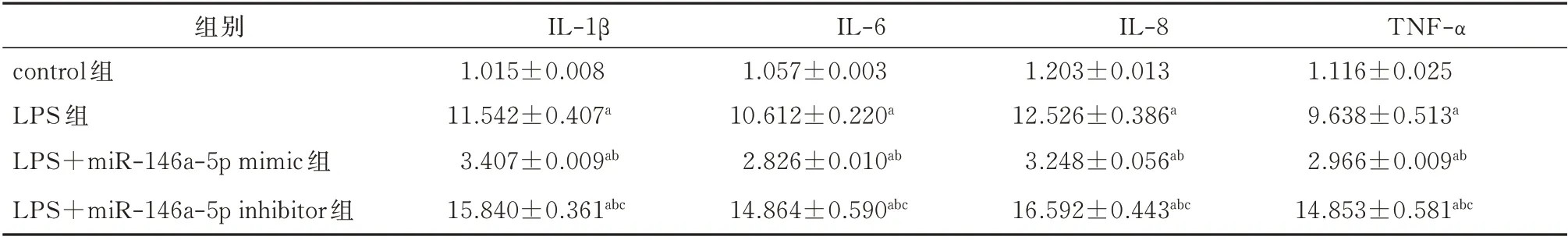
表2 转染后5 组JEG-3 细胞中IL-1β、IL-6、IL-8、TNF-α 的mRNA 表达水平的比较(±s)Tab 2 Comparison of mRNA expression levels of IL-1β,IL-6,IL-8 and TNF-α in JEG-3 cells after transfection(±s)
注:与control 组比较,aP<0.05;与LPS 组比较,bP<0.05;与LPS+miR−146a−5p mimic 组比较,cP<0.05。
组别control 组LPS 组LPS+miR-146a-5p mimic 组LPS+miR-146a-5p inhibitor 组TNF-α 1.116±0.025 9.638±0.513a 2.966±0.009ab 14.853±0.581abc IL-1β 1.015±0.008 11.542±0.407a 3.407±0.009ab 15.840±0.361abc IL-6 1.057±0.003 10.612±0.220a 2.826±0.010ab 14.864±0.590abc IL-8 1.203±0.013 12.526±0.386a 3.248±0.056ab 16.592±0.443abc
2.4 Western Blot 技术检测JEG-3 各组细胞样本中TRAF6、NF-κB 的蛋白水平
转染miR-146a mimic 后JEG-3 细胞内TRAF6、NF-κB 蛋白的表达量较对照组下降;转染miR-146a inhibitor 后JEG-3 细 胞 内TRAF6、NF-κB 蛋 白 的 表达量较对照组上升。差异均有统计学意义(P<0.05)。见图1 及表3。
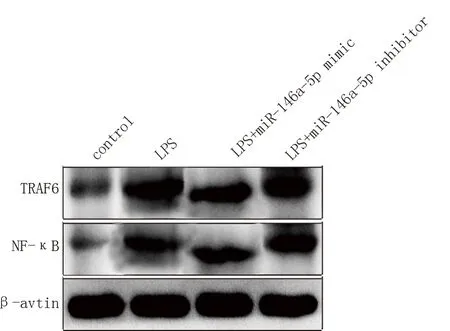
图1 TRAF6、NF-κB 的WB 表达水平检测图Fig 1 Expression levels of TRAF6 and NF-κB
表3 转染后各4 组JEG-3 细胞中TRAF6 和NF-κB 蛋白表达水平的比较(±s)Tab 3 Comparison of TRAF6 and NF-κB protein expression levels in JEG-3 cells after transfection(±s)
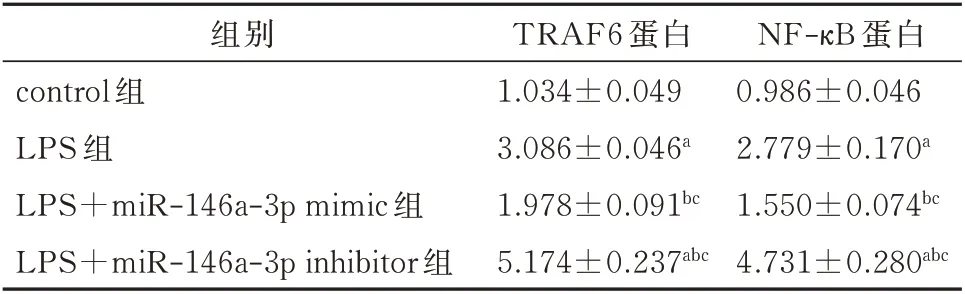
表3 转染后各4 组JEG-3 细胞中TRAF6 和NF-κB 蛋白表达水平的比较(±s)Tab 3 Comparison of TRAF6 and NF-κB protein expression levels in JEG-3 cells after transfection(±s)
注:与 对 照 组 比 较,aP<0.05;与LPS 组 比 较,bP<0.05;与LPS+miR-146a-5p mimic 组比较,cP<0.05。
NF-κB 蛋白0.986±0.046 2.779±0.170a 1.550±0.074bc 4.731±0.280abc组别control 组LPS 组LPS+miR-146a-3p mimic 组LPS+miR-146a-3p inhibitor 组TRAF6 蛋白1.034±0.049 3.086±0.046a 1.978±0.091bc 5.174±0.237abc
3 讨论
PE 是妊娠期高血压疾病的常见形式。除了终止妊娠娩出胎儿胎盘外,PE 尚无治愈方法,目前对PE 的治疗始终还不能有效改善孕产妇和胎儿的结局,因此研究该疾病的发病机制以便可以采取更有效的治疗方案是非常必要的[16]。
尽管子痫前期的确切机制尚不清楚,但普遍认为这些并发症与异常的母亲炎症反应有关[17]。异常激活的炎症导致PE 的发生[18]。有大量证据表明氧化应激在PE 的病理生理中起关键作用[19]。氧化应激将活性氧释放到母体循环中,从而引起全身性炎症反应[20]。
异常的炎症反应导致过度的氧化应激和核因子-κB(NF-κB)信号激活[21]。
患有PE 的妇女表现出较高的炎症状态,并且促炎性细胞因子和趋化因子如TNF-α、IL-6 和IL-1β 在全身及胎盘局部升高[22,23]。PE 胎盘中IL-6 和TNF-α 升高增加了滋养层细胞的凋亡并增加了内皮的活化,使内皮功能障碍,导致PE 高血压的出现[24]。
本研究发现LPS 诱导的JEG 细胞中IL-1β、IL-6、IL-8 和TNF-α 表达较对照组上调。因为人绒毛膜癌滋养细胞系JEG-3 细胞具有与滋养细胞相似的分子结构和生物学性状,常用于代替正常滋养细胞,研究其生物学行为[25]。脂多糖是革兰氏阴性菌外膜的主要成分,是炎症反应的主要活性成分[26]。Cotechini 等[27]发现LPS 诱发的炎症,导致胎盘亚硝化应激,肾脏结构和功能改变,MAP 升高,引起PE和FGR。在JEG-3 细胞中,LPS 通过上调环氧合酶-2(COX-2)和相关炎症因子的表达激活了NF-κB信号通路,而JEG-3 细胞的侵袭能力却被削弱[28]。
本研究发现,与对照组相比,LPS 诱导的JEG-3细胞中miR-146a-5p 的表达量显著增加,(P<0.05)。这与Feng 等[29]报道的MALAT1 调节miR-146 在保护微血管内皮细胞在LPS 诱导的炎性损伤中的作用一致:LPS 暴露后,miR-146a 和miR-146b的表达与对照细胞相比呈剂量依赖性的增加。人工加入miR-146a-5p mimic 增加miR-146a-5p 的表达后,可以抑制LPS 诱导的JEG 细胞中IL-1β、IL-6、IL-8 和TNF-α 表达(P<0.05);加入miR-146a-5p inhibitor 降 低miR-146a-5p 表 达,则 加 重LPS 诱导的JEG 细胞中IL-1β、IL-6、IL-8 和TNF-α 表达(P<0.05)。与LPS+miR-146a-5p mimic 组比较,LPS+miR-146a-5p inhibitor 组的JEG 细胞中IL-1β、IL-6、IL-8 和TNF-α 表达明显增高(P<0.05)。
miR-146a-5p 作为一种抗炎调节剂,已显示出在各种免疫细胞中介导其功能的作用[30]。miR-146a 通过靶向TRAF6 在炎症中发挥作用也已见报道,Fei 等[31]先前有研究报道,miR-146a 可以通过靶向TNF 受体相关因子6(TRAF6)和IL-1 受体相关激酶(IRAK)来控制Toll 样受体(toll like receptors,TLR)和细胞因子信号传导,MiR-146a 通过靶向柯萨奇B 病毒感染中的TLR3 和TRAF6 下调炎症反应。TRAF6 调控核转录因子κB(Nuclear transcrip⁃tion factor-kappa B,NF-κB)通路已在肿瘤等大肠癌中报道,Zhu 等[32]发现,TRAF6 在结直肠癌组织中高表达,其患者生存率低,TRAF6 基因敲除可抑制结直肠癌细胞的增殖、迁移和侵袭。TRAF6 通过进入细胞核激活TRAF6-NF-κB/AP-1 信号通路,引起大肠癌细胞的生物学行为改变,在大肠癌的发生发展中起着重要作用。
miR-146a 下调TRAF6 在肝细胞癌等多种疾病中 发 挥 重 要 作 用[33]。但miR-146a 调 控TRAF6/NF-κB 通路能否在子痫前期中发挥抗炎作用未见报道,本研究中,用miR-146a-5p 模拟物转染后,使miR-146a-5p 过表达,抑制LPS 诱导的TRAF6/NFκB 通路的激活,降低JEG3 细胞中TRAF6 和NF-κB蛋白的表达,并降低促炎细胞因子IL-1β、IL-6、IL-8 和TNF-α 的表达。与先前Zeng 等[34]的研究一致:miR-146a 可通过抑制TLR2/IRAK1/TRAF6/NFκB 和MAPK 途 径 来 下 调 痤 疮 炎 症 中IL-6、IL-8 和TNF-α 的产生。
笔者在体外实验对miR-146a 和TRAF6 /NFκB 信号通路在滋养细胞炎性因子产生中的作用进行了研究。与对照组相比,LPS 组中TRAF6 和NF-κB 及细胞因子IL-1β、IL-6、IL-8 和TNF-α 表均增加(P<0.05)。在LPS 组中加入miR-146a-5p mimic 后,TRAF6 和NF-κB 和细胞因子IL-1β、IL-6、IL-8 和TNF-α 表达较LPS 组均下降(P<0.05);而在LPS 组中加入miR-146a-5p inhibitor 后的目的蛋白TRAF6 和NF-κB 表达及细胞因子较LPS 组上升。结果表明,miR-146a 过表达可能通过抑制TRAF6 /NF-κB 信号传导通路而抑制促炎性细胞因子的产生(P<0.05)。
总之,本研究通过体外实验表明,miR-146a 通过抑制TRAF6 /NF-κB 信号传导从而降低滋养细胞促炎性细胞因子的产生。这些发现证明miR-146a-5p 在子痫前期中的一种新的抗炎机制。此外,近期Yang 等[35]研究还发现,羊水来源的MSC(AFMSCs)对LPS 诱导的炎性滋养层细胞的抗炎作用,而TRAF6 的预测靶标miR-146a-5p 和miR-548e-5p参与了人类滋养层细胞中氧化应激的调节;可能是治疗炎症疾病和妊娠期相关问题的新靶点。我们将进一步行体内实验进行验证,为下一步子痫前期的靶向抗炎治疗药物提供理论依据。
