石灰和双氰胺对红壤酸化和硝化作用的影响及其机制*
2021-04-08张昊青赵学强张玲玉沈仁芳
张昊青,赵学强†,张玲玉,沈仁芳
(1. 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008;2. 中国科学院大学,北京 100049)
中国南方酸性红壤区面积218 万km2,约占全国土地总面积的22.7%[1]。该地区水热资源丰富,有着巨大的农业生产潜力[2]。然而,由于土壤铝毒、锰毒、酸害及养分缺乏等一系列植物生长限制因子,酸性土壤的巨大生产潜力难以发挥[2-3]。近年来,由于氮肥的大量施用,我国农田土壤酸化严重,不仅限制了农业生产力,也威胁到生态环境质量[4-5]。与全国其他地区相比,红壤区的酸化问题更为突出[6]。实现酸性红壤的可持续利用,是关系到国家粮食安全和环境保护的重要课题。
施用酸性土壤改良剂是提高酸性土壤作物生产力的一个主要策略[2,5],其中石灰是最传统且效果显著的酸性土壤改良剂。施用石灰可快速提高土壤pH,显著改善酸性土壤上植物的生长,但在土壤pH提高的同时,又会不可避免地加速土壤硝化作用[7]。硝化作用的加速,一方面引起质子积累,加重土壤酸化程度;另一方面,增加土壤中硝态氮的累积,在高温多雨的南方红壤区,硝态氮极易发生径流、淋洗和反硝化损失,从而对水体质量和空气质量构成潜在威胁[8]。由于土壤颗粒表面一般带负电荷,与带负电的硝酸根相比,带正电的铵离子更易被土壤吸附和晶格固定,不易随水淋失[9]。此外,与吸收硝态氮相比,植物根系吸收铵态氮不需要还原过程,一般耗能较少,速率较快,容易获得较高生物量[10]。酸性土壤硝化作用较弱,铵态氮/硝态氮的比例较高,由于长期进化适应的原因,酸性土壤上生长的植物一般较为偏好铵态氮且耐铝毒[11]。利用铵态氮和铝的协同作用是提高酸性土壤氮效率的主要策略之一[12]。因此,若能有效抑制石灰诱导的酸性红壤硝化作用,将土壤中的铵硝比维持在较高水平,不仅可以降低硝态氮淋失及反硝化造成的环境风险,提高氮肥利用效率,同时也能减缓硝化作用引起的土壤酸化,维持酸性红壤区农业的可持续发展。
硝化抑制剂种类较多, 其中, 双氰胺(Dicyandiamide,DCD)是目前广泛应用于农业生产中的一种硝化抑制剂。利用DCD 延缓铵态氮向硝态氮的转化,可有效降低土壤氮素损失,提高作物产量和改善品质,提高氮肥利用率[13]。DCD 在农业上的应用效果已有大量报道,其施用效果经常依赖于土壤环境和管理措施,在不同条件下存在很大差异[13-15]。在酸性土壤地区,为了改善作物生长,经常施用石灰以提高土壤pH。一方面,土壤pH 是调控土壤中的硝化过程和硝化微生物的关键因素[16],施用石灰导致的土壤pH 增加会加速酸性土壤中的硝化过程,进而可能会影响DCD 的作用效果。另一方面,DCD 通过抑制土壤硝化作用,减缓土壤酸化,也可能改变石灰的作用效果。目前研究多集中于石灰或DCD 单一因素对土壤硝化作用的影响,对于石灰和DCD 配合施用对酸性土壤硝化过程的影响及其机制的研究尚鲜有报道。基于上述考虑,为了探究石灰和DCD 配合施用对酸性土壤pH 和硝化作用的影响及其机制,本文比较分析了石灰和DCD 交互作用对酸性土壤培养过程中pH、铵态氮和硝态氮含量及硝化微生物(氨氧化细菌和氨氧化古菌)丰度的影响。研究结果旨在为酸性土壤改良和氮素优化管理提供理论基础和科学依据。
1 材料与方法
1.1 供试材料
供试红壤发育于第四纪红黏土,采集自江西省鹰潭市中国科学院红壤生态试验站旱地农田,该地区属于亚热带湿润季风气候,年平均降水量 1882 mm。采集0~20 cm 的新鲜土壤样品,剔除杂物及残留根系后,风干,磨细,分别过1 mm 和0.149 mm 孔径筛备用。
于试验开始前进行供试土壤的基本理化性质分析。用pH 计(PB-21,Sartorius,德国)在土水比为1∶2.5 的条件下测得土壤pH 为4.80;用2 mol·L-1KCl 浸提,流动分析仪(San++ System,SAKLAR,荷兰)测得土壤初始硝态氮含量为1.42 mg·kg-1,铵态氮含量为3.10 mg·kg-1;用盐酸-氟化铵浸提,钼锑抗比色法测得土壤有效磷含量为3.00 mg·kg-1;用1 mol·L-1乙酸铵浸提,火焰光度法测得土壤速效钾含量为67.90 mg·kg-1;用低温外加热重铬酸钾氧化—比色法测得土壤有机质含量为8.9 g·kg-1。
1.2 试验设计
试验包括两个因素,A 因素为石灰(CaCO3)用量,分别为0、2、4、6 g·kg-1干土;B 因素为DCD,分为不施用DCD(-DCD)和施用DCD(+DCD)。共8 个处理,每个处理重复3 次。同时,所有处理均供应200 mg·kg-1(以N 计)尿素作为氮源。DCD用量为20 mg·kg-1干土(施氮量的10%)。DCD 由上海麦克林生化科技有限公司生产,含量980 g·kg-1。
首先,称取50 g 过1 mm 筛的风干土于培养瓶中,分别加入不同量的石灰,与土壤充分混匀,得到不同石灰添加量的土壤。再将同一石灰用量的土壤分为两份,一份仅加入尿素溶液,另一份加入尿素和DCD 的混合溶液。另加入一定量去离子水以维持正常的水分含量和通气状态。用塑料膜将培养瓶封口,并在中间留出小孔以创造好气环境。将培养瓶置于25 ℃人工气候室中恒温黑暗培养。培养期间每3 天采用称重法补水1 次,使土壤水分保持基本恒定。于培养开始后的0、7、14、21 和35 d 分别取样,取样后立即用2 mol·L-1KCl 溶液浸提,浸提液置于4 ℃冰箱保存,用于测定土壤铵态氮和硝态氮含量。同时,于培养开始后第35 天采集土壤样品,置于-20 ℃冰箱,用于土壤DNA 的提取。
1.3 土壤微生物总DNA 的提取
于培养结束时(第35 天),采用FastDNA Spin Kit For Soil 试剂盒(北京天根生化科技有限公司),提取土壤总DNA。称取0.50 g 土壤样品,按照试剂盒说明书进行提取。用微量分光光度计(NanoDrop ND-1000 spectrophotometer,美国)检测提取DNA样品的浓度和纯度,后保存至-20 ℃冰箱,以用于氨氧化微生物amoA基因拷贝数检测。
1.4 氨氧化细菌和氨氧化古菌中amoA 基因实时荧光定量PCR 分析
氨氧化古菌(Ammonia-oxidizing archaea;AOA)和氨氧化细菌(Ammonia-oxidizing bacteria;AOB)中amoA基因丰度采用PCR 扩增仪(LightCycler 480real-time PCR system,Roche,德国)进行定量分析。所采用的引物序列及反应程序如表1 所示。试验采用引物由南京金斯瑞生物科技有限公司生产,SYBR Premix Ex Taq 由日本TaKaRa 公司生产。实时荧光定量PCR 分析以提取的土壤DNA 为模板,反应体系为10 μL,包括1 μL DNA 模板、5 μL SYBR Premix Ex Taq,前后引物各1 μL 及2 μL 灭菌双蒸水。同时设置空白对照,即以灭菌双蒸水代替土壤DNA 作为反应模板。每个样品3 次技术重复。

表1 氨氧化古菌(AOA)与氨氧化细菌(AOB)amoA 基因定量PCR 引物序列及反应程序Table 1 Primer sequences and reaction procedures of ammonia-oxidizing archaea(AOA)and ammonia-oxidizing bacteria(AOB)amoA gene quantitative PCR
标准曲线的制作:通过溶菌肉汤(LB,Lysogeny Broth)培养基培养含有目的基因的克隆子,按照试剂盒(FavorPrep Plasmid Extraction Mini Kit,FAVORGEN Bio,中国)的操作步骤进行质粒的提取和纯化。提取后的质粒用微量分光光度计(NanoDrop ND-1000 spectrophotometer,美国)检测其浓度,并以10 倍梯度对质粒进行稀释,得到标准曲线。标准曲线重复3 次,扩增效率均在92%~105%之间,决定系数R2均大于0.99。
1.5 数据处理
土壤表观硝化率是土壤中硝态氮含量占土壤铵态氮含量和硝态氮含量之和的百分数[19]。
数据采用SPSS19.0 进行统计分析。采用单因素方差分析检验不同石灰用量处理间土壤硝态氮、铵态氮、表观硝化率、土壤pH 及AOA 和AOB 中amoA基因丰度的差异显著性。采用独立样本t-检验分析同一石灰用量条件下施DCD 与不施DCD 处理之间上述测定指标差异显著性。多重比较采用邓肯(Duncan)法,差异显著性水平为5%。通径分析方法参考杜家菊和陈志伟[20]的报道,通过SPSS19.0进行线性回归得到线性回归方程的标准系数,即为直接通径系数,再乘以自变量之间的相关系数即得间接通径系数。
2 结 果
2.1 石灰和硝化抑制剂对土壤pH 的影响
由于尿素的水解,在培养0 d 时不施石灰处理pH 显著高于试验初始pH(4.8)。在整个培养期间,无论是否施用 DCD,当石灰用量从 0 增加至4 g·kg-1,土壤 pH 逐渐升高,但当石灰用量大于4 g·kg-1时,继续加大石灰用量对土壤pH 的提升幅度较低(图1)。在不施DCD 的条件下,培养期间各石灰用量下的土壤pH 均有下降的趋势(图1a));而在施用DCD 的条件下,土壤pH 基本保持不变(图1b))。在整个培养期间,施用DCD 较不施DCD 处理土壤pH 均显著增加,其中,以施用2 g·kg-1石灰处理下外加DCD 对土壤pH 的提升幅度最大。
2.2 石灰和硝化抑制剂对土壤硝态氮和铵态氮含量的影响
在不施DCD 的条件下,施用石灰显著增加土壤硝态氮含量,在培养7、14、21 d 时,施用石灰处理硝态氮含量较不施石灰处理分别增加 391.6%、127.3%和72.6%,其中以施用4 g·kg-1石灰处理对土壤硝态氮的提高幅度最大(图2a))。随着培养时间的增加,不施石灰和施用2 g·kg-1石灰处理的土壤硝态氮含量均在培养35 d 达到峰值,而施用4 g·kg-1和6 g·kg-1石灰处理则在培养14 d 即达到峰值,后续有降低的趋势。在培养第35 天时,各石灰用量之间硝态氮含量无显著差异,这可能是由于各石灰处理土壤中的铵态氮已经被完全硝化。在施用DCD 的条件下,土壤硝态氮含量在整个培养期间内仅有少量增加,始终显著低于不施DCD 处理。不同石灰用量对土壤硝态氮含量的影响并不显著,且均保持较低水平(40 mg·kg-1以下),意味着土壤pH 的变化对DCD 自身的抑制效果无显著影响(图2b))。
与硝态氮的变化趋势相反,在不施DCD 的条件下,石灰处理土壤铵态氮含量在整个培养期间均显著低于对照处理,其中以施用4 g·kg-1石灰处理下铵态氮含量最低,较不施石灰处理降低62%(图3a))。随着培养时间的增加,土壤中铵态氮含量急剧下降。培养21 d 后,除不施石灰处理外,其余处理土壤铵态氮含量均低于10 mg·kg-1,培养35d 后,各处理土壤铵态氮含量均降至3 mg·kg-1左右(图3a))。在施用DCD 的条件下,不同石灰用量之间铵态氮含量差异不显著,且整个培养期始终维持在100 mg·kg-1以上,显著高于不施DCD 处理,进一步证明了DCD 对硝化作用的抑制效果不受土壤pH 变化的影响(图3b))。
2.3 石灰和硝化抑制剂对土壤表观硝化率的影响
在不施DCD 的条件下,施用石灰显著提高培养7~21 d 期间土壤的表观硝化率。在培养7 d 时,在三种石灰用量中,4 g·kg-1石灰处理表观硝化率最高,其次为6 g·kg-1石灰处理,最低为2 g·kg-1石灰,而在培养14 和21 d,三种石灰用量之间土壤表观硝化率无显著差异;在培养35 d 后,各处理表观硝化率均达到98%以上(表2)。在施用DCD 的条件下,不同石灰用量对土壤表观硝化率无显著影响,且均维持在较低水平(<30%),显著低于不施DCD处理(表2)。
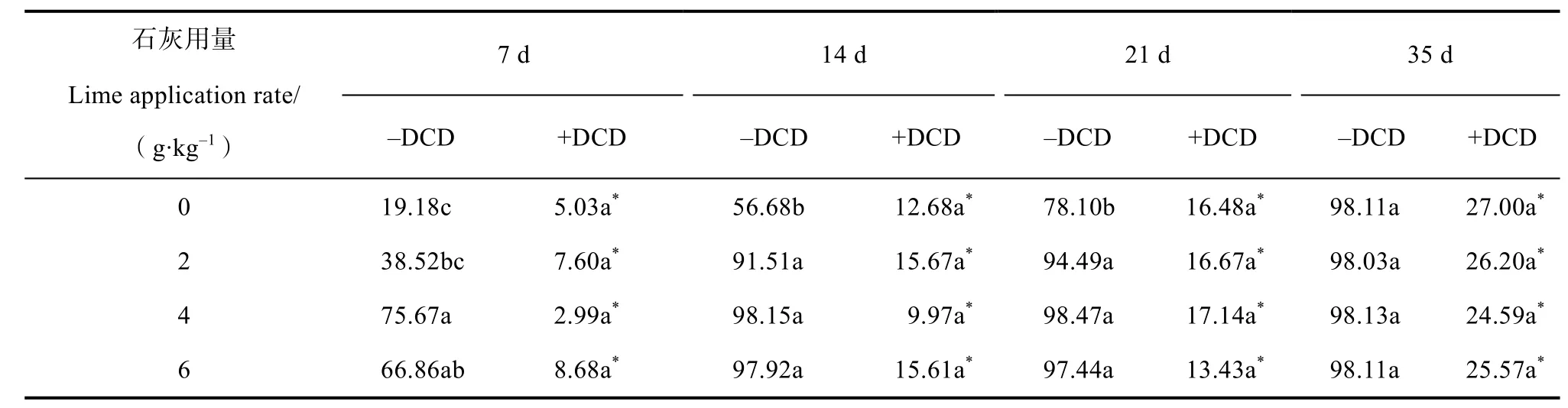
表2 石灰和DCD 处理下的土壤表观硝化率Table 2 Effects of lime and DCD addition on apparent soil nitrification rate/%
进一步分析了施用石灰引起的土壤pH 变化与表观硝化率之间的相关性。结果表明,在培养第7、14、21 天,若不添加DCD,土壤表观硝化率随土壤pH的增加呈现先增加后降低的抛物线趋势(图4)。培养第7、14、21 天的表观硝化率均在pH 6.9 左右达到峰值,峰值分别为72.2%、99.1%和98.8%。若添加DCD,土壤表观硝化率不受土壤pH 影响(图4)。
2.4 石灰和硝化抑制剂对土壤 AOA 和 AOB amoA 丰度的影响
在培养35 d 后,在不施DCD 的条件下,AOA 的丰度随着石灰用量的增加逐渐降低(图5a)),而石灰的施用却显著增加了土壤中AOB 的丰度(图5b))。DCD 的添加仅在未施用石灰的条件下显著降低AOA 的丰度,而在施用石灰的条件下对AOA 丰度无显著影响(图5a))。相反,DCD 的施加在各石灰用量条件下均造成了AOB 丰度的大幅度降低。由此证明,在低pH 条件下,DCD 可同时抑制AOA 和AOB 的数量,而在高pH 条件下,DCD 主要通过抑制AOB 的数量以抑制硝化。
通径分析一方面可以确定自变量与因变量之间的直接关系(直接通径系数),同时也可确定自变量1 通过影响自变量2 而对因变量产生的间接影响(间接通径系数)[20]。由此可从直接影响和间接影响两方面深入研究自变量与因变量之间的相关性。土壤硝化作用主要由AOA 和AOB 来主导,二者可以单独或者联合来控制土壤硝化作用。在添加DCD 的条件下,土壤硝化作用很弱。通过通径分析进一步分析了在不添加DCD 的条件下AOA 和AOBamoA基因丰度对7、14、21 d 土壤表观硝化速率的影响(表3)。在不添加DCD 的条件下,AOA 丰度对土壤表观硝化率的直接影响为负值,意味着随着AOA 丰度的增加,土壤表观硝化率降低,但二者之间相关性在统计学上并不显著。同时,AOA 丰度也通过负面影响AOB 的丰度而间接降低土壤表观硝化率;相反,在培养14 和21 d 后,AOB 丰度直接影响表观硝化速率,且呈现显著正相关关系(表3)。这些结果进一步证明石灰诱导的酸性红壤硝化作用增强是由AOB 所主导。
3 讨 论
3.1 石灰和DCD 对红壤酸化的影响
本研究表明,无论是否添加DCD,当石灰用量小于4 g·kg-1时,土壤pH 随石灰用量的增加显著增加,而当石灰用量大于4 g·kg-1时,继续增施石灰对土壤pH 的提高并不显著(图1)。这可能是因为石灰可以在短时间内中和土壤中的H+,对提高土壤pH有很强的瞬时效果,随后由于土壤自身的缓冲作用,当到达土壤缓冲的临界值时,继续增加石灰用量不会造成土壤pH 的进一步增加[21]。同时本研究也发现,在不添加DCD 的条件下,随着培养时间的延长,石灰对土壤pH 的提高效果有逐渐降低的趋势(图1),这与前人[21-22]的研究结果相似。其原因可能是由于施用石灰增强了土壤硝化作用,从而增加了H+的释放[7]。在添加DCD 的条件下,在整个培养期间土壤pH 一直保持稳定且始终高于不加DCD 处理。在施用2 g·kg-1石灰的条件下,添加DCD 处理的土壤pH 可基本与施用4 g·kg-1石灰处理相持平,这与刘源等[23]的研究结果相似。充分说明DCD 可通过抑制铵态氮的硝化过程以减缓酸化进程。因此,在酸性土壤改良的过程中,不仅需要添加石灰提高土壤pH,还需从源头抑制硝化作用,进行酸化阻控。
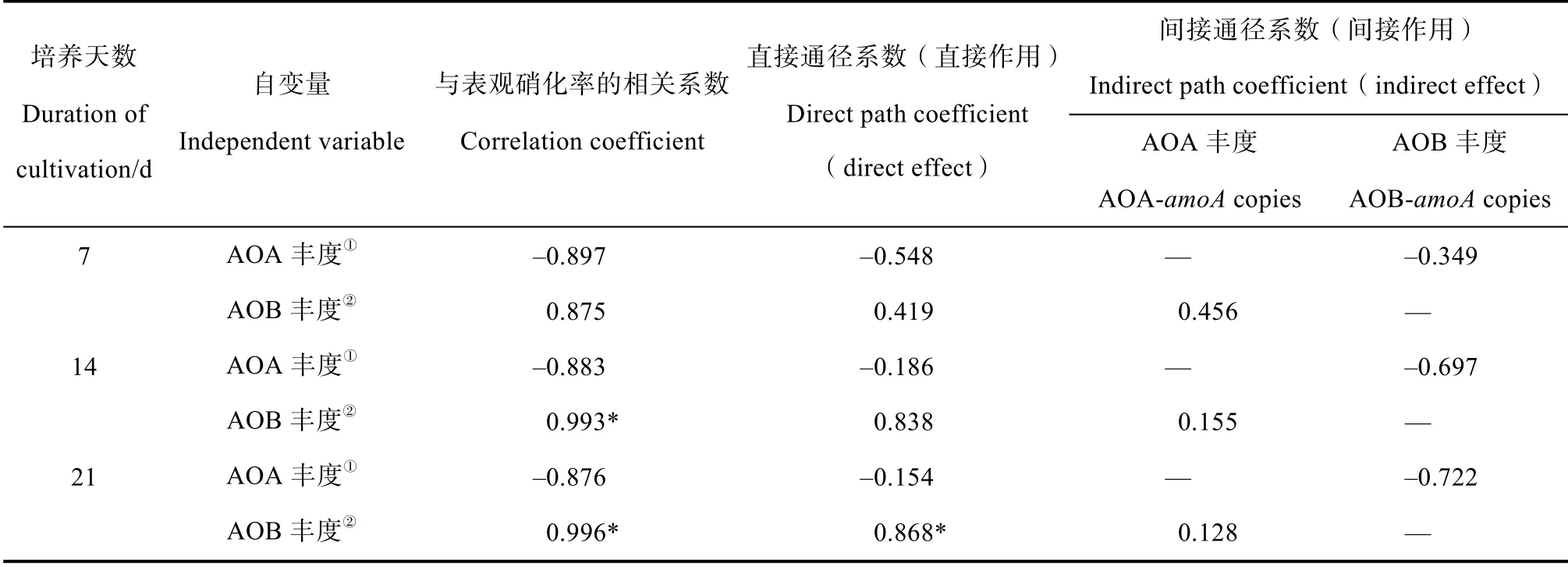
表3 不施DCD 条件下对土壤AOA、AOB 丰度与表观硝化率的通径分析Table 3 Path coefficient analysis of the amoA gene copies in ammonia oxidizing archaea and bacteria and apparent nitrification rate without DCD
3.2 石灰用量对红壤硝化作用的影响及其机制
硝化过程是对pH 高度敏感的生物学过程[16]。施用石灰在大幅度提高酸性红壤pH 的同时,也显著影响硝化反应的进行。在本研究中,土壤表观硝化率在土壤pH 为7 左右时达到峰值,之后随着土壤pH 的增加,表观硝化率呈现降低趋势(表2)。这与Bramley 和White[24]的研究结果相似。究其原因主要有以下两点:(1)pH 的升高会促进氨挥发的发生,当pH 达到7 左右时,继续提高土壤pH 势必会造成更多的氨挥发损失,进而降低底物浓度;(2)高pH 有可能会抑制硝化细菌的活性。Bramley 和White[24]研究发现,土壤硝化细菌活性在土壤pH 6.0附近达到最高,其后随着pH 的增加而降低。本研究也同样发现,随着pH 的增加,AOA 丰度持续降低,AOB 丰度先增加后趋于平缓(图5),与土壤表观硝化率高度相关,进一步证明高pH 环境对硝化微生物的抑制作用。但是,也有研究表明,将初始pH 为7.24 的紫色土用石灰调节至pH 为7.70,在培养18 d 后,表观硝化率仍显著增加[19]。一方面,在他们的研究中,施氮量为500 mg·kg-1土,远高于本试验施氮量(200 mg·kg-1土),因此底物浓度不会成为该试验中硝化过程的限制因子;另一方面,他们所采用的供试土壤初始pH 较高(7.24),其中的硝化微生物很可能已经适应高pH 环境,继续提高土壤pH 则不会抑制其数量和活性。由此可见,对于不同土壤、不同培养环境,达到硝化作用峰值所对应的土壤pH 也不尽相同,这可能与添加的底物浓度、土壤初始pH 及初始硝化微生物数量和活性有关。
本研究中发现,酸性土壤中增施石灰所引起的硝化作用增强主要是由于AOB 丰度的增加,这与众多其他研究结果相似[7,25-26]。与前人研究结果不同的是,在本研究中,由于AOA 的喜酸特性[27],AOAamoA基因丰度随着石灰用量的增加持续降低,而在Teutscherova 等[28]的研究中,施用石灰后土壤中AOA 和AOBamoA基因丰度均显著增加,造成差异的原因可能与供试土壤中氮素矿化过程有关。AOA主要利用土壤有机氮矿化释放的少量NH3生长,在Teutscherova 等[28]的研究中,供试土壤有机碳含量较高(25.8 g·kg-1),为氮素矿化过程提供了充足碳源。随着pH 的增加,土壤中有机氮的矿化过程增强,NH3显著增加,从而促进了AOA 的生长。而在本研究中,土壤有机碳含量较低(8.9 g·kg-1),很可能限制了氮素矿化过程的发生,进而对AOA 的生长无促进作用。
3.3 添加DCD 对红壤硝化作用的影响及其机制
本研究中,在不施用石灰的条件下,添加DCD与不施DCD 处理相比表观硝化率显著降低,且降低幅度始终保持在 70%左右,证实了 DCD 在抑制酸性红壤硝化过程中的有效性。这与诸多前人[29-30]研究结果相同。其原因主要是由于DCD 在酸性条件下显著降低了AOA 和AOB 丰度。但是,诸多研究指出,由于DCD 极易溶于水且移动性较强,降雨会导致其在土壤中发生淋溶损失,减弱其抑制作用[31]。此外,也有研究表明,DCD 在高温下降解较快,在热带地区不适合采用DCD 作为硝化抑制剂[32]。本研究在室内开展,无法完全模拟实际生产中的水热条件。红壤地区多集中于我国东南丘陵区,降雨量大,水热资源丰富,因此,DCD 田间的实际效果尚需进一步验证。
3.4 石灰与DCD 配合施用对红壤硝化的作用效果
在酸性土壤中,抑制铵态氮向硝态氮的转化对提高酸性土壤氮素利用效率具有重要意义。尽管一般情况下酸性土壤本身的硝化作用较弱,但在生产过程中,人们通常会施用石灰以提高土壤pH,保证作物产量,由此间接促进了土壤中的硝化过程。传统的硝化抑制剂DCD 能否在石灰改变pH 的条件下始终有效抑制硝化是当前红壤区生产中亟需解决的问题。本研究发现,与不施 DCD 对照相比,施用DCD 在各石灰用量条件下均有效抑制了红壤硝态氮的产生(图2),显著降低了表观硝化率,且各石灰处理间表观硝化率无显著差异(表2),充分说明DCD 的抑制效果不受土壤pH 升高的影响。与本研究结果不同的是,史云峰等[32]在海南的砖红壤上研究发现,用石灰调节pH 后,DCD 的硝化抑制作用随pH 的升高而降低。此外,最近的研究发现,DCD在pH 较高的潮土和水稻土上对硝化作用的抑制效果较明显,而在酸性红壤上的抑制效果较差[14],也表明DCD 对硝化作用的抑制效果依赖于土壤pH,这与本文结果也有所不一致。DCD 施用量的不同可能是造成结果差异的主要原因。在本研究中,DCD用量为20 mg·kg-1土,为史云峰等[32]DCD 用量的两倍,早有研究表明,DCD 用量越大,其抑制效果越佳[33]。因此,需保证 DCD 的较高施用量,以维持较好的抑制效果。
进一步探究DCD 的作用机理发现,在不同石灰用量条件下,DCD 对硝化作用的抑制机理也不同。在施用石灰的条件下,DCD 主要通过抑制AOB 的数量达到抑制效果。这与诸多研究[34]结果相似。原因一方面是由于AOA 的数量已经被碱性环境强烈抑制,另一方面可能是由于基本代谢和细胞之间的差异,细菌相对古菌更容易受到抑制物的影响[16]。而在不施石灰的条件下,DCD 对AOA 和AOB 的丰度均有显著抑制作用(图5),意味着在酸性条件下,DCD 可能是通过同时抑制AOA 和AOB 来抑制硝化作用。这与Robinson 等[26]的结果相同,说明在不同石灰用量(即不同pH 条件下),DCD 主要通过抑制环境中的主导硝化微生物菌群的生长,从而抑制硝化过程。
4 结 论
通过短期土壤培养试验,本文研究了不同用量石灰和硝化抑制(DCD)对红壤pH 和硝化作用的影响及其机制。结果发现:(1)施用石灰可以短期显著提高红壤的pH,但随着培养时间的延长,石灰对红壤 pH 的提高效果有逐渐降低的趋势。施用DCD 可通过抑制硝化过程提高土壤pH,减缓土壤酸化;(2)红壤表观硝化率随土壤pH 的增加呈现先增加后降低的趋势。在土壤pH 为6.9 左右时,表观硝化率达到峰值。DCD 对硝化作用的抑制效果不受土壤pH 影响;(3)施用石灰提高红壤pH,进而增强硝化作用,其主要是由AOB 所主导。低pH(pH< 6.0)条件下,DCD 对AOA 和AOB 均有显著抑制作用,而在高pH(pH 7.0~7.8)条件下,DCD 主要抑制AOB,而对AOA 的影响并不显著。这些结果表明,在酸性红壤上,石灰和DCD 相结合施用,不仅可以提高土壤pH,减缓土壤酸化,而且可以抑制土壤硝化作用。上述研究结果为酸性红壤改良利用和氮肥施用管理提供了理论支持。
