雷贝拉唑对不同CYP2C19基因型健康志愿者体内氯吡格雷及其活性代谢物药动学的影响
2021-04-07叶艮英何瑞荣梁淑贞周国祥丁少波
叶艮英 何瑞荣 梁淑贞 周国祥 丁少波
摘 要 目的:探討雷贝拉唑对不同CYP2C19代谢型健康志愿者体内氯吡格雷及其活性代谢物药动学特征的影响。方法:选择健康志愿者为对象,根据其CYP2C19基因型按随机数字表法挑选快代谢型、中间代谢型和慢代谢型受试者各8例分组,采用单剂量、随机、开放、两周期的交叉试验设计,各组患者在试验周期内分别单次口服硫酸氢氯吡格雷片300 mg或硫酸氢氯吡格雷片300 mg+雷贝拉唑钠肠溶片20 mg,清洗期为7天。采用超高效液相色谱-串联质谱法检测受试者血浆中氯吡格雷及活性代谢产物H4(MP-H4)的质量浓度,通过DAS 2.0软件计算药动学参数并比较。结果:3种代谢型受试者年龄、身高、体质量、肝酶、血肌酐等一般临床资料比较,差异均无统计学意义(P>0.05)。与单用氯吡格雷者比较,联用雷贝拉唑的快代谢型组受试者体内氯吡格雷的达峰浓度(cmax)和药-时曲线下面积(AUC0-t)分别上升了36%和27%,MP-H4的cmax和AUC0-t分别下降了34%和28%(P<0.01);中间代谢型受试者氯吡格雷的cmax和AUC0-t分别上升了19%和18%,MP-H4的cmax和AUC0-t分别下降了19%和16%(P<0.05或P<0.01);而慢代谢型受试者联用雷贝拉唑后体内氯吡格雷及MP-H4的cmax、AUC0-t以及各代谢型受试者体内氯吡格雷及MP-H4的tmax与单用氯吡格雷者比较,差异均无统计学意义(P>0.05)。结论:在CYP2C19快代谢型和中间代谢型受试者中,联用雷贝拉唑可明显增加氯吡格雷的暴露量并降低其活性代谢产物MP-H4的暴露量;而这种联用对CYP2C19慢代谢型受试者体内氯吡格雷及其活性代谢产物的影响并不显著。
关键词 氯吡格雷;活性代谢产物;雷贝拉唑;CYP2C19;基因型;药动学;药物相互作用
中图分类号 R969.1 文献标志码 A 文章编号 1001-0408(2021)05-0601-07
ABSTRACT OBJECTIVE: To investigate the effects of rabeprazole on the pharmacokinetic characteristics of clopidogrel and its active metabolite in healthy volunteers with different CYP2C19 genotypes. METHODS: Healthy volunteers were selected as subjects, and then randomly divided into extensive metabolizer (EM) group, intermediate metabolizer (IM) group, and poor metabolizer (PM) group with 8 subjects in each group, according to their CYP2C19 genotypes by random number table. In single-dose, randomized, open, two-cycle-crossover design, each group was given Clopidogrel bisulfate tablets 300 mg or Clopidogrel bisulfate tablets 300 mg+Rabeprazole sodium enteric-coated tablets 20 mg. UPLC-MS/MS method was adopted to detect the concentration of clopidogrel and its active metabolite derivative (MP-H4). The pharmacokinetic parameters were calculated and compared by DAS 2.0 software. RESULTS: There was no statistical significance in clinical data as age, height, body weight, liver enzymes and serum creatinine among 3 kinds of metabolism subjects (P>0.05). Compared with subjects receiving clopidogrel alone, cmax and AUC0-t of clopidogrel of subjects combined with rabeprazole in EM group were increased by 36% and 27%, while those of MP-H4 were decreased by 34% and 28%(P<0.01); cmax and AUC0-t of clopidogrel of subjects combined with rabeprazole in IM group were increased by 19% and 18%, while those of MP-H4 were decreased by 19% and 16%(P<0.05 or P<0.01); there was no statistical significance in cmax and AUC0-t of clopidogrel and MP-H4 in PM group after receiving rabeprazole additionally as well as tmax of clopidogrel and MP-H4 in all metablism subjects, compared with clopidogrel alone (P>0.05). CONCLUSIONS: Among CYP2C19 EM and IM subjects, combined use of rabeprazole can significantly increase the exposure of clopidogrel and decrease the exposure of its active metabolite MP-H4, but has no significant impact on clopidogrel and its active metabolite in CYP2C19 PM subjects.
KEYWORDS Clopidogrel; Active motabolite; Rabeprazole; CYP2C19; Genotype; Pharmacokinetics; Drug interaction
目前,我国心血管病患病率和病死率不断上升,估计我国冠心病现患病人数约1 100万,已成为重大的公共卫生问题[1]。氯吡格雷是冠心病患者的一线抗血小板药物,在临床应用广泛,且氯吡格雷和阿司匹林双联抗血小板治疗是急性冠脉综合征(ACS)患者的标准治疗方案[2-3];此外,临床上常推荐联用质子泵抑制剂(PPIs)以预防和/或降低双联抗血小板治疗引起的胃肠道不良反应[4]。有研究指出,联用PPIs可减少双联抗血小板治疗中50%的胃肠道出血风险[5]。有研究指出,氯吡格雷主要经细胞色素P450(CYP)2C19和CYP3A4酶代谢,生成具有抗血小板作用的硫醇代谢物H4(MP-H4)[6-8];而多数PPIs也经上述CYP酶代谢且对CYP2C19酶有不同程度的抑制作用[9],因此联用PPIs可能会抑制MP-H4的生成,从而对氯吡格雷的体内代谢过程造成影响。国内外学者研究并报道了雷贝拉唑对氯吡格雷代谢及其抗血小板作用的影响[10-12],但结果并不一致,同时尚缺乏有关雷贝拉唑对不同CYP2C19基因型携带者氯吡格雷体内代谢影响的研究报道。为此,本研究拟采用两周期的交叉试验来探究雷贝拉唑对不同CYP2C19基因型健康志愿者体内氯吡格雷及其活性代谢物药动学特征的影响,旨在为临床合理用药提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括LC-20AB型高效液相色谱仪(日本Shimadzu公司)、API 4000型质谱仪(美国AB SCIEX公司)、ABI 7500型实时荧光定量聚合酶链式反应(PCR)仪(美国Thermo Fisher Scientific公司)、5424R型高速冷冻离心机(德国Eppendorf公司)等。
1.2 主要药品与试剂
硫酸氢氯吡格雷片[国药准字H20123116,批号B190602A2,规格75 mg(以C16H16ClNO2S计)]购自乐普药业股份有限公司;雷贝拉唑钠肠溶片(国药准字H20080125,批号20190610,规格20 mg)购自晋城海斯制药有限公司;硫酸氢氯吡格雷对照品(批号100819-201906,纯度≥99%)和卡马西平对照品(批号100142-201706,纯度100%)均购自中国食品药品检定研究院;MP-H4对照品(批号5-MNZ-188-22,纯度≥99%)购自加拿大Toronto Research Chemicals公司;2-溴-3′-甲氧基苯乙酮(MPB,批号101522615,纯度≥98%)购自美国Sigma-Aldrich公司;人类CYP2C19基因检测试剂盒(批号19112310)购自武汉友芝友医疗科技股份有限公司;血液基因组DNA提取试剂盒(批号U8618)购自天根生化科技(北京)有限公司;乙腈为色谱纯,其余试剂均为分析纯或实验室常用规格,水为超纯水。
2 对象与方法
2.1 纳入与排除标准
纳入标准:(1)18~40岁男性;(2)体质量指数18~24 kg/m2;(3)无各系统慢性病史,无吸烟史;(4)血常规、尿常规、大便常规、常规体格检查、心电图、肝肾功能检查均正常;(5)对试验所用相关药物不过敏。
排除标准:(1)近3个月内有参加献血或其他临床试验者;(2)近2周内服用过其它药物者。
2.2 研究对象
按上述纳入与排除标准选择2019年10-12月于我院行健康体检的男性志愿者,共150例。本研究经我院医学伦理委员会批准,所有受试者均签署知情同意书。收集所有受试者的相关信息,包括年龄、身高、体质量、体质量指数以及谷氨酸转氨酶、天冬氨酸转氨酶、血肌酐水平等。采用实时荧光PCR仪按CYP2C19基因检测试剂盒说明书方法检测其基因型。PCR反应体系(共25 μL)包括:CYP2C19反应液(PCR缓冲液、特异性引物和探针、内标引物、探针和模板、Taq酶、UNG酶)23 μL和DNA模板(按血液基因组DNA提取试剂盒说明书操作提取)2 μL。反应条件为:37 ℃下以UNG酶处理10 min;95 ℃预变性5 min;95 ℃变性15 s,62 ℃延伸60 s,共40个循环。根据CYP2C19*2及CYP2C19*3反应液在FAM和VIC通道所检测的Ct值(即每个样品荧光信号达到设定阈值时所经历的循环数)是否≤36来判断受试者基因型,并按如下标准判定CYP2C19基因的代谢型:CYP2C19*1/*1为快代谢型,CYP2C19*1/*2、CYP2C19*1/*3为中间代谢型,CYP2C19*2/*2、CYP2C19*2/*3、CYP2C19*3/*3为慢代谢型[13]。
2.3 分组、给药及样本收集
根据受试者基因型检测结果[所有受试者各基因型分布经χ2检验均符合Hardy-Weinberg平衡(P>0.05)],采用随机数字表法挑选CYP2C19快代谢型、中间代谢型和慢代谢型男性健康受试者各8例,分别作为快代谢型组、中间代谢型组和慢代谢型组。各组受试者根据体质量分层后,再通过随机数字表法分为2个小组(每小组4人),分别在2个周期内按不同顺序口服硫酸氢氯吡格雷片300 mg或硫酸氢氯吡格雷片300 mg+雷贝拉唑钠肠溶片20 mg,清洗期为7天。所有受试者在服药前需禁食10 h以上,用240 mL温开水送服药物,服用雷贝拉唑钠肠溶片2 h后再服用硫酸氢氯吡格雷片,4 h后进标准餐。分別在每次给药后0、0.25、0.5、1、1.5、2、3、4、6、8、12、24 h时取受试者静脉血2 mL于乙二酸四乙胺抗凝采血管中,迅速加入500 mmol/L的MPB溶液(以甲醇为溶剂)25 μL,轻微摇匀,在15 min内于4 ℃下以5 000 r/min离心10 min,分离血浆,置于-80 ℃保存,备测。
2.4 氯吡格雷及其代谢产物血药浓度检测
取“2.3”项下血浆样本于室温下解冻后,吸取200 μL于离心管中,加入250 ng/mL卡马西平工作液(以甲醇作为溶剂)20 μL,再加入乙腈800 μL,涡旋5 min后,以 12 000 r/min离心10 min;吸取上清液650 μL,吹干,残渣用流动相100 μL复溶后,采用UPLC-MS/MS法检测血浆中氯吡格雷及其代谢产物MP-H4的质量浓度(以卡马西平为内标)。
色谱条件采用的色谱柱为Shim-pack XR-OD Ⅱ(150 mm×2.0 mm,2.2 ?m),流动相为含2 mmol/L醋酸铵和0.2%甲酸的水溶液-乙腈(40 ∶ 60,V/V),柱温为40 ℃,流速为0.5 mL/min,进样量为10 ?L。质谱条件采用的离子源为电喷雾离子源,以多反应监测模型进行正离子扫描,离子化电压为5 100 kV,毛细管温度为610 ℃,用于定量分析的离子对分别为m/z 322→212(氯吡格雷)、m/z 504→155(MP-H4)、m/z 237→194(内标)。结果,氯吡格雷、MP-H4检测质量浓度的线性范围分别为0.005~20.0、0.5~250.0 ng/mL。样品溶液配制、方法学考察等内容见前期研究[14]。
2.5 统计学分析
采用DAS 2.0软件计算达峰浓度(cmax)、达峰时间(tmax)和药-时曲线下面积(AUC0-t)等药动学参数,并计算cmax和AUC0-t的几何均值比及其双侧90%置信区间(CI),采用GraphPad Prism 7软件绘制药-时曲线;采用SPSS 22.0对数据进行统计分析。一般临床资料使用Shapiro-Wilk检验进行正态性分析,若符合正态分布则以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验;若不符合正态分布则以中位数(四分位间距)表示,多组间比较采用Kruskal-Wallis检验,组间两两比较采用Mann-Whitney检验。药动学参数cmax、AUC0-t均以x±s表示,以几何均值比及其90%CI进行组间比较;tmax以中位数(最低值,最高值)表示,采用Wilcoxon符号秩和检验进行组间比较。P<0.05为差异有统计学意义。
3 结果
3.1 一般临床资料
3种代谢型受试者的年龄、身高、体质量、体质量指数等一般临床资料比较,差异均无统计学意义(P>0.05),具有可比性,详见表1。
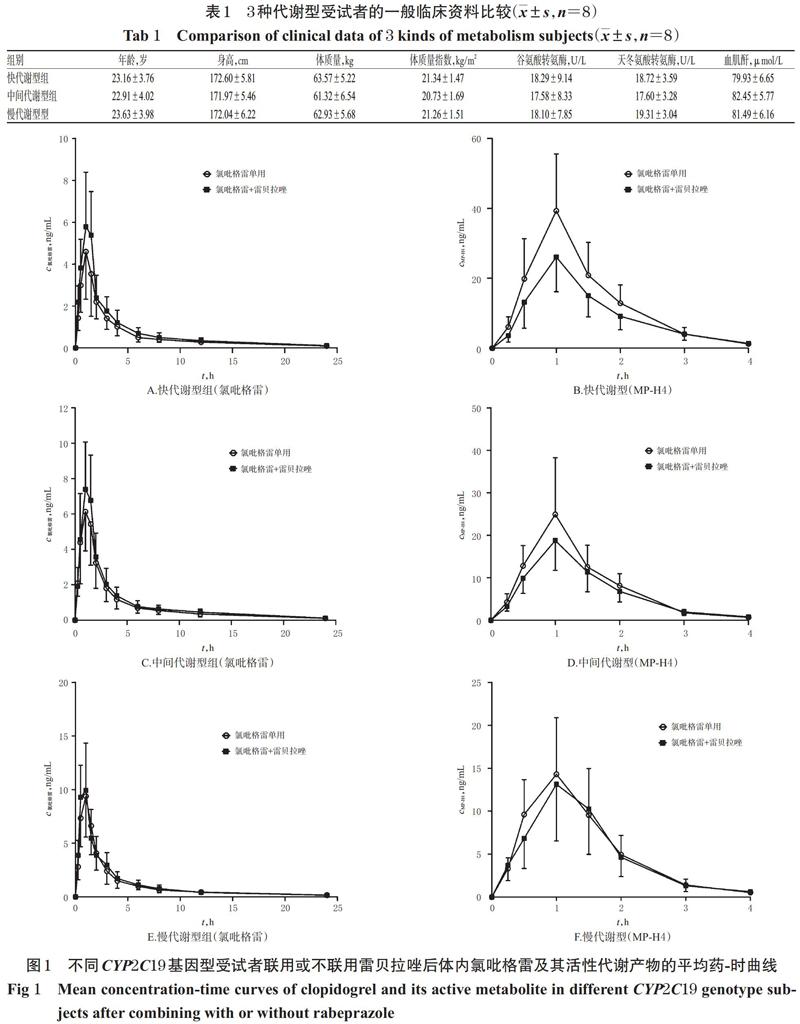
3.2 药-时曲线分析
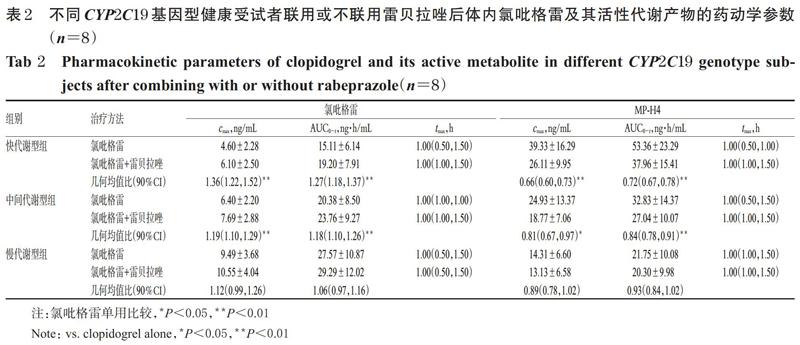
快代谢型组、中间代谢型组和慢代谢型组受试者单独口服硫酸氢氯吡格雷片300 mg和口服硫酸氢氯吡格雷片300 mg+雷贝拉唑钠肠溶片20 mg后,氯吡格雷及其活性代谢物MP-H4的平均药-时曲线见图1,药动学参数见表2。由图1、表2可见,氯吡格雷在不同代谢型受试者体内暴露量(即AUC0-t,下同)由高到低依次为慢代谢型>中间代谢型>快代谢型,MP-H4暴露量由高到低依次为快代谢型>中间代谢型>慢代谢型,且联用雷贝拉唑钠肠溶片对快代谢型患者氯吡格雷及其代谢产物血药浓度的影响更明显。
3.3 不同CYP2C19基因型受试者联用雷贝拉唑对氯吡格雷及其活性代谢物药动学参数的影响
由表2可见,与单用硫酸氢氯吡格雷(300 mg)比较,联用雷贝拉唑(20 mg)后,各代谢型受试者体内氯吡格雷及MP-H4的tmax差异均无统计学意义(P>0.05);而快代谢型组两药联用者体内氯吡格雷的cmax和AUC0-t分别较单用氯吡格雷者增加了36%、27%,MP-H4的cmax和AUC0-t分别降低了34%、28%,差异均有统计学意义(P<0.01);中间代谢型组两药联用者体内氯吡格雷的cmax和AUC0-t分别较单用氯吡格雷者增加了19%、18%,MP-H4的cmax和AUC0-t分别降低了19%、16%,差异均有统计学意义(P<0.01);慢代谢型组两药联用者体内氯吡格雷的cmax和AUC0-t分别较单用氯吡格雷者增加了12%、6%,MP-H4的cmax和AUC0-t分别降低11%、7%,但差异均无统计学意义(P>0.05)。这提示联用雷贝拉唑可对CYP2C19快代谢型和中间代谢型两药联用者体内氯吡格雷及其活性代谢产物的药动学参数造成显著影响。
4 讨论
氯吡格雷属于P2Y12受体拮抗剂,是一种前体药物,口服吸收后约85%经羧酸酯酶1水解成无活性的羧酸代谢物,其余15%经CYP1A2、CYP2B6、CYP2C9、CYP2C19、CYP3A4和CYP3A5等肝药酶的两步氧化作用代谢为活性硫醇代谢物MP-H4,其中CYP2C19和CYP3A4酶起主要作用[6]。临床上与氯吡格雷联用较多的他汀类药物、PPIs和钙离子通道阻滞剂等所引起的药物相互作用受到了学者的广泛关注[15-16]。目前,临床上常用的PPIs包括奥美拉唑、埃索美拉唑、兰索拉唑、雷贝拉唑和泮托拉唑。大多数PPIs均经过CYP2C19和CYP3A4酶代谢且对CYP2C19酶有不同程度的抑制作用;体外研究结果显示,对CYP2C19酶抑制作用由强到弱的PPIs依次为兰索拉唑>奥美拉唑>雷贝拉唑硫醚>埃索美拉唑>泮托拉唑>雷贝拉唑[17]。结合药动学及临床疗效研究结果,临床认为奥美拉唑和埃索美拉唑对氯吡格雷的体内代谢影响最大,兰索拉唑次之,泮托拉唑和雷贝拉唑的影响最小,故大多选择泮托拉唑或雷贝拉唑与氯吡格雷联用[18-19]。虽然雷贝拉唑约80%经非酶途径代谢[20],但是其硫醚代谢物对CYP2C19酶具有较强的抑制作用[9],这可能是该药影响氯吡格雷体内代谢的原因之一。
然而,目前关于雷贝拉唑对氯吡格雷药效学及药动学指标的影响仍存在一定争议,如Wu等[10]研究发现,联用雷贝拉唑不影响患者氯吡格雷的抗血小板作用,且对氯吡格雷及MP-H4的药动学参数也无显著影响;Funck-Brentano等[12]研究发现,联用雷贝拉唑虽然对氯吡格雷药效学参数无显著影响,但可显著减少MP-H4的生成;而Furuta等[21]则发现,联用雷贝拉唑10 mg便可显著减弱氯吡格雷的抗血小板作用。另外,本课题组前期研究发现,联用雷贝拉唑可增加氯吡格雷的暴露量并降低MP-H4的暴露量[14]。与此同时,除药物相互作用外,基因多态性也是影响氯吡格雷疗效及药动学特征的重要因素。其中,CYP2C19基因可根据*2、*3的突变情况分为快代谢型、中间代谢型及慢代谢型。研究显示,在CYP2C19各等位基因中,*2和*3突变将显著降低CYP2C19酶活性,且这两种分型在亚洲人群中的分布频率分别为29%~35%和2%~9%,远高于白种人群[13]。有研究指出,CYP2C19基因多态性可直接影响氯吡格雷的体内代谢及疗效,慢代谢型受试者在单日口服75 mg和150 mg的氯吡格雷后,其体内MP-H4的暴露量比快代谢型受试者分别低71%和64%,腺苷二磷酸诱导的血小板抑制率分别低10.5%和7.9%[22]。本研究也得出了相似的结果:快代谢型组、中间代谢型组和慢代谢型组患者单独口服氯吡格雷时,其体内MP-H4的AUC0-t分别为(53.36±23.29)、(32.83±14.37)、(21.75±10.08) ng·h/mL。此外,CYP2C19基因多态性还对氯吡格雷和雷贝拉唑与其它药物的相互作用产生影响,如Furuta等[11]研究发现,在快代谢型健康志愿者中,奥美拉唑和雷贝拉唑均显著减弱了氯吡格雷的抗血小板作用,但在*2和/或*3突变携带者中并不明显;何瑞荣等[23]的一项基于300例ACS患者的研究发现,在慢代谢型患者中,与瑞舒伐他汀、普伐他汀相比,阿托伐他汀能更显著地降低氯吡格雷的抗血小板作用,但这种作用对快代谢型和中间代谢型患者并不明显;Nuki等[24]的研究纳入了26例联用塞来昔布和雷贝拉唑以及29例联用塞来昔布和安慰剂的志愿者,結果发现联用雷贝拉唑组中的中间代谢型+慢代谢型者小肠损伤发生率远高于快代谢型者(85.7% vs. 31.6%,P=0.026)。这提示联用雷贝拉唑可能会对氯吡格雷等药物的体内过程造成影响。笔者通过前期文献查阅得知,目前尚缺乏探究雷贝拉唑对不同CYP2C19基因型受试者体内氯吡格雷药动学影响的相关研究,因此本研究采用单剂量、随机、开放、两周期的交叉试验设计,初步分析了联用雷贝拉唑对不同基因型健康受试者体内氯吡格雷代谢的影响。
有研究指出,雷贝拉唑的药效及暴露量受到CYP2C19基因型的显著影响,即对雷贝拉唑暴露量和药效的影响排序均为慢代谢型>中间代谢型>快代谢型[25];而且联用CYP2C19酶抑制剂氟伏沙明后,受试者体内雷贝拉唑及非酶途径代谢产物雷贝拉唑硫醚的暴露量均大幅增加[26]。上述结果提示,当CYP2C19酶活性下降时,口服雷贝拉唑后雷贝拉唑及其硫醚代谢物血药浓度均增加,对CYP2C19酶的抑制作用应该增强。然而,本研究结果显示,对雷贝拉唑抑制氯吡格雷代谢为MP-H4的影响排序为快代谢型>中间代谢型>慢代谢型;联用雷贝拉唑后,CYP2C19快代谢型、中间代谢型和慢代谢型受试者体内氯吡格雷暴露量分别升高27%、18%和6%,MP-H4暴露量分别降低28%、16%和7%。这说明CYP2C19酶活性下降虽然导致了雷贝拉唑及其硫醚代谢物血药浓度增加,但并未导致雷贝拉唑对氯吡格雷代谢抑制作用的进一步增强。这一发现与此前Furuta等[21]学者的研究结果基本一致(即联用雷贝拉唑10 mg能显著降低快代谢型和中间代谢型受试者口服氯吡格雷75 mg的抗血小板作用,但对慢代谢型受试者无明显影响),但具体机制尚有待进一步研究。
综上所述,在CYP2C19快代谢型和中间代谢型健康志愿者中,联用雷贝拉唑可显著增加氯吡格雷的暴露量并降低活性代谢产物MP-H4的暴露量;而这种联用对CYP2C19慢代谢型受试者体内氯吡格雷及其活性代谢产物的影响并不显著。本研究结果对临床个体化用药有一定的参考价值,即CYP2C19快代谢型和中间代谢型患者联合使用氯吡格雷和雷贝拉唑时应注意药物相互作用的影响,但这一影响是否会不利于临床治疗结局还有待进一步研究。此外,本研究并未设置对CYP2C19酶抑制作用更强的兰索拉唑、奥美拉唑等作为对照,无法比较不同抑制强度的PPIs对不同CYP2C19基因型受试者体内氯吡格雷代谢的影响,存在一定的局限性,有待后续研究予以完善。
参考文献
[ 1 ] 中国心血管健康与疾病报告编写组.中国心血管健康与疾病报告2019概要[J].中国循环杂志,2020,35(9):833- 854.
[ 2 ] 中华医学会心血管病学分会,中华心血管病杂志编辑委员会.急性ST段抬高型心肌梗死诊断和治疗指南:2019[J].中华心血管病杂志,2019,47(10):766-783.
[ 3 ] IBANEZ B,JAMES S,AGEWALL S,et al. 2017 ESC guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation:the task force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC)[J]. Eur Heart J,2018,39(2):119-177.
[ 4 ] VALGIMIGLI M,BUENO H,BYRNE RA,et al. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS:the task force for dual antiplatelet therapy in co- ronary artery disease of the European Society of Cardiology (ESC) and of the European Association for Cardio-Thoracic Surgery (EACTS)[J]. Eur Heart J,2018,39(3):213-260.
[ 5 ] SILLER-MATULA JM,JILMA B,SCHROR K,et al. Effect of proton pump inhibitors on clinical outcome in patients treated with clopidogrel:a systematic review and meta-analysis[J]. J Thromb Haemost,2010,8(12):2624- 2641.
[ 6 ] KAZUI M,NISHIYA Y,ISHIZUKA T,et al. Identification of the human cytochrome P450 enzymes involved in the two oxidative steps in the bioactivation of clopidogrel to its pharmacologically active metabolite[J]. Drug Metab Dispos,2010,38(1):92-99.
[ 7 ] 鐘诗龙,韩雅玲,陈纪言,等.氯吡格雷抗血小板治疗个体化用药基因型检测指南解读[J].中国实用内科杂志,2015,35(1):38-41.
[ 8 ] TUFFAL G,ROY S,LAVISSE M,et al. An improved method for specific and quantitative determination of the clopidogrel active metabolite isomers in human plasma[J]. Thromb Haemost,2011,105(4):696-705.
[ 9 ] LI XQ,ANDERSSON TB,AHLSTROM M,et al. Comparison of inhibitory effects of the proton pump-inhibiting drugs omeprazole,esomeprazole,lansoprazole,pantoprazole,and rabeprazole on human cytochrome P450 activities[J]. Drug Metab Dispos,2004,32(8):821-827.
[10] WU J,JIA LT,SHAO LM,et al. Drug-drug interaction of rabeprazole and clopidogrel in healthy Chinese volunteers[J]. Eur J Clin Pharmacol,2013,69(2):179-187.
[11] FURUTA T,IWAKI T,UMEMURA K. Influences of different proton pump inhibitors on the anti-platelet function of clopidogrel in relation to CYP2C19 genotypes[J]. Br J Clin Pharmacol,2010,70(3):383-392.
[12] FUNCK-BRENTANO C,SZYMEZAK J,STEICHEN O,et al. Effects of rabeprazole on the antiplatelet effects and pharmacokinetics of clopidogrel in healthy volunteers[J]. Arch Cardiovasc Dis,2013,106(12):661-671.
[13] SCOTT SA,SANGKUHL K,STEIN CM,et al. Clinical pharmacogenetics implementation consortium guidelines for CYP2C19 genotype and clopidogrel therapy:2013 update[J]. Clin Pharmacol Ther,2013,94(3):317-323.
[14] 何瑞榮,丁少波,胡润凯,等. LC-MS/MS法测定泮托拉唑及雷贝拉唑对氯吡格雷及其活性代谢物药代动力学的影响[J].中国临床药理学杂志,2019,35(19):2369- 2372.
[15] 宋浩静,杜亚斌,郭彩会,等.我院门诊处方中具有潜在相互作用的氯吡格雷联合用药的调查分析[J].中国药房,2018,29(17):2429-2432.
[16] 陈新利,李雪松,丁永丽,等.非遗传因素对氯吡格雷疗效影响的研究进展[J].中国临床药理学杂志,2018,34(14):1719-1722.
[17] 张玉,赵杰,童荣生,等.质子泵抑制剂优化应用专家共识[J/OL].中国医院药学杂志(2020-05-06)[2020-09-10]. http://kns.cnki.net/kcms/detail/42.1204.r.20200430.1503. 002.html.
[18] NORGARD NB,MATHEWS KD,WALL GC. Drug-drug interaction between clopidogrel and the proton pump inhibitors[J]. Ann Pharmacother,2009,43(7):1266-1274.
[19] FRELINGER AL 3RD,LEE RD,MULFORD DJ,et al. A randomized,2-period,crossover design study to assess the effects of dexlansoprazole,lansoprazole,esomeprazole,and omeprazole on the steady-state pharmacokinetics and pharmacodynamics of clopidogrel in healthy volunteers[J]. J Am Coll Cardiol,2012,59(14):1304-1311.
[20] CIANCIOLO G,FELICIANGELI G,COMAI G,et al. Protonic pump inhibitors in kidney transplant patients:efficacy and safety[J]. Minerva Urol Nefrol,2007,59(2):207-215.
[21] FURUTA T,SUGIMOTO M,KODAIRA C,et al. Influence of low-dose proton pump inhibitors administered concomitantly or separately on the anti-platelet function of clopidogrel[J]. J Thromb Thrombolysis,2017,43(3):333-342.
[22] SIMON T,BHATT DL,BERGOUGNAN L,et al. Genetic polymorphisms and the impact of a higher clopidogrel dose regimen on active metabolite exposure and antiplatelet response in healthy subjects[J]. Clin Pharmacol Ther,2011,90(2):287-295.
[23] 何瑞荣,丁少波,梁淑贞,等.阿托伐他汀、瑞舒伐他汀及普伐他汀对不同CYP2C19基因型急性冠脉综合征患者氯吡格雷抗血小板作用的影响[J].中国药学杂志,2019,54(19):1599-1603.
[24] NUKI Y,UMENO J,WASHIO E,et al. The influence of CYP2C19 polymorphisms on exacerbating effect of rabeprazole in celecoxib-induced small bowel injury[J]. Aliment Pharmacol Ther,2017,46(3):331-336.
[25] HAYATO S,HASEGAWA S,HOJO S,et al. Dose-response relationships of rabeprazole 5,10,20,and 40 mg once daily on suppression of gastric acid secretion through the night in healthy Japanese individuals with different CYP2C19 genotypes [J]. Eur J Clin Pharmacol,2012,68(5):579-588.
[26] UNO T,SHIMIZU M,YASUI-FURUKORI N,et al. Different effects of fluvoxamine on rabeprazole pharmacokinetics in relation to CYP2C19 genotype status[J]. Br J Clin Pharmacol,2006,61(3):309-314.
(收稿日期:2020-07-10 修回日期:2021-01-07)
(编辑:张元媛)
