基于UPLC法测定指标成分结合指纹图谱评价不同产地川赤芍不同部位的质量
2021-04-07钟海蓉张绍山海来约布曲别军长李奕松杨正明
钟海蓉,张绍山,肖 芳,海来约布,曲别军长,李奕松,杨正明*,刘 圆
• 药材与资源 •
基于UPLC法测定指标成分结合指纹图谱评价不同产地川赤芍不同部位的质量
钟海蓉1,张绍山2, 4,肖 芳1,海来约布1,曲别军长1,李奕松1,杨正明2, 4*,刘 圆3, 4*
1. 西南民族大学药学院,四川 成都 610041 2. 西南民族大学青藏高原研究院,四川 成都 610041 3. 西南民族大学民族医药研究院,四川 成都 610041 4. 四川省羌彝药用资源保护与利用技术工程实验室,四川 成都 610225
采用超高效液相色谱法(UPLC)分别对18个产地川赤芍的根、茎和叶中的芍药苷、氧化芍药苷、1,2,3,4,6--五没食子酰葡萄糖3种成分进行含量测定,并建立其指纹图谱,基于多元统计法综合分析川赤芍根、茎和叶中主要化学成分的整体分布以及在不同部位中的差异性,并对川赤芍品质进行综合评价。采用UPLC法,色谱条件:C18色谱柱(100 mm×2.1 mm,1.8 μm),流动相为乙腈-0.1%磷酸水溶液,梯度洗脱,柱温30 ℃,体积流量0.2 mL/min,进样量1 μL,检测波长230 nm;采用2012版《中药色谱指纹图谱相似度评价系统》软件建立图谱;并采用差异分析、相似度分析、主成分分析(PCA)、TOPSIS分析和偏最小二乘法判别分析(PLS-DA)对川赤芍品质进行综合评价。根据含量测定结果,川赤芍中氧化芍药苷含量大小为根>茎>叶;芍药苷、1,2,3,4,6--五没食子酰葡萄糖含量大小为根>叶>茎。其中,根样品中的芍药苷含量均大于1.8%,符合《中国药典》2020年版规定;茎、叶中芍药苷含量与根较为接近。并建立了根、茎、叶的UPLC指纹图谱,共标定了17个共有峰,并指认出3个共有峰(芍药苷、氧化芍药苷、1,2,3,4,6--五没食子酰葡萄糖)。相似度评价结果显示,不同产地川赤芍根、茎、叶的相似度均较好,质量稳定。指纹图谱可有效评价不同产地川赤芍品质。川赤芍茎、叶中芍药苷含量与根中相近,基于《中国药典》2020年版以芍药苷为质量控制指标,为综合评价川赤芍的品质和开发新的入药部位等研究提供相关理论基础。
川赤芍;指纹图谱;芍药苷;氧化芍药苷;主成分分析;品质评价;资源开发
川赤芍Lynch为毛茛科芍药属多年生草本植物,以其根入药,为《中国药典》2020年版所收载赤芍的来源之一。赤芍为传统常用中药材,用途广泛,具有清热凉血、散瘀止痛的功效[1]。川赤芍化学成分主要为苷类、酚类、黄酮类化合物,其质量评价多以单萜苷类成分芍药苷为指标,《中国药典》2020年版规定芍药苷不得少于1.8%[2-3]。
川赤芍主产地为四川西部,集中生长在青藏高原的边缘地带。其生长环境苛刻,通常为海拔2650~3750 m的高原和峡谷地,在生态脆弱的青藏高原,川赤芍的自我再生非常缓慢,目前人工种植尚未起步;多个主产区的川赤芍野生资源蕴藏量逐年减少,上市量随之锐减,野生川赤芍已呈濒危之势[4-5]。
近年来,指纹图谱法在中药研究中应用较多[6-7],作为评价药材质量和稳定性的最优方法,具有综合、宏观、模糊等非线性特点[8-11]。有相关文献报道[12-14],根据2种基原的赤芍指纹图谱,可快速、准确地鉴别2种赤芍,综合评价二基原赤芍药材的质量。目前,前人对以芍药为基原的赤芍研究较多,但是对于川赤芍的研究较少。本研究采用指纹图谱、相似度分析、聚类分析等方法从多角度分析,综合评价不同产地、不同部位的川赤芍质量。从中药资源的综合利用和药材质量评价角度出发,采用UPLC法对18批不同产地川赤芍的不同植物部位中芍药苷、氧化芍药苷、1,2,3,4,6--五没食子酰葡萄糖等3种成分进行含量测定,并建立了根、茎、叶的化学成分指纹图谱,通过多元统计分析,研究川赤芍根、茎、叶中化学成分的整体分布和含量变化及定量比较,以期最大化的综合利用野生川赤芍资源,对评价川赤芍品质和开发新的入药部位等研究具有一定的参考意义。
1 仪器、试剂与材料
WatersAcquityUPLC®超高效液相色谱仪(美国Waters公司);ACQUITY UPLC®BEH C18色谱柱(100 mm×2.1 mm,1.8 μm);BP211D型电子天平(德国Sartorius公司);KQ-5200E型超声波清洗器(昆山超声仪器有限公司);METTLERAE240电子分析天平(上海梅特勒-托利多仪器有限公司)。
对照品芍药苷(批号18012305)、氧化芍药苷(批号18082704)、1,2,3,4,6--五没食子酰葡萄糖(批号19010904)均购自成都格利普生物科技有限公司,质量分数均≥98.0%;乙腈为色谱纯(美国Sigma公司);甲醇为分析纯(成都市科隆化工试剂厂);水为屈臣氏蒸馏水;其余试剂为分析纯。
本课题组在全国第四次中药资源普查工作中,对汶川县和壤塘县进行中药资源调查,分别于2017—2018年于四川省甘孜藏族自治州各地与阿坝藏族羌族自治州沿途采集川赤芍样品。经西南民族大学青藏高原研究院刘圆教授鉴定为毛茛科芍药属植物川赤芍Lynch,川赤芍样品信息见表1。
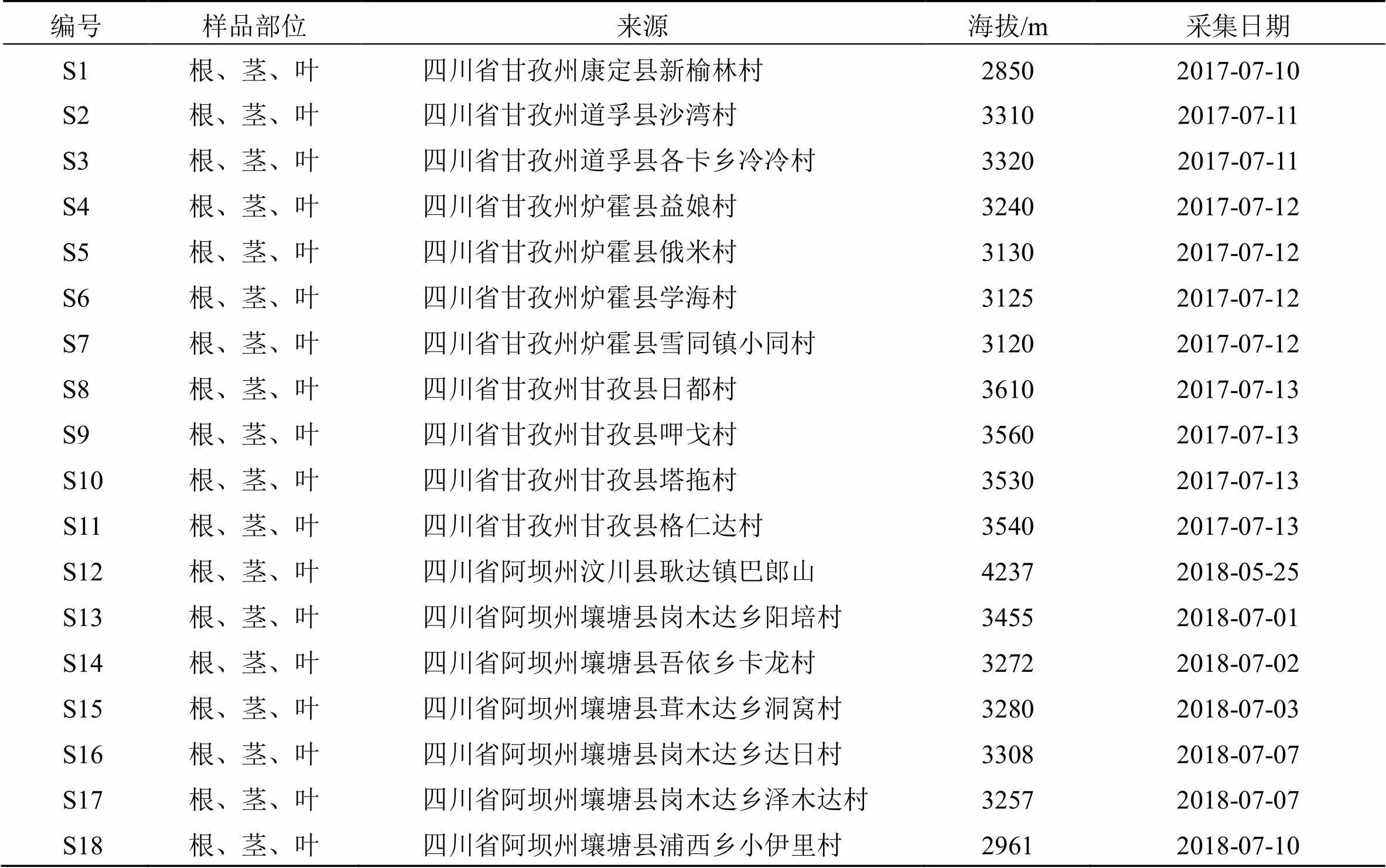
表1 川赤芍样品来源
2 方法与结果
2.1 色谱条件
Waters Acquity UPLC®超高效液相色谱仪(美国Waters公司);ACQUITY UPLC®BEH C18色谱柱(100 mm×2.1 mm,1.8 μm);流动相为乙腈(A)- 0.1%磷酸水溶液(B),梯度洗脱程序:0~5 min,5%~8% A;5~8 min,8%~12% A;8~13 min,12%~15% A;13~23 min,15%~20% A;23~27 min,20%~22% A;27~33 min,22%~75% A;33~34 min,75%~100% A;柱温30 ℃;体积流量0.2 mL/min;进样量1 μL;检测波长230 nm。供试品及对照品色谱图见图1。
2.2 混合对照品溶液制备
分别精密称取芍药苷、氧化芍药苷、1,2,3,4,6--五没食子酰葡萄糖对照品适量,加甲醇制成含芍药苷1.017 mg/mL、氧化芍药苷0.200 mg/mL、1,2,3,4,6--五没食子酰葡萄糖0.296 mg/mL的混合对照品溶液,摇匀,即得。
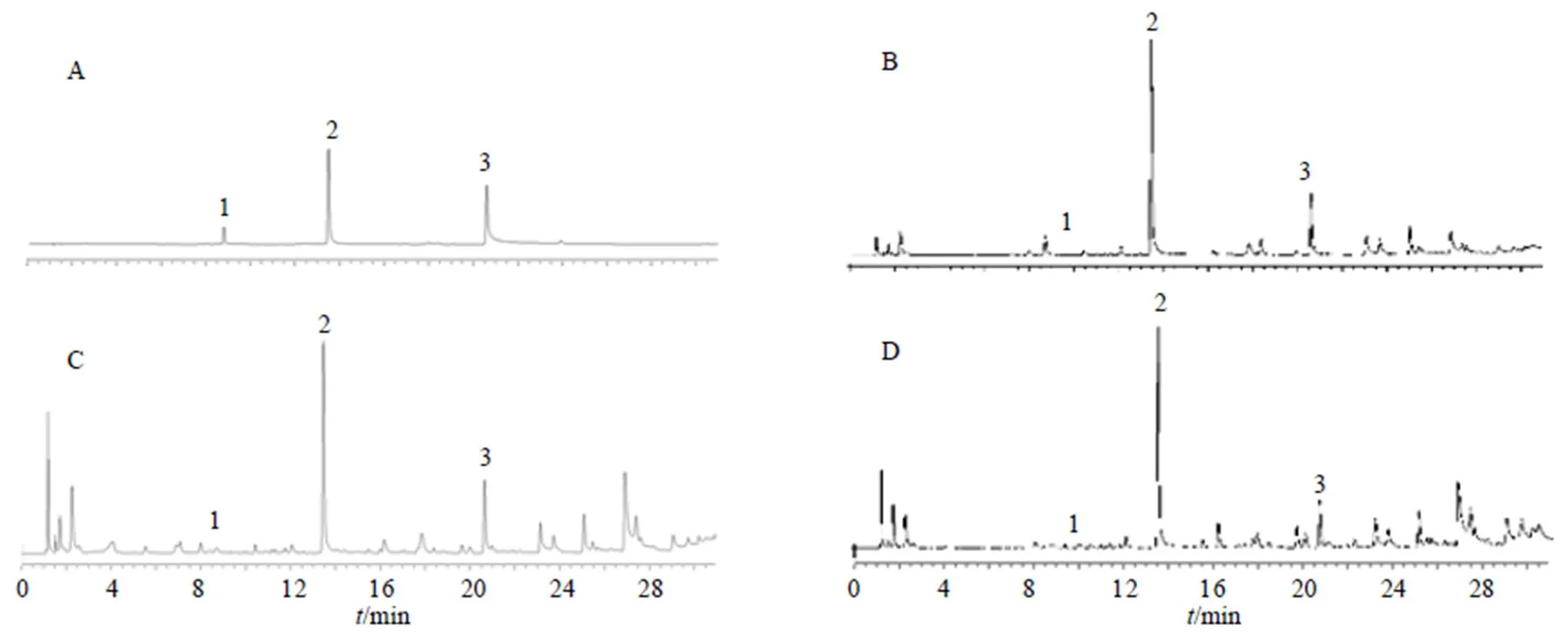
1-氧化芍药苷 2-芍药苷 3-1,2,3,4,6-O-五没食子酰葡萄糖
2.3 供试品溶液制备
称取药材粉末(过3号筛)约0.5 g,精密称定,置于100 mL锥形瓶中,加入甲醇25 mL,摇匀,密封称定质量,超声75 min后,冷却,密封称定质量,用甲醇补足减少的质量,滤过,续滤液用0.22 μm微孔滤膜滤过,备用。
2.4 方法学考察
2.4.1 专属性试验 分别取供试品溶液(根、茎、叶)和混合对照品溶液“2.1”项下色谱条件测定,得到特征峰,供试品溶液与杂质分离良好,无干扰。
2.4.2 线性关系考察 精密吸取混合对照品溶液,稀释成6个不同浓度,按“2.1”项下色谱条件测定,并记录峰面积。以对照品浓度为横坐标(),峰面积为纵坐标(),绘制标准曲线,并进行线性回归,得3种成分的回归方程与线性范围,见表2。

表2 回归方程与线性范围
2.4.3 精密度试验 取混合对照品溶液连续进样6次,按“2.1”项下色谱条件测定,计算峰面积的RSD值,氧化芍药苷、芍药苷、1,2,3,4,6--五没食子酰葡萄糖峰面积RSD值分别为0.71%、0.26%、1.98%。
2.4.4 重复性试验 精密称取同一药材样品,共6份,制备供试品溶液,按“2.1”项下色谱条件测定,得氧化芍药苷、芍药苷、1,2,3,4,6--五没食子酰葡萄糖质量分数RSD分别是1.45%、1.31%、1.08%。
2.4.5 稳定性试验 取同一供试品溶液,分别于6、12、18、24、32、40、48 h进样,按“2.1”项下色谱条件测定,得氧化芍药苷、芍药苷、1,2,3,4,6--五没食子酰葡萄糖峰面积RSD分别是2.75%、0.83%、1.26%。
2.4.6 加样回收率试验 精密称取已测定的样品0.25 g,共6份,分别添加一定浓度的芍药苷、氧化芍药苷、1,2,3,4,6--五没食子酰葡萄糖对照品溶液,依照“2.3”项方法制备样品溶液,按“2.1”项下色谱条件测定,芍药苷、氧化芍药苷、1,2,3,4,6--五没食子酰葡萄糖加样回收率在98.72%~101.41%,RSD在1.49%~2.68%。
2.5 不同产地川赤芍多成分含量测定
2.5.1 川赤芍不同植物部位含量测定结果及化学成分定量比较 18批川赤芍不同植物部位含量测定结果见表3。由表3可知,川赤芍根样品中氧化芍药苷、芍药苷、1,2,3,4,6--五没食子酰葡萄糖含量分别为0.14%~0.85%、1.79%~4.11%、0.20%~0.80%;茎样品中氧化芍药苷、芍药苷、1,2,3,4,6--五没食子酰葡萄糖含量分别为0.10%~0.32%、1.08%~1.96%、0.09%~0.58%;叶样品中氧化芍药苷、芍药苷、1,2,3,4,6--五没食子酰葡萄糖质量分数分别为0.02%~0.18%、1.13%~5.40%、0.11%~0.70%。根中芍药苷平均含量为3.20%,均大于1.8%,符合药典规定;18批次叶样品的平均含量为2.19%,大部分达到了《中国药典》2020年版标准,且1,2,3,4,6--五没食子酰葡萄糖平均含量与根相近;茎中芍药苷平均质量分数为1.45%,接近《中国药典》标准。因此,考虑可将茎叶作为芍药苷的开发部位使用。
2.5.2 差异性分析 川赤芍根、茎、叶样品中氧化芍药苷、芍药苷和1,2,3,4,6--五没食子酰葡萄糖含量范围、均值及差异性分析结果见图2。
由图2可知,川赤芍中氧化芍药苷含量大小为根>茎>叶,芍药苷、1,2,3,4,6--五没食子酰葡萄糖含量大小为根>叶>茎。川赤芍根、茎、叶中氧化芍药苷和芍药苷含量差异极显著,1,2,3,4,6--五没食子酰葡萄糖含量差异显著。
2.5.3 TOPSIS分析 根据氧化芍药苷、芍药苷、1,2,3,4,6--五没食子酰葡萄糖权重结果(以变异系数法计算,表4),以标准化的数据采用DPS软件进行TOPSIS分析[15],得川赤芍根(G1~18)、茎(J1~18)、叶(Y1~18)结果见表5。结果表明,以氧化芍药苷、芍药苷、1,2,3,4,6--五没食子酰葡萄为评价指标,根据最优值相对接近度(CI)排名,3号川赤芍根样品质量最优、6号川赤芍茎样品质量最优、6号川赤芍叶样品质量最优。
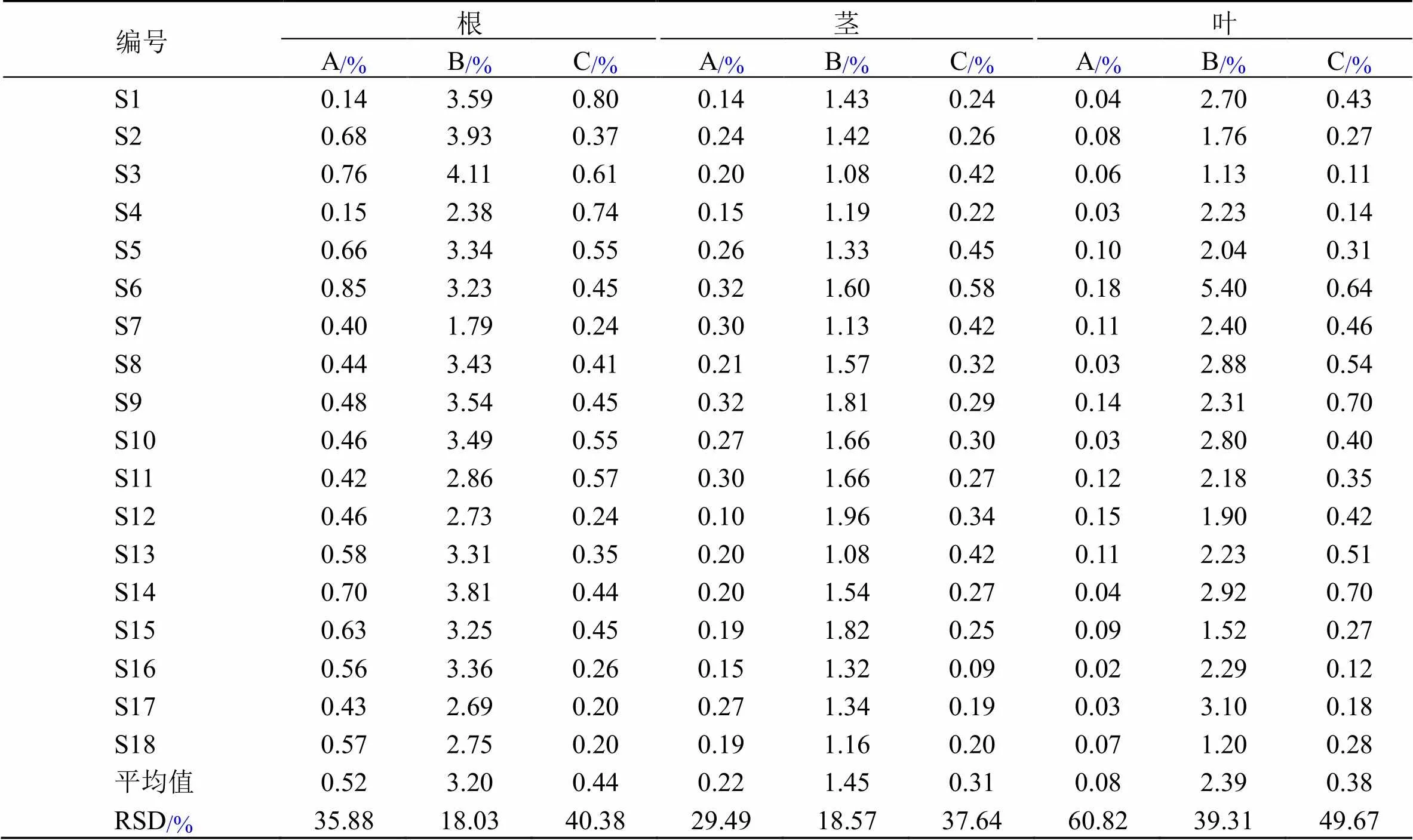
表3 川赤芍根、茎和叶中3种化学成分的含量测定结果
A-氧化芍药苷 B-芍药苷 C-1,2,3,4,6--五没食子酰葡萄糖
A-oxypaeoniflorin B-paeoniflorin C-1,2,3,4, 6--pentagalloylglucose
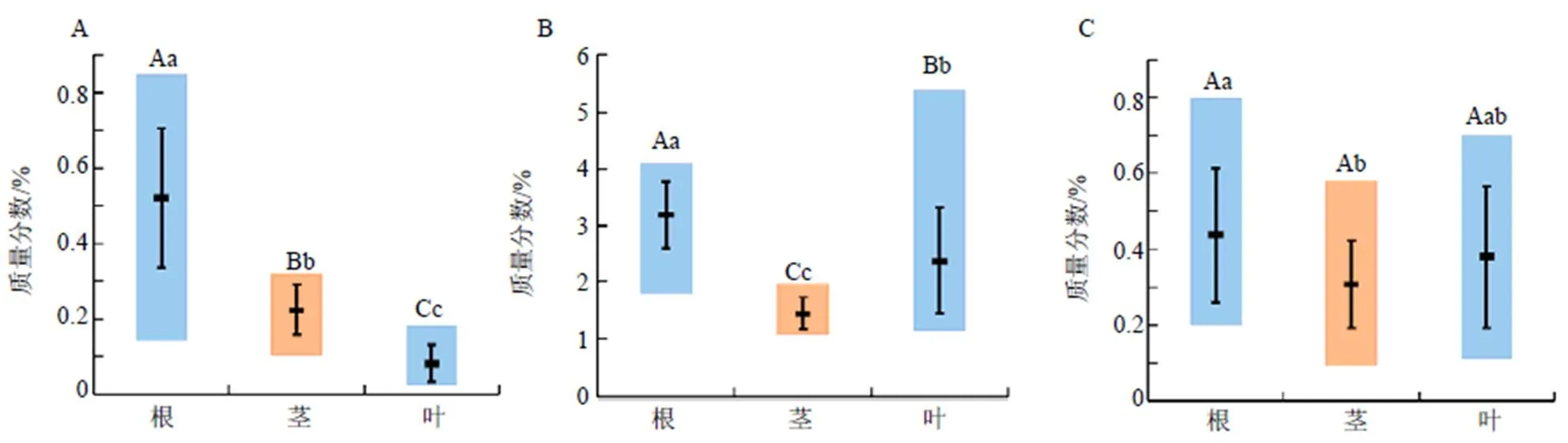
小写字母表示显著性α=0.05,大写字母表示显著性α=0.01
2.6 指纹图谱的建立与分析
中药化学成分种类繁多复杂,测定单一成分或几种成分很难表征其药材质量,因此本研究对18批川赤芍药材建立指纹图谱,从整体上分析其化学成分。2.6.1 指纹图谱的建立 按照“2.1”项下条件依次测定,“2.3”项下条件制备供试品,将18个产地的川赤芍UPLC数据以AIA格式导入2012版《中药色谱指纹图谱相似度评价系统》软件中,分别以G1、J1和Y1样品作为参照图谱,采用中位数法,时间窗宽度为0.5,经过多点校正后,进行色谱峰的匹配,分别生成川赤芍根、茎和叶指纹图谱叠加图(图3)。以5号峰作为对照峰,共确定17个共有峰,用对照品对所得色谱峰进行比对,共指认出3个峰,分别为氧化芍药苷(3号峰)、芍药苷(5号峰)、1,2,3,4,6--五没食子酰葡萄糖(10号峰)。
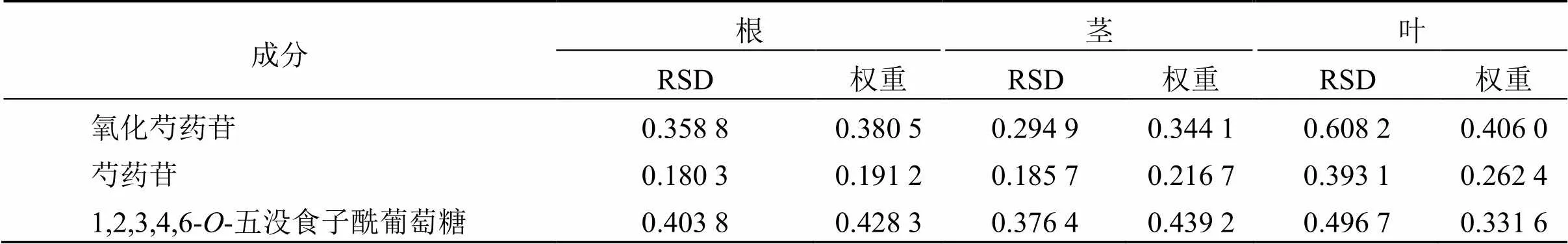
表4 3种成分的含量RSD与权重结果
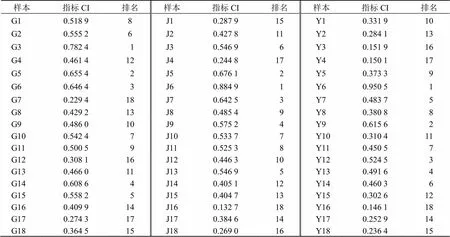
表5 川赤芍不同部位TOPSIS分析结果
G-根 J-茎 Y-叶,下同
G-root J-stem Y-leaves,same as below
2.6.2 相似度分析 分别对川赤芍根、茎和叶样品的指纹图谱与对照指纹图谱进行相似度评价(表6),结果显示,18批川赤芍根、茎和叶UPLC指纹图谱相似度系数相似度均在0.905之上,说明各产地产地川赤芍质量稳定。
2.6.3 主成分分析 采用SPSS 19.0软件,以17个共有峰(1~17)峰面积为变量,对川赤芍根、茎、叶样品进行主成分分析。参考文献报道[16-17],选取每个主成分因子最大荷载值10%范围内和最高Norm值10%范围内的指标进入品质指标评价的最小数据库集(minimum data set,MDS)。将18个产地川赤芍不同部位(根、茎、叶)样品的共有峰峰面积导入SPSS 19.0软件,对各共有峰峰面积进行标准化处理,计算主成分特征值、累积贡献率及主成分综合得分等[18]。
川赤芍各样品主成分因子载荷矩阵、公因子方差和Norm值见表7。川赤芍根样品各共有峰的公因子方差≥0.518(4的公因子方差最小,为0.518;11的公因子方差最大,为0.965),特征值>1的主成分有3个,且累积贡献率达84.262%,基本可以客观反映川赤芍根样本信息。选取共有峰2、10~17进入MDS,表明这些共有峰可以基本反映川赤芍根的品质信息。川赤芍茎样品各共有峰的公因子方差≥0.539(6的公因子方差最小,为0.539;15的公因子方差最大,为0.986),特征值>1的主成分有4个,且累积贡献率达88.975%,基本可以客观反映川赤芍茎样本信息。选取共有峰2、4、8~17进入MDS,表明这些共有峰可以基本反映川赤芍茎的品质信息。川赤芍叶样品各共有峰的公因子方差≥0.546(7的公因子方差最小,为0.539;11的公因子方差最大,为0.986),特征值>1的主成分有3个,且累积贡献率达87.922%,基本可以客观反映川赤芍叶样本信息。选取共有峰2、4、9~17进入MDS,表明这些共有峰可以基本反映川赤芍叶的品质信息。根据各样品主成分综合得分结果(表8),川赤芍根的综合得分排名为G17>G3>G2>G6>G16……G5>G13>G7,表明岗木达村(G17)、冷冷村(G3)、沙湾村(G2)、学海村(G6)、达日村(G16)这5个产地的川赤芍根样品质量较好。川赤芍茎的综合得分排名为J12>J6>J16>J8>J3…… J15>J10>J17,表明巴朗山(J12)、学海村(J6)、达日村(J16)、日都村(J8)、冷冷村(J3)这5个产地的川赤芍茎样品质量较好。川赤芍叶的综合得分排名为Y11>Y15>Y17>Y10>Y7……Y2>Y14>Y4,表明仁达村(Y11)、洞窝村(Y15)、岗木达村(Y17)、塔拖村(Y10)、小同村(Y7)这5个产地的川赤芍叶样品质量较好。
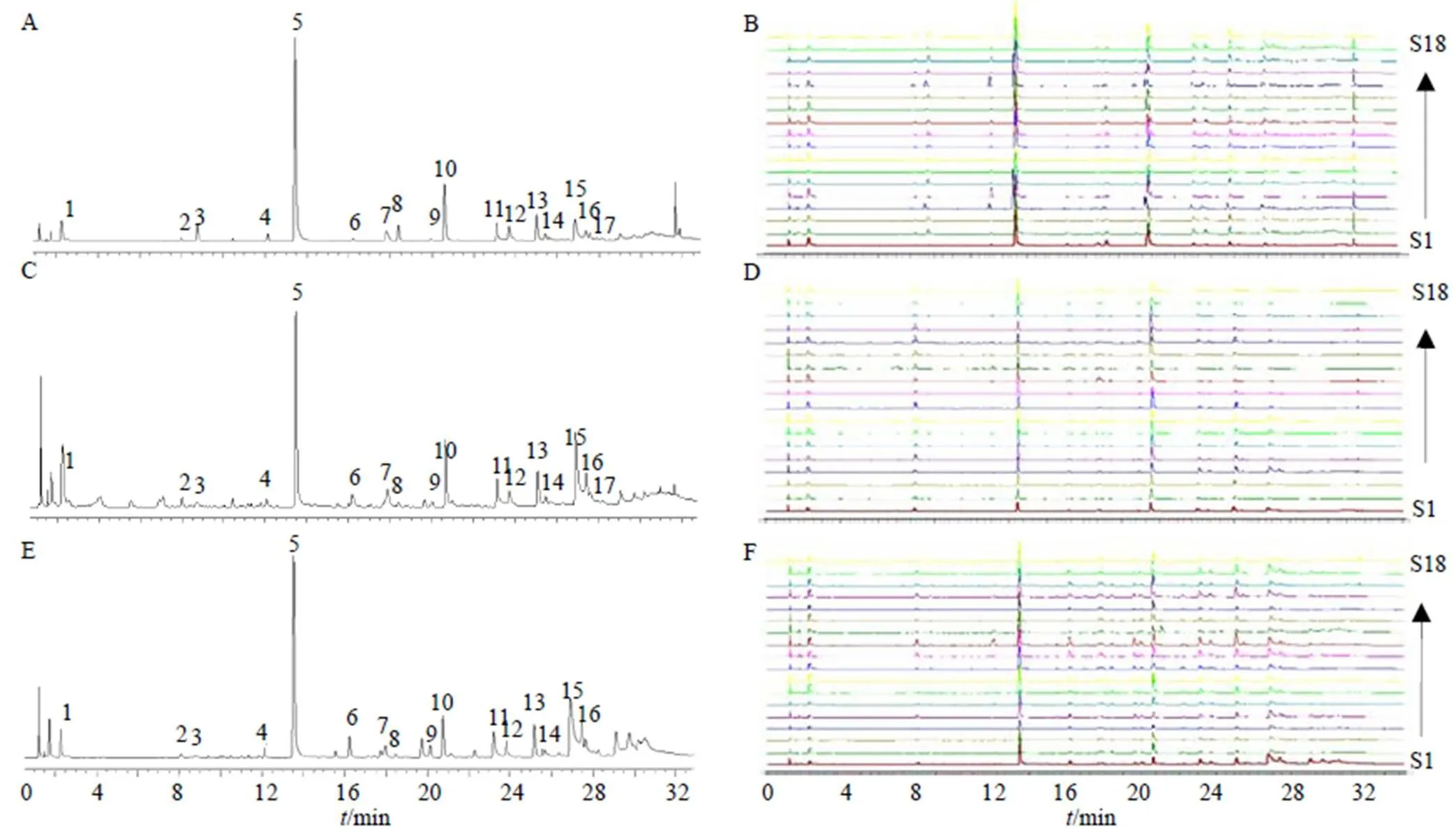
A-川赤芍根对照图谱 B-川赤芍根叠加图 C-川赤芍茎对照图谱 D-川赤芍茎叠加图 E-川赤芍叶对照图谱 F-川赤芍叶叠加图
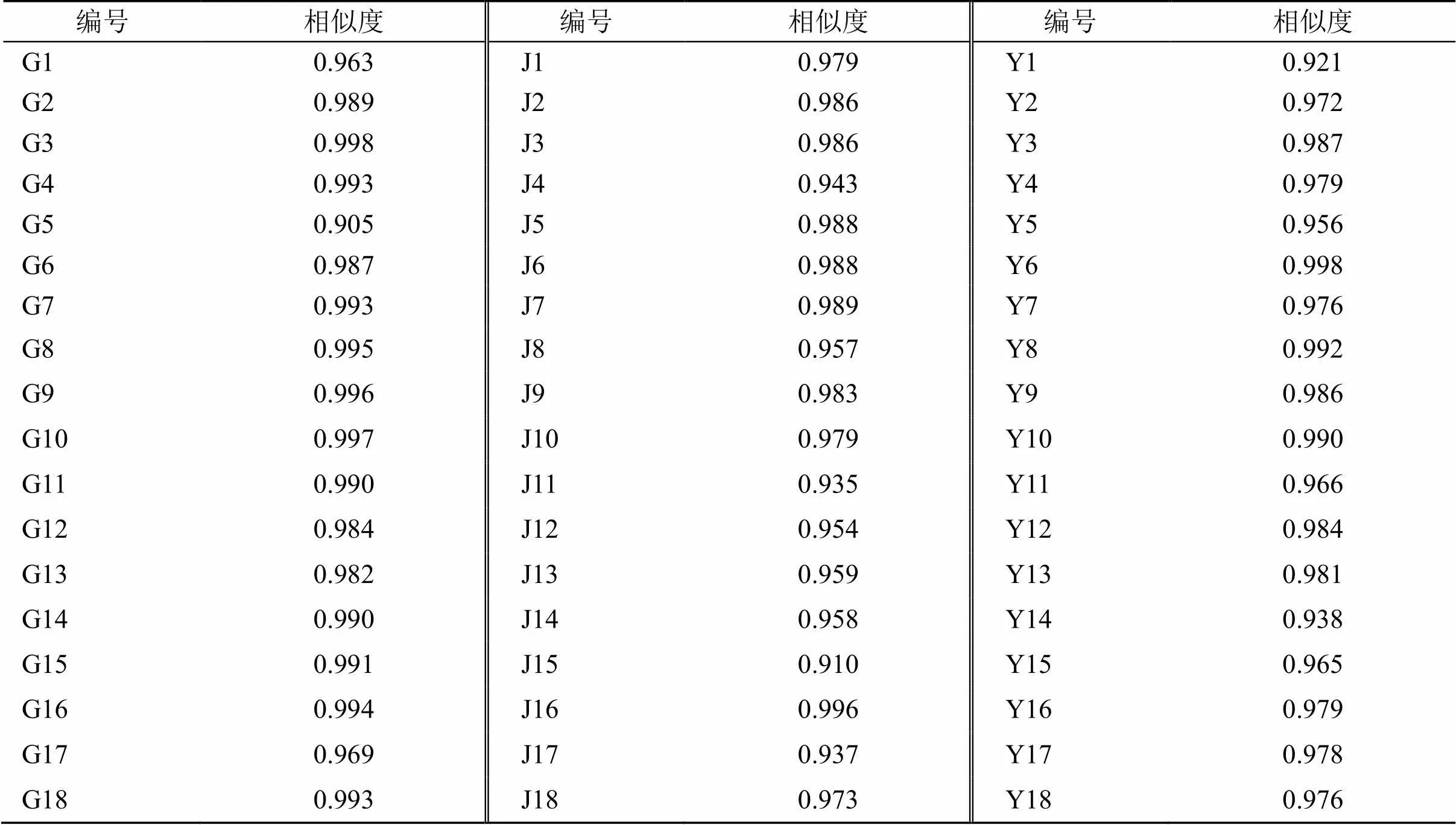
表6 18批川赤芍相似度结果
2.6.4 TOPSIS分析 根据川赤芍不同部位共有峰权重结果,将标准化的数据采用DPS软件进行TOPSIS分析[15],以共有峰面积做评价指标,根据最优值相对接近度(CI)排名(表8)。结果表明,14号川赤芍根样品质量最优、12号川赤芍茎样品质量最优、11号川赤芍叶样品质量最优。
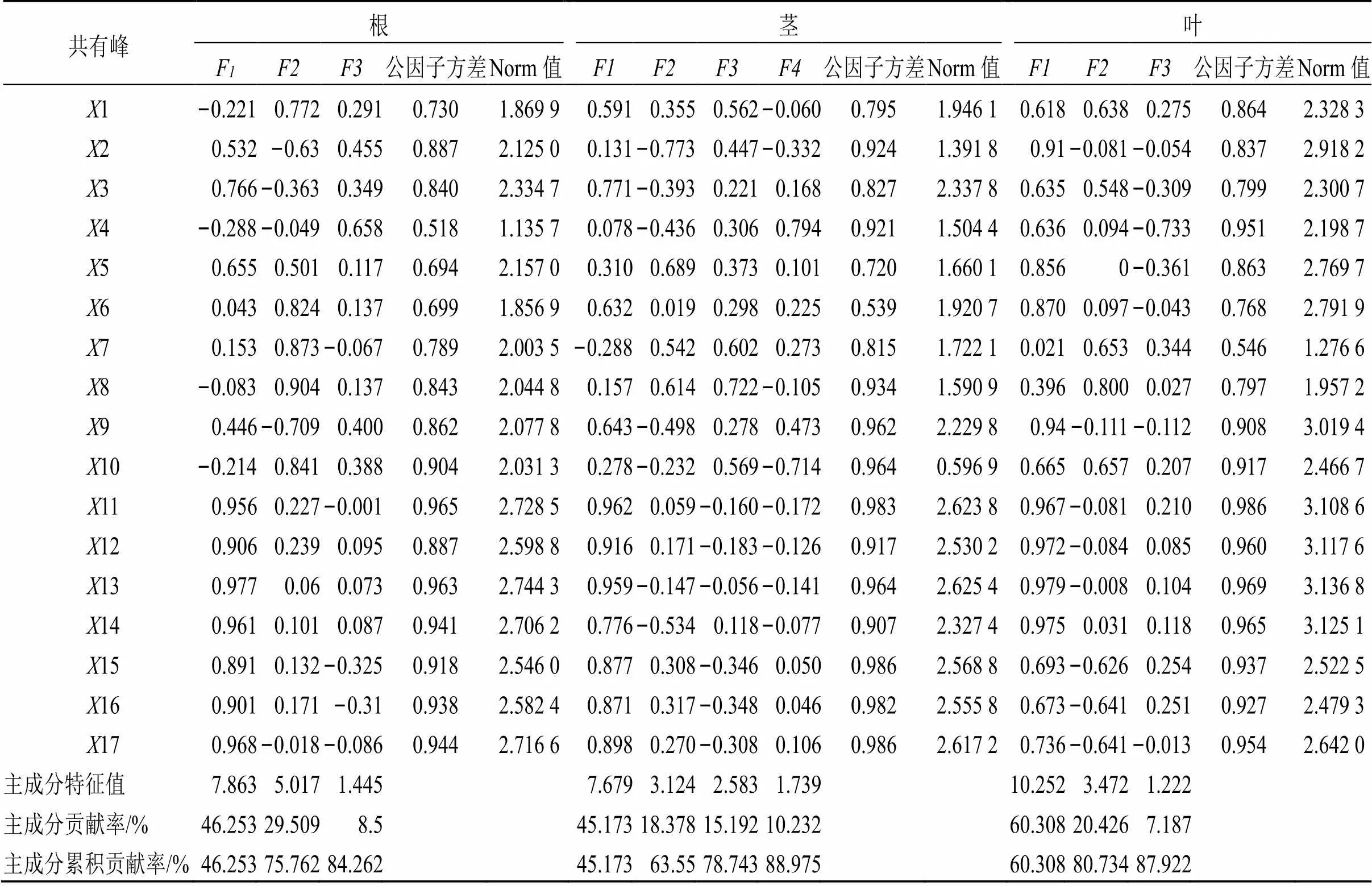
表7 川赤芍各部位样品主成分因子载荷矩阵、公因子方差和Norm值
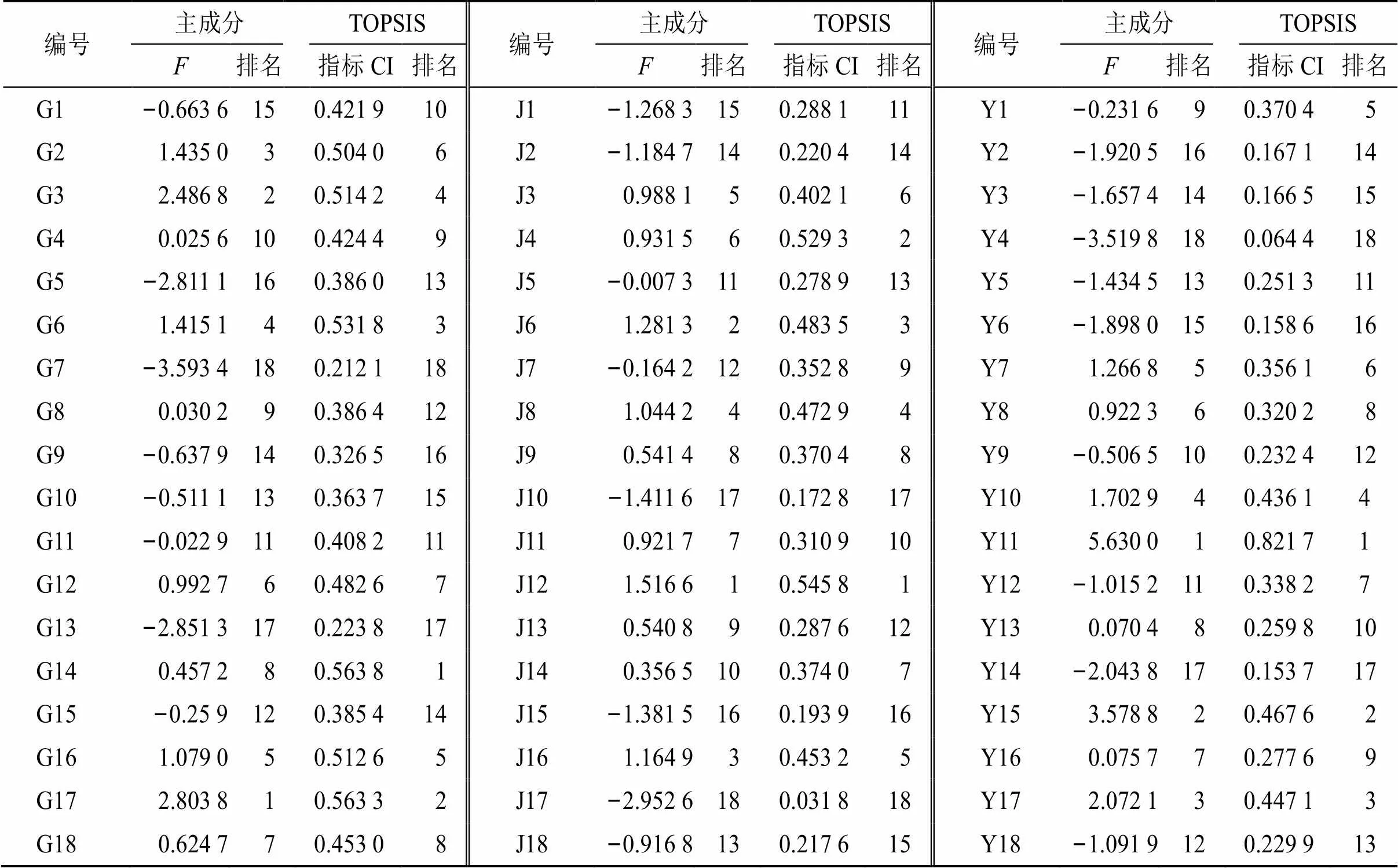
表8 川赤芍不同部位主成分分析与TOPSIS分析结果
2.6.5 偏最小二乘回归(PLS-DA)分析 为了进一步筛选引起不同产地川赤芍不同部位(根、茎、叶)质量特征差异的标志性成分,采用SIMCA 13.0软件对18批不同产地川赤芍不同部位(根、茎、叶)UPLC指纹图谱的原始数据进行PLS-DA分析,进而提取PLS-DA模型中17个变量的VIP值(图4),以变量的VIP>1作为评价标准,筛选引起不同产地川赤芍不同部位(根、茎、叶)质量差异的潜在化学成分[19]。筛选结果表明,川赤芍根样品色谱峰1、15、5、17、4等的VIP值大于1,说明这些峰所代表的成分是造成不同产地川赤芍根样品差异的主要标志性物质;川赤芍茎样品色谱峰12、15、16、17、11、5、13等的VIP值大于1,说明这些峰所代表的成分是造成不同产地川赤芍茎样品差异的主要标志性物质;川赤芍叶样品色谱峰5、7、1、15等的VIP值大于1,说明这些峰所代表的成分是造成不同产地川赤芍叶样品差异的主要标志性物质;其中5号峰为芍药苷,其他几个还有待鉴别。因此,芍药苷是影响产地差异的主要评价因素,这与药典选取芍药苷为指控标志相一致。
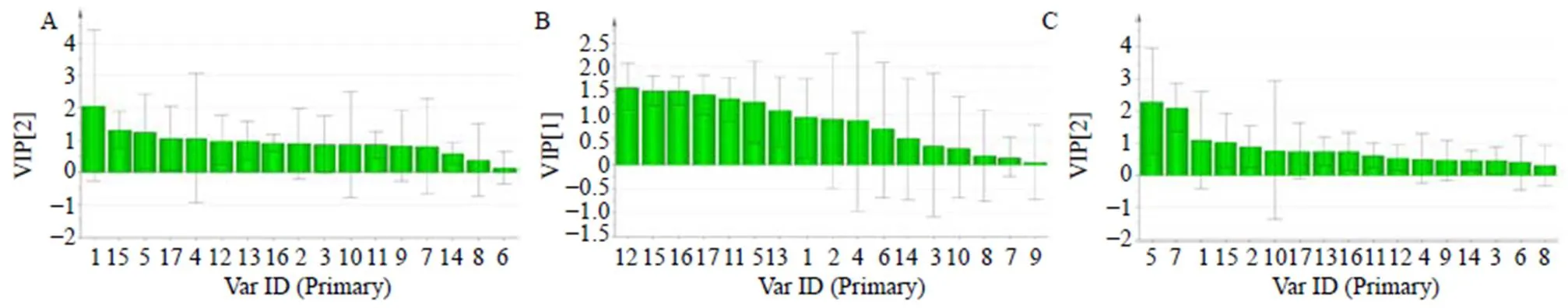
图4 川赤芍根(A)、茎(B)、叶(C) 的UPLC指纹图谱共有色谱峰的PLS-DA VIP值
3 讨论
本研究为了优化供试品制备的提取条件,分别考察了提取溶剂(甲醇、50%甲醇、乙醇、50%乙醇)、提取方法(回流提取法和超声提取法)、提取时间(30、45、60、75、90、120 min)、料液比(1∶10、1∶25、1∶50、1∶75)对提取效果的影响,确定最佳提取条件为:以甲醇为溶剂,超声提取75 min。建立的UPLC测定方法操作简单、准确可靠,精密度、稳定性和重复性良好。
川赤芍主要含有苷类和没食子酸及其衍生物两大类成分,具有镇静、镇痛、扩张血管、抗炎、抗溃疡、抗癌、抗糖尿病等生物学活性[20-24]。本研究所选芍药苷、氧化芍药苷、1,2,3,4,6--五没食子酰葡萄糖为川赤芍的主要活性成分,根据刘昌孝院士提出的质量标志物原则[25],以上3种成分均与川赤芍功能密切相关,同时可以定性鉴别和定量测定。因此,本研究选择以上3种成分作为质量标志物科学而合理,符合中医药研究理论。
综合多元统计分析结果,基于不同产地、不同部位川赤芍定量分析和指纹图谱,本课题组所建立的多元统计分析方法可用于提高川赤芍的质量控制和质量标准,可作为不同产地、不同部位中药材间的质量评价方法。
目前,川赤芍主要为生态脆弱的青藏高原野生资源,且分布范围广,尚未有人工栽培。本研究对不同产地川赤芍不同植物部位化学成分进行了比较。UPLC指纹图谱相似度评价结果显示,川赤芍各部位的化学成分极为相似,且茎和叶化学成分含量较接近,说明不同产地川赤芍根药材质量存在显著差异。《中国药典》2020年版规定川赤芍主要的入药部位为根,且以芍药苷含量作为主要质控指标。本研究结果表明,川赤芍根中芍药苷平均含量为3.20%,均符合药典规定。川赤芍茎和叶均含有芍药苷,其中叶中芍药苷平均含量高达2.19%,大部分达到药典规定;茎中芍药苷含量虽未达药典标准,但其含量可观。因此,建议在对川赤芍茎叶做进一步药效学研究,考虑是否可将川赤芍茎叶与根同等入药或者川赤芍的茎叶作为新的入药部位,综合有效利用已渐濒危之势的川赤芍野生资源。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 87.
[2] 陆小华, 马骁, 王建, 等. 赤芍的化学成分和药理作用研究进展 [J]. 中草药, 2015, 46(4): 595-602.
[3] 冀兰鑫, 黄浩, 李长志, 等. 赤芍药理作用的研究进展 [J]. 药物评价研究, 2010, 33(3): 233-236.
[4] 简在友, 王文全, 俞敬波. 赤芍野生资源调查及可持续利用技术途径探讨 [J]. 中国现代中药, 2010, 12(5): 10-11.
[5] 向楚兵, 刘友平, 陈鸿平, 等. 赤芍二基源药材的HPLC指纹图谱鉴别及质量评价 [J]. 中国实验方剂学杂志, 2011, 17(23): 43-48.
[6] 瞿领航, 曹国胜, 涂济源, 等. 基于灰色关联度与正交偏最小二乘法分析的苍术挥发油燥性谱效关系研究 [J]. 中草药, 2019, 50(1): 150-156.
[7] 徐珍珍, 史星星, 樊旭蕾, 等. 基于灰色关联度法和FCM算法的木香质量评价研究 [J]. 中草药, 2018, 49(24): 5916-5922.
[8] 聂磊, 胡震, 罗国安, 等. 中药指纹图谱的融合技术 [J]. 分析化学, 2005, 33(6): 898.
[9] 曹瑞竹. 木香顺气丸HPLC特征指纹图谱研究及多成分含量测定 [J]. 药物分析杂志, 2017, 37(6): 1127-1134.
[10] 黄萌萌, 唐颂豪, 陈彦, 等. 排石颗粒HPLC指纹图谱及化学模式识别分析 [J]. 中华中医药杂志, 2017, 32(6): 2768-2772.
[11] 李莉娜, 杨淑婷, 杨健, 等. 生芪消渴胶囊UPLC指纹图谱建立及6种成分含量测定 [J]. 中国新药杂志, 2018, 27(18): 2196-2202.
[12] 付士朋, 沈宏伟, 王谦博, 等. 指纹图谱结合灰色关联度分析法对不同产地赤芍质量的评价研究 [J]. 中草药, 2019, 50(23): 5865-5871.
[13] 孙冬梅, 陈秋谷, 毕晓黎, 等. 二基原赤芍HPLC指纹图谱的建立和5种成分的含量测定 [J]. 中药材, 2018, 41(4): 898-903.
[14] 向楚兵, 刘友平, 陈鸿平, 等. 赤芍二基源药材的HPLC指纹图谱鉴别及质量评价 [J]. 中国实验方剂学杂志, 2011, 17(23): 43-48.
[15] 杨正明, 刘哲, 邓秋林, 等. 四川道地产区江油附子和川乌中4种核苷类成分含量测定及多元统计分析 [J]. 中草药, 2018, 49(23): 5657-5664.
[16] 吴玉红, 田霄鸿, 同延安, 等. 基于主成分分析的土壤肥力综合指数评价 [J]. 生态学杂志, 2010, 29(1): 173-180.
[17] 杨正明. 川产道地药材江油附子和川乌品质及其与土壤养分相关性研究 [D]. 雅安: 四川农业大学, 2019.
[18] 张文霖. 主成分分析在SPSS中的操作应用 [J]. 市场研究, 2005(12): 31-34.
[19] 陶晓赛, 龚海燕, 谢彩侠, 等. 基于UPLC指纹图谱结合化学计量学评价不同产地盾叶薯蓣药材质量 [J]. 中草药, 2021, 52(1): 227-233.
[20] 张晔, 文继红. 芍药苷抗抑郁作用及机制的实验研究进展 [J]. 云南中医中药杂志, 2018, 39(12): 78-81.
[21] 李惠晨, 胡伟, 丁井永. 五没食子酰基葡萄糖抗肿瘤的作用研究进展 [J]. 现代肿瘤医学, 2014, 22(9): 2255-2258.
[22] 张建博, 谢雨, 杨浩然, 等. 五没食子酰基葡萄糖治疗2型糖尿病及其并发症药效机制研究进展 [J]. 药学研究, 2015, 34(6): 344-348,352.
[23] Wang D, Tan Q R, Zhang Z J. Neuroprotective effects of paeoniflorin, but not the isomer albiflorin, are associated with the suppression of intracellular calcium and calcium/calmodulin protein kinase II in PC12 cells [J]., 2013, 51(2): 581-590.
[24] Hino H, Takahashi H, Suzuki Y,. Anticonvulsive effect of paeoniflorin on experimental febrile seizures in immature rats: Possible application for febrile seizures in children [J]., 2012, 7(8): e42920.
[25] 刘昌孝, 陈士林, 肖小河, 等. 中药质量标志物(Q-Marker): 中药产品质量控制的新概念 [J]. 中草药, 2016, 47(9): 1443-1457.
Comprehensive evaluation on quality of different habitats and parts ofbased on UPLC fingerprint and multicomponent determination
ZHONG Hai-rong1, ZHANG Shao-shan2, 4, XIAO Fang1, HAILAI Yue-bu1, QUBIE Jun-zhang1, LI Yi-song1, YANG Zheng-ming2, 4, LIU Yuan3, 4
1. College of Pharmacy, Southwest Minzu University, Chengdu 610041, China 2. Institute of Qinghai-Tibetan Plateau, Southwest Minzu University, Chengdu 610041, China 3. Ethnic Medicine Institute, Southwest University for Nationalities, Chengdu 610041, China 4. Sichuan Provincial Qiang-Yi Medicinal Resources Protection and Utilization Technology and Engineering Laboratory, Chengdu 610225, China
To determine the content of paeoniflorin, oxypaeoniflorin and 1,2,3,4,6--pentagalloyl glucose in different parts of 18 batches ofand establish an UPLC method for the fingerprint analysis to make a comprehensive analysis on the overall distribution and the differences of the main chemical components in different parts based on the multivariate statistical analysis, which was used to evaluate the medicinal materials quality of.The separation was performed on a chromatographic Diamonsil C18column (100 mm×2.1 mm, 1.8 μm), with acetonitrile-0.1% phosphoric acid as the mobile phase for gradient elution. Column temperature was 30 ℃. Volume flow rate was 0.2 mL/min. Injection was 1 μL and the detection wavelength was 230 nm. The fingerprints were established and evaluated by the Similarity Evaluation System of TCM (version 2012). Difference analysis, similarity analysis (SA), principal component analysis (PCA), TOPSIS analysis, and orthogonal partial least squares-discriminant analysis (OPLS-DA) were used to comprehensively evaluate the quality of.According to the content determination results, the content of oxypaeoniflorin inwas as follows: root>stem>leaf, and the content of paeoniflorin, 1,2,3,4,6--pentagalloyl glucose was as follows: root>leaf>stem. Among them, the content of paeoniflorin in root samples was more than 1.8%, which was in line with the provisions of the 2020 edition of China Pharmacopoeia. The content of paeoniflorin in stems and leaves was close to that of in roots. In this study, the UPLC fingerprint of roots, stems and leaves was established, a total of 17 common peaks were identified, and three common peaks (paeoniflorin, paeoniflorin, 1,2,3,4,6--pentagalloyl glucose) were identified. The results of similarity evaluation showed that the similarity of roots, stems and leaves offrom different habitats was good and the quality was stable.Fingerprint could effectively evaluate the quality offrom different habitats. Based on the quality control index of paeoniflorin (C23H28O11) in the 2020 edition of the China Pharmacopoeia, the content of paeoniflorin in the stems and leaves ofwas similar to that of in the roots, this study provided relevant theoretical basis for the comprehensive evaluation of the quality ofand the development of new medicinal parts.
Lynch; fingerprints; oxypaeoniflorin; principal component analysis; quality evaluation; resource development
R286.2
A
0253 - 2670(2021)07 - 2062 - 10
10.7501/j.issn.0253-2670.2021.07.023
2020-08-09
国家重点研发计划(2018YFC1708005);四川省科技农村领域重点研发(2019YFN0089);中央高校基本科研业务费专项资金研究类项目(2020NGD01)
钟海蓉(1994—),女,在读硕士,主要从事民族药品种、品质评价及新药资源开发与利用研究。Tel: 18328092180 E-mail: 392009773@qq. com
杨正明,助理研究员,主要从事民族药资源品质评价及其生理生态与栽培研究。Tel: (028)85528812 E-mail: 790721918@qq.com
刘 圆,教授,博士生导师,从事民族药品种、品质评价及新药资源开发与利用研究。Tel: (028)85528812 E-mail: 499769896@qq.com
[责任编辑 时圣明]
