施用生物炭对分次施氮砖红壤N2O 排放的影响*
2021-04-07潘凤娥伍延正何秋香柯用春
曹 明,潘凤娥,伍延正,孟 磊,何秋香,柯用春
(1.三亚市南繁科学技术研究院,海南 三亚 572000;2.海南大学 热带作物学院,海南 海口 570228)
作为重要的温室效应气体,N2O 增温潜势巨大[1],此外,N2O 还能消耗臭氧层中的臭氧,引起臭氧层“空洞”[2]。N2O 排放主要来自农田和热带土壤[1]。为获得作物高产,投入的大量氮肥加剧了海南农田土壤N2O 排放[3]。有研究结果表明:生物炭施入海南土壤,能中和土壤酸性,显著提高土壤pH,同时增加土壤碳氮含量[4-5]。此外,许多研究发现:生物炭分别添加到海南代表性地带性土壤砖红壤及燥红土中能显著促进硝化作用,降低N2O 排放[5-8]。因此,生物炭应用于热区土壤,既有助于土壤质量提升,又能实现N2O 减排。大量研究表明:除了田间试验和培养试验的条件不同外,例如温度和降雨等,添加生物炭对N2O 排放的抑制效果往往要低于培养试验的结果[9];另一个重要的差异是培养试验大部分为添加生物炭后一次性施肥的结果[6-8],而田间条件下的N2O 排放是以整个作物生长季进行计量[10-11],明确添加生物炭后分次施肥对土壤N2O排放的影响,能够更好地阐明生物炭对热区土壤N2O 的减排效果及机理。
因此,通过室内培养试验,研究添加生物炭对先后2 次施氮后砖红壤性质及N2O 排放的影响,可为正确评价生物炭对N2O 减排效应及生物炭合理应用提供理论依据。
1 材料与方法
1.1 供试材料
试验用土壤为采自海南西北部花岗岩母质发育而来的砖红壤,地理坐标为E109°29′,N19°30′。采集0~20 cm 土壤带回实验室,除去植物根及砾石,风干后过2 mm 筛备用。土壤理化性质为:土壤pH 为4.88,有机碳含量6.07 g/kg,全氮含量 0.58 g/kg,碱解氮含量86.92 mg/kg,速效磷含量43.94 mg/kg,速效钾含量92.65 mg/kg,阳离子交换量(CEC)含量3.40 cmol/kg。
供试生物炭为玉米秸秆在400 ℃裂解制备,其pH 为8.66,碳含量为636.45 g/kg,氮含量为17.32 g/kg。生物炭粉碎过2 mm 筛后备用。
1.2 试验设计
按生物炭与烘干土质量比的0、1%和2%添加生物炭,分别记作CK、B1和B2。称取200.00 g 土(以烘干土计)置于烘干大烧杯内,按比例加入生物炭,混合均匀后转移到250 mL锥形瓶内,调节土壤水分40%田间持水量后,置于25 ℃恒温箱中预培养7 d。随后将尿素溶于水中,按m(N)∶m(干土)=150 mg∶1 kg 比例,均匀加入土壤中,补充水分至75%田间持水量后,将锥形瓶放入30 ℃恒温培养箱内继续培养。培养至180 d,第2 次加入尿素,方法同第1 次。整个培养过程中,锥形瓶口用扎孔的保鲜膜封住,用称重法维持土壤水分恒定。每处理设置6 个重复,3 个重复进行采集气体,另外3 个重复用于土壤NH4+、NO3-及pH 等的测定。
1.3 气体采样及测定方法
加尿素后的第1、2、4、6、8、11、15、19、23、27、31、35、40、45、50、55 和60 天采集气体进行N2O 分析。采样前,用高纯空气向锥形瓶内吹数分钟,随后将硅胶塞和704 胶密封瓶口。密封开始及40 min 后,分别用10 mL 注射器通过三通阀采集瓶内气体,直接注入气相色谱仪(岛津GC-2014)测定N2O 排放量。
1.4 土壤指标测定方法
分别在每次加尿素的第7、14、19、23、28、45、49、55 和60 天进行土壤NH4+、NO3-含量测定。待测土壤用2 mol/L KCl 进行浸提(液土质量比5∶1),滤液中NH4+-N 含量采用靛酚蓝比色法(625 nm)测定,NO3--N 含量采用双波长(220 nm 和275 nm)紫外分光光度法测定。
每一阶段培养结束后,取土测定其他理化性质,参考《土壤农业化学分析方法》[12]。pH 采用电位法(水土质量比2.5∶1)测定;有机碳用重铬酸钾—硫酸消化法测定;土壤总氮用半微量凯氏定氮法测定;速效磷用钼蓝比色法测定;速效钾采用火焰光度计测定;阳离子交换量用乙酸铵交换—蒸馏法测定。
1.5 数据计算及处理
N2O 排放通量和排放总量参照参考潘凤娥等[8]的方法计算。数据分析与处理采用Microsoft Excel 2010 和SPSS 19.0 (处理间差异比较采用Duncan 多重比较),作图采用Origin 2016。
2 结果与分析
2.1 添加生物炭对土壤理化性质的影响
如表1 所示:土壤有机碳和全氮含量随生物炭添加量增加而增加,尤其是有机碳,不同生物炭添加量处理间差异达到显著水平(P<0.05)。同一处理下,培养到60 与225 d 时的土壤有机碳和全氮含量的差异不显著。相较于培养前土壤pH值,施氮对土壤有明显的酸化作用。如CK、B1和B2第1 次加氮培养60 d 后,土壤pH 分别为4.10、4.25 和4.66,第2 次施氮培养到225 d 时,各处理降至3.70、3.72 和4.38。添加高量生物炭的土壤pH 显著高于CK (P<0.05),表明生物炭能缓解施氮对土壤的酸化作用,且该作用效果较长。生物炭添加亦可显著提高土壤有效磷和速效钾的含量(P<0.05),生物炭用量越多,增加幅度越大。同时,添加生物炭能提高土壤阳离子交换量(CEC),而同一处理第2 次施氮降低了土壤CEC。
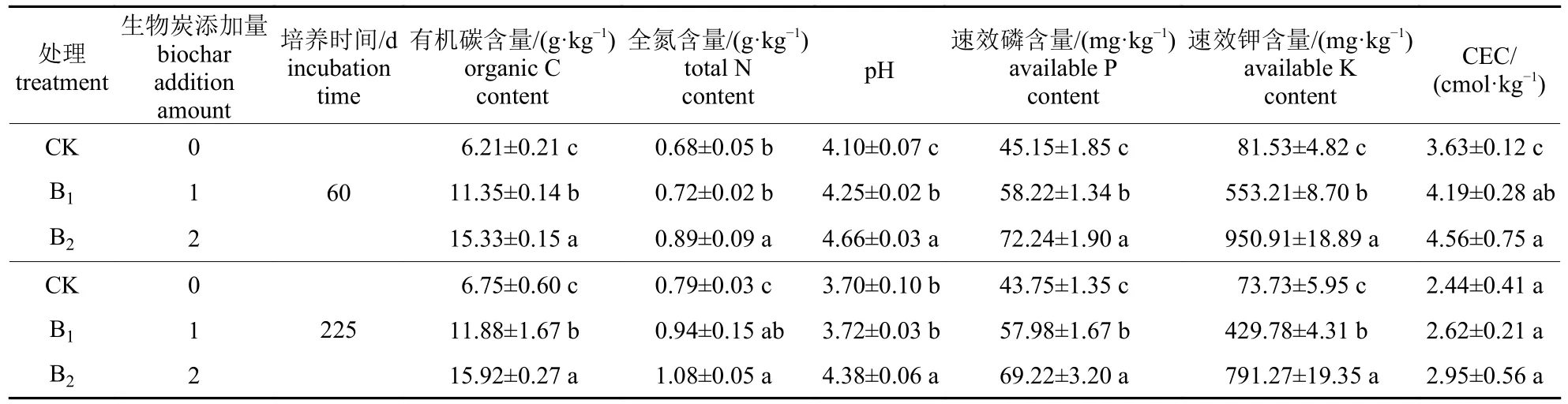
表1 土壤培养第60 和225 天时基本理化性质Tab.1 Soil basial physio-chemical properties of different treatments at 60th day and 225th day in the incubation study
2.2 添加生物炭对土壤矿质氮含量的影响
2 次施氮后,土壤NH4+-N 变化趋势有较大差异(图1)。第1 次施氮,土壤起始NH4+-N 含量最高,随后逐渐降低。培养到第60 天时,B1和B2处理的土壤NH4+-N 含量已分别降至1.32 mg/kg和0.32 mg/kg,显著低于CK (P<0.05)。CK 处理的NH4+-N 含量始终高于生物炭处理,但B1和B2处理之间的NH4+-N 含量差异不显著。第2 次施氮时,随着培养时间增加,土壤NH4+-N 含量先增加到峰值,后逐渐降低。添加生物炭能显著缩短NH4+-N 含量起峰时间,生物炭用量越多,其用时越少。升高过程中,NH4+-N 含量大小表现为B2>B1>CK,降低过程则相反。
土壤NO3--N 含量变化不同于NH4+-N,且前后2 次施氮后的变化趋势也存在差异(图1)。第1 次施肥后,所有处理土壤NO3--N 含量均快速增加,后逐渐放缓;在45~50 d 后,生物炭处理出现下降。NO3--N 含量在快速上升期时处理间差异不明显,而在缓慢增长期时处理间差异增大,土壤NO3--N 含量大小为B2>B1>CK。第2 次施氮培养,初始土壤NO3--N 含量均处于较高水平。随后,添加生物炭土壤NO3--N 含量缓慢上升,最后趋于稳定,而CK 则略有下降,而后趋于稳定,到后期又略有升高。但CK 处理NO3--N 含量低于添加生物炭处理,而B1和B2处理间NO3--N 含量相当。
2.3 添加生物炭对土壤N2O 排放速率的影响
由图2 可知:第1 次施氮后,各处理N2O 排放速率变化趋势基本一致。表现为初始缓慢增加,处理之间无差异,第10 天迅速上升,处理之间差异显著(P<0.05)。至第19 天,各处理N2O排放均达到峰值,且峰值差异显著(P<0.05),峰值N2O 含量大小为CK>B1>B2。达到峰值后,土壤N2O 排放速率开始下降。第41 天时,B1和B2的N2O 排放速率接近0,而CK 的排放速率仍达到1.25 μg/(kg·h)(按N2O-N 的量计,下同) 直到第60 天,CK 才降为0.002 μg/(kg·h)。
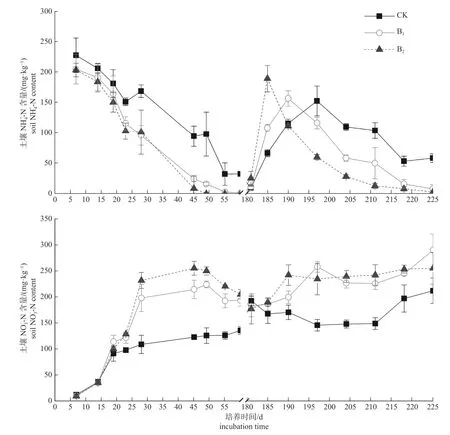
图1 各处理土壤NH4+-N 和NO3--N 含量变化Fig.1 The dynamic of NH4+-N and NO3--N contents of each treatment
培养到第180 天时进行第2 次施氮,土壤N2O排放速率变化与第1 次施氮后有所不同(图2)。CK 处理N2O 排放速率相对稳定,一直维持在较低排放水平[低于0.1 μg/(kg·h)]。B1和B2土壤N2O 排放速率则缓慢上升。但相较于第1 次施氮后的N2O 排放,B1和B2的峰值下降明显,且较快达到峰值,如B1在施氮后13 d 已达到峰值[0.78 μg/(kg·h)],B2在第8 天时已达到峰值[0.98 μg/(kg·h)]。其后,B1和B2的N2O 排放速率缓慢下降,施氮27 d 后,降到与CK 一致水平。
2.4 添加生物炭对土壤N2O 累计排放量的影响
第1 次施氮后,B1和B2处理60 d 内土壤N2O累积排放量分别较CK 降低了65.96%和89.22%,且B1和B2间存在显著差异(P<0.05)。第2 次施氮的结果与第1 次相反,即添加生物炭促进了N2O 排放。B1和B2的N2O 累积排放量分别较CK 提高202%和407%,且B1和B2处理间差异显著(P<0.05)。综合2 次施氮后N2O 排放总量,相较于CK,B1和B2的N2O 排放总量的降幅分别为54.34%和70.40% (表2)。
3 讨论
生物炭含有大量碳和一定量的氮,施入土壤相应增加了土壤碳和氮含量[4-5]。生物炭能提高土壤pH,源于其含有大量的碱性物质,如碳酸盐等[13]。生物炭施入酸性土壤,中和土壤酸度,显著提高土壤pH[4-5]。在一定pH 范围内,pH 值与土壤有效磷呈显著正相关[14]。此外,生物炭含有盐基离子,施入土壤能丰富其养分含量[15]。例如,生物炭表面富含羧基、羰基等官能团能改善磷和钾供应[16],生物炭施于土壤中,也能显著提高CEC。
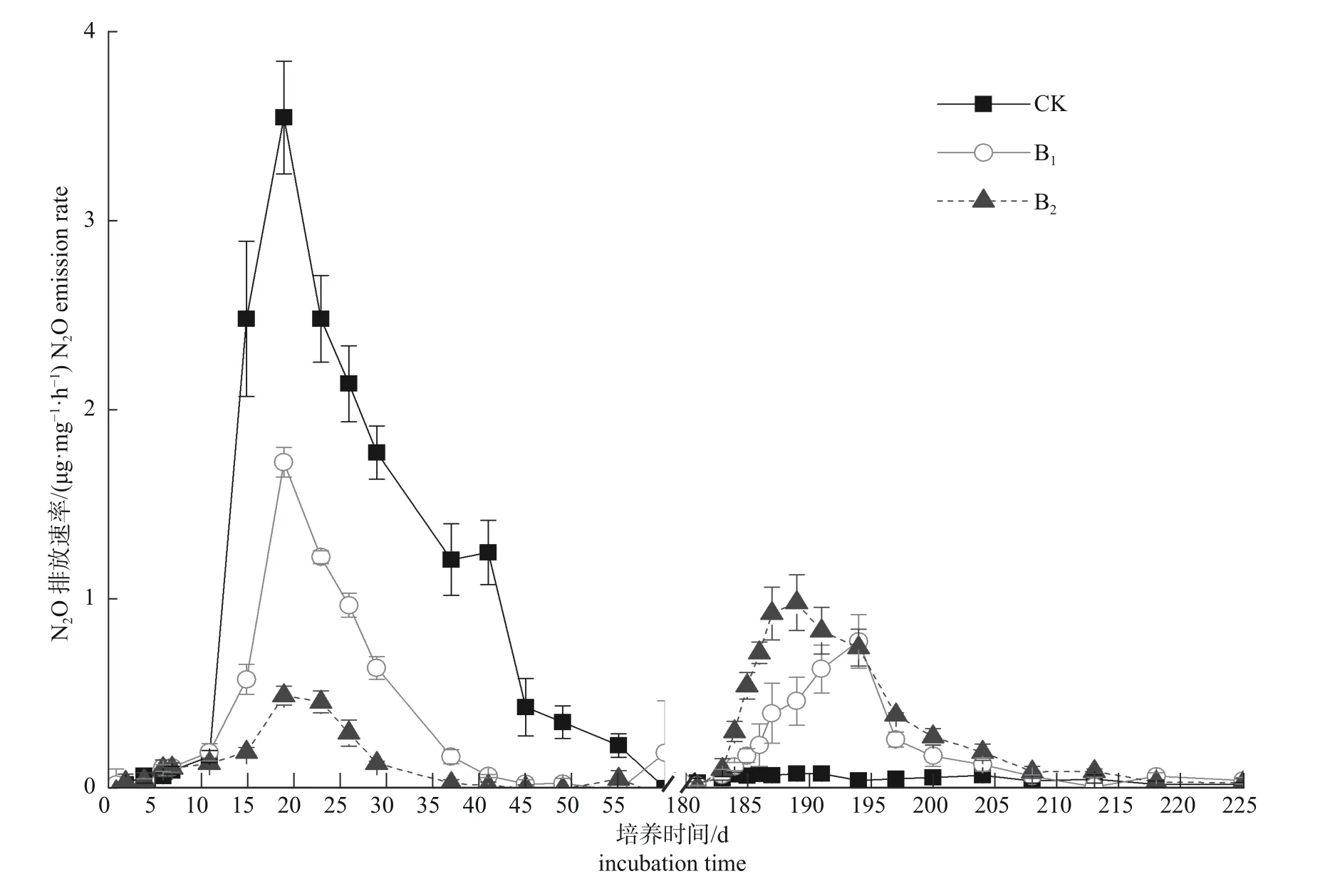
图2 不同处理对土壤添加尿素后N2O 的排放速率(按N2O-N 的量计)的影响Fig.2 Effects of different treatments on the emission rates of N2O (in terms of N2O-N amount)in soil after urea fertilizer addition

表2 不同处理对土壤N2O 累积排放量(按N2O-N 的量计)的影响Tab.2 Effects of different treatments on the cumulative emissions of N2O (in terms of N2O-N amount) in soil
生物炭虽能显著减少土壤N2O 总排放量,但比较前后2 次施氮土壤N2O 排放总量发现:生物炭仅大幅度降低第1 次施氮后的N2O 排放,却促进了第2 次施氮后的N2O 排放(表2)。季雅岚等[7]研究发现:300 ℃下制备的生物炭明显促进N2O 排放,500 和700 ℃等较高温度制备的生物炭则显著降低N2O 排放。可能是低温制备的生物炭含有大量易分解物质[17],能消耗土壤O2,而利于N2O 生成。高温制备的生物炭稳定性强,具有较大的比表面积和较强的物理吸附性[17],具有吸附N2O 的能力。此外,较高热解温度制备的生物炭可能导致土壤孔隙率增加,抑制厌氧反硝化过程[18],最终有效抑制土壤N2O 的产生。但CASE等[19]认为:生物炭尽管能增加土壤孔隙度,改善土壤通透性,但对N2O 减排贡献并不大,添加生物炭增加土壤的物理和生物吸附,造成参与N2O反应底物量的减少,才是N2O 减排的原因。土壤CEC 值反映了土壤阳离子吸附状况。B1和B2土壤CEC 相对于CK 分别增加了0.56 cmol/kg 和0.93 cmol/kg (表1),尽管其中可能有生物炭施入带入的盐基离子,但施入尿素水解产生大量NH4+可利用质量效应占据的吸附位点,从图1 中可大概反映出CK 与B1、B2的NH4+-N 含量差异在20~50 mg/kg 之间,但生物炭用量差异没有显著造成该部分吸附氮的差异。WANG 等[20]将花生壳炭添加到酸性土壤中,发现能降低酸性土壤的硝化作用,源于花生壳生物炭中含有的酚类化合物能抑制氨氧化细菌(AOB)数量,从而阻止了产N2O 过程的进行,实现了N2O 减排,但该结果不能用于解释本试验。尽管生物炭可以吸附大量的NH4+,从图1 第1 次施肥后土壤NH4+-N 和NO3--N含量的变化可推断出生物炭施用于砖红壤中,能显著促进硝化作用。可能是生物炭添加改善了影响硝化作用的pH[21],使得其适于硝化微生物生长,最终使得添加生物炭的土壤NH4+转化为NO3-的效率增高。B1和B2处理在第1 次施肥后,土壤NH4+-N 含量低于CK 处理;B1和B2土壤NO3--N含量显著高于CK 处理,而B2又显著高于B1处理(图1)。生物炭可增加土壤氨氧化菌数量,促进土壤硝化过程及N2O 产生[22]。同时,生物炭与提升亚硝酸还原酶基因(nirK),氧化亚氮还原酶基因(nosZ)等反硝化基因数量有关,如果土壤局部区域存在反硝化作用,便可将N2O 继续还原为N2[23],由此降低N2O 排放。本试验的土壤水分也适合于反硝化过程发生,从而导致第1 次施氮后实现了生物炭减排N2O 的现象。
本研究也证实土壤施氮后出现明显酸化。如第1 次施氮采气结束后,CK、B1和B2土壤pH 由初始的4.88 分别降至4.10、4.25 和4.66,第2 次施氮采气结束时,土壤pH 继续降至3.70、3.72 和4.38 (表1)。原因在于酸化产生的H+占据了本来应该吸附NH4+的吸附位点[24],降低了生物炭对NH4+的吸附量,使得第2 次施氮培养结束后,生物炭添加与否都没有造成土壤CEC 差异(表1)。而添加生物炭能明显缓解酸性土壤的pH下降[25]。pH 在3.4~8.6 范围时,土壤硝化作用强度随pH 升高而增强[26]。添加生物炭土壤的pH 高于CK (表1),因此土壤硝化作用强度高于CK,由此土壤NH4+大都能通过硝化作用转化为NO3-。正是由于添加生物炭土壤参与硝化过程中的NH4+量高于CK,才使得其N2O 排放高于CK。添加生物炭越多,缓解酸性程度越大。B2酸化的程度弱于B1,使得B1硝化程度低于B2,导致B1土壤中存留的部分NH4+不能被硝化,由此造成B2的N2O 排放高于B1(图1)。
第1 次施氮采气结束后土壤中已存在大量NO3-,而第2 次施氮继续培养后土壤硝态氮却并未明显提升(图1)。早在20 世纪80 年代的研究已发现:有氧条件下可发生好氧反硝化作用,参与微生物因具有周质硝酸盐还原酶(Nap)而对氧不敏感,能在好氧条件下发生反硝化作用,其影响因素主要包括土壤有机质和NO3-含量。本研究中第1 次施氮提供了大量NO3-,尤其B1和B2处理(图1),生物炭添加又相应增加了土壤有机质(表1),因此营造了利于好氧反硝化发生的条件而促进该作用的进行。同时该条件下硝化—反硝化作用可以耦合发生,被认为是氮损失的最主要途径[27-28]。第2 次施氮后可利用的有机碳可能少于第1 次,加之pH 值也低于第1 次,由此降低了氧化亚氮还原酶的活性,使产生的N2O 不易被还原为N2[29]。同时由于好氧硝化和反硝化作用增加,导致第2 次施氮后添加生物炭土壤具有促进土壤N2O 排放的效果。
4 结论
生物炭能显著提高土壤有机碳和氮含量,缓解土壤酸化,增加土壤速效磷和速效钾的含量,增强土壤保肥性能。但施入生物炭对先后2 次施氮后N2O 排放的影响存在差异。第1 次施氮,生物炭促进了反硝化作用,加速N2O 向N2转化,表现为减排;第2 次施氮,生物炭缓解了土壤酸化,导致更多NH4+参与硝化作用,减缓N2O 转化为N2,表现为增排。综合2 次施氮后N2O 排放情况,生物炭实现了土壤N2O 总量减排。
