多替拉韦钠有关物质的合成与表征
2021-04-07樊印波王忠美王世辉
樊印波,王忠美,李 翔,王世辉*
(1.宁波诺柏医药有限公司,浙江 宁波 315000;2.浙江朗华制药有限公司,浙江 台州 318000)
HIV-1 整合酶抑制剂是治疗HIV/AIDS 的一项重要手段。其中,多替拉韦钠(1,图1)具有高效的抗病毒活性以及抗耐药性[1-2],自2013 年被美国FDA 批准上市以来,多替拉韦钠以其显著的治疗效果得到广泛的应用。多替拉韦钠具有多官能团的三环母核结构,因此在其制备过程中需要较长的合成路线及纯化策略。本研究重点介绍了多替拉韦钠制备过程中一系列关键杂质的合成及表征,并对杂质的传递情况进行了分析。

图1 多替拉韦钠的化学结构式Fig.1 Chemical structure of dolutegravir sodium
1 多替拉韦钠合成路线
采用多替拉韦钠原研公司的专利工艺路线[3-4],如图2 所示。起始物料2 在甲磺酸催化下缩醛水解得到中间体3,加入过量的氨基丁醇中和催化量的甲磺酸,同时进行环合反应,立体选择性地生成三环结构骨架化合物4。4 与CDI 活化经活性中间体5,再与2,4-二氟苄胺缩合反应生成中间体6,经溴化锂脱去甲基生成多替拉韦游离态化合物7,最后7 与氢氧化钠成盐得到原料药多替拉韦钠(1)。
2 多替拉韦钠开环杂质的制备
采用原研专利路线得到的多替拉韦钠多批次产品中,HPLC 图谱均显示存在一个杂质超过鉴定限(0.15%)。通过LC-MS 检测分析,该杂质具有和产品一样的分子量。同时,产品的稳定性实验表明,该杂质在酸性条件下产生,在碱性条件下可以稳定存在,推测杂质的结构可能为母核结构中类似的缩醛结构发生氢质子转移,从而生成共轭体系更强的烯烃开环杂质,最后经核磁确证结构为1’(图3)。同时查询相关文献发现该杂质已有报道[5],但文献并未提及该杂质的详细制备方法,或者制备方法过于繁琐。因此有必要寻求一种更为简便的制备方法。
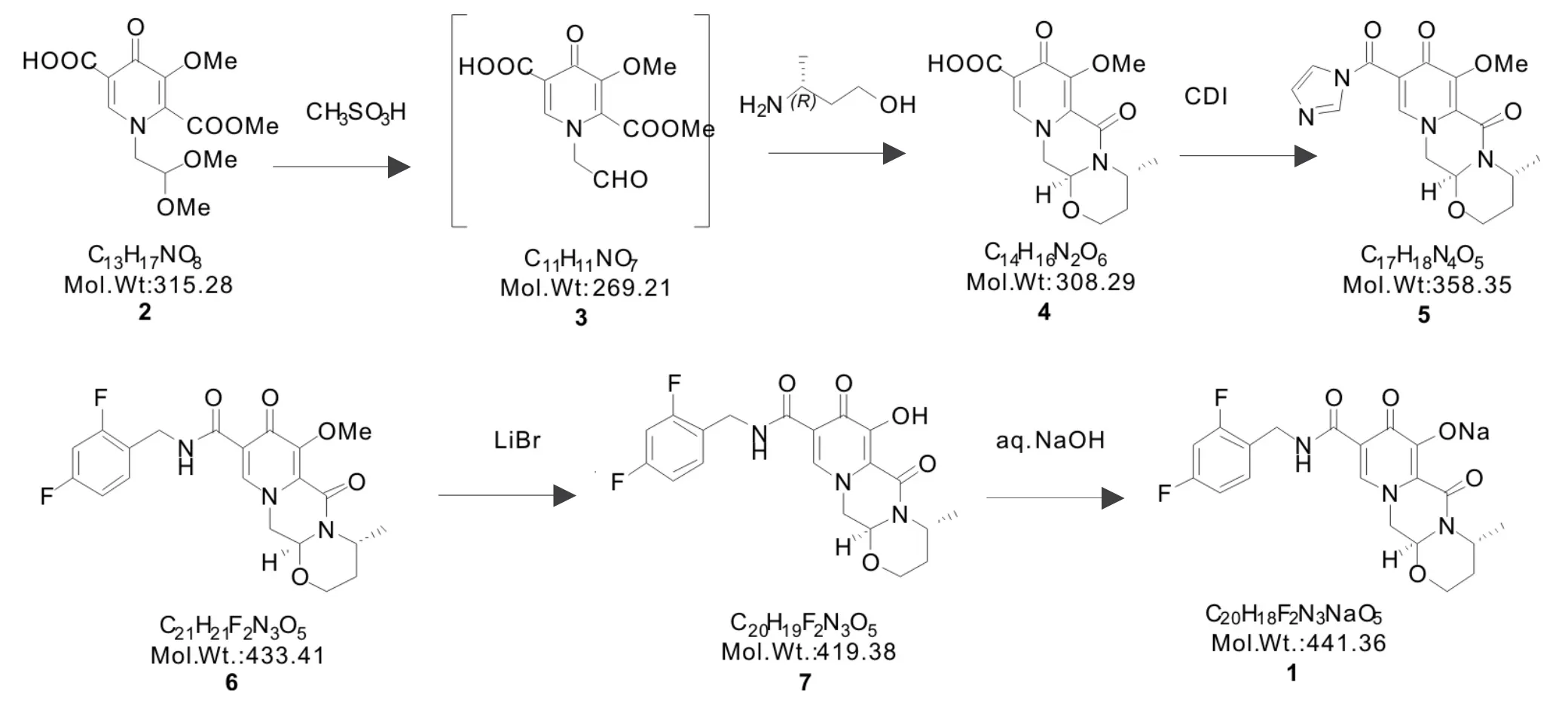
图2 多替拉韦钠的原研专利工艺路线Fig.2 ROS in original patent of dolutegravir sodium

图3 多替拉韦钠的开环杂质1’生成机理Fig.3 Mechanism of open-cycle impurity 1’ of dolutegravir sodium
基于开环杂质在酸性条件下产生,尝试以中间体7 为原料,筛选了多种酸性条件(表1)。结果发现:将工艺产品或者相应的中间体在甲磺酸催化下,反应温度为80 ℃,反应2 h,即可达到80%以上的转化率,反应液经简单柱层析分离,所得到的开环杂质7’收率和纯度较好;再与氢氧化钠成盐,即可快速分离得到大量的杂质对照品1’,以供后续多替拉韦钠产品的分析方法开发和验证。

表1 开环杂质7’的制备条件筛选Tab.1 Condition screening for the preparation of open-cycle impurity 7’
同时,对该杂质在各反应步骤间的传递和去除效果进行了系统研究,发现在合成化合物4 的步骤中已经出现了开环杂质4’,通过反应传递和后续中间体降解最终一步步传递到原料药中。采用类似的方法,分别成功制备了中间体4,6 对应的开环杂质4’,6’(图4),为后续制定中间体及成品质量标准提供了杂质标准品。

图4 开环杂质传递路线Fig.4 Scheme of open-cycle impurities carryover
2.1 开环杂质7’的合成
向反应瓶中加入化合物7(42 g,100 mmol)、乙腈(200 mL)、自来水(200 mL),室温下搅拌溶解,滴加甲磺酸(10 g,100 mmol),升温至80 ℃,搅拌约2 h,HPLC 检测化合物7 残留小于5%。旋蒸蒸除溶剂,残余物通过biotage 梯度洗脱,分批分离得到高纯杂质7’30 g,外观为淡黄色固体,收率为71%,纯度为99.5%。1H NMR(500 MHz,DMSO-d6),δ:12.29(br,1H),10.61(t,1H),8.80(s,1H),7.55(d,1H),7.42(q,1H),7.25(dt,1H),7.07(dt,1H),7.02(d,1H),4.86~4.93(m,1H),4.54~4.57(m,3H),3.37~3.40(m,2H),1.74~1.90(m,2H),1.29(d,3H);13C NMR(400 MHz,DMSO-d6),δ:168.2,163.5,161.8,160.5,159.8,153.1,134.9,130.9,122.2,117.7,117.3,114.8,113.6,111.4,103.9,57.5,47.4,36.6,35.9,18.4;ESI-MS:m/z,420.2 [M+H],839.4[2M+H]。
2.2 开环杂质1’的合成
将纯化后的杂质7’(10 g,23.8 mmol)加入反应瓶中,随后加入甲醇(100 mL),升温到65 ℃,滴加预先配置的20%氢氧化钠水溶液(1.4 g NaOH,5.6 g 水),反应瓶中逐渐析出固体,滴加完毕后,继续保温2 h,降至室温,过滤得到淡黄色杂质1’约9.5 g,收率为90%,纯度为99.8%。1H NMR(500 MHz,DMSO-d6),δ:10.92~10.94(t,1H),8.13(s,1H),7.36~7.41(q,1H),7.19~7.24(td,1H),7.14(d,1H),7.01~7.05(td,1H),6.66~6.65(d,1H),4.84~4.91(m,1H),4.53~4.54(d,2H),4.49(brs,1H),3.35(s,2H),1.68~1.80(m,2H),1.19(d,3H);13C NMR (125 MHz,DMSO-d6),δ:175.4,167.1,165.9,160.5,159.8,159.1,130.7,127.4,122.8,115.5,115.4,112.2,111.2,109.9,103.7,57.7,44.8,37.1,35.4,18.8;ESI-MS:m/z,420.0[M+H]。
2.3 开环杂质4’的合成
以中间体4 为原料,制备方法同开环杂质7’,得到(R)-2-(4-羟基丁-2 基)-9-甲氧基-1,8-二氧代-1,8-二氢-2H-吡啶[1,2-a]并吡嗪-7-羧酸(开环杂质4’),外观为黄色粉末,收率为70%,纯度为99.5%。1H NMR(500 MHz,DMSO-d6),δ:9.06(s,1H),7.53(d,1H),7.19(d,1H),4.88~4.95(m,1H),4.53(t,1H),3.87(s,3H),3.35~3.93(m,2H),1.74~1.88(m,2H),1.28(d,3H);13C NMR(400 MHz,DMSO -d6),δ:173.3,165.3,153.3,151.0,138.6,131.5,117.3,117.0,111.5,60.5,57.6,47.5,36.9,18.7;ESI-MS:m/z,309.2 [M+H]639.3[2M+Na]。
2.4 开环杂质6’的合成
以中间体6 为原料,制备方法同开环杂质7’,得到开环杂质6’,外观呈淡黄色粉末,收率为75%,纯度为99.3%。1H NMR(500 MHz,DMSOd6),δ:10.60(t,1H),8.88(s,1H),7.41~7.47(m,2H),7.23~7.28(m,1H),7.05~7.10(m,1H),7.00(d,1H),4.86~4.95(m,1H),4.56(d,2H),4.51~4.53(m,1H),3.81(s,3H),3.38~3.39(m,2H),1.71~1.88(m,2H),1.25(d,3H);13C NMR(400 MHz,DMSO-d6),δ:171.8,163.2,161.6,159.6,153.5,152.1,138.1,131.0,129.5,122.1,119.7,115.4,111.6,111.3,103.9,60.1,57.6,47.1,36.9,35.9,18.6;ESI-MS:m/z,434.2 [M+H]。
3 小结
本文论述了一种简便高效地定向杂质合成方法,合成出多替拉韦钠原料药关键工艺杂质1’及相应的中间体开环杂质4’,6’,7’,并对其进行了全面的结构鉴定。随后进行了该系列杂质的传递研究,为后续的工艺研究及杂质控制策略研究提供有力支持。
