过渡金属硫酸盐协同Pd/C高效定向降解木质素的研究
2021-04-07吴敏雅刘明华刘以凡吕源财
吴敏雅 刘明华,2,* 刘以凡,2 吕源财,2
(1.福州大学环境与资源学院,福建福州,350116;
2.福建省农村废弃物绿色循环技术工程研究中心,福建福州,350116)
木质素是自然界第二大生物质资源,含量仅低于纤维素,在植物中的占比达20%~30%,每年全球约产生6×1014t木质素[1]。木质素是一种三维空间结构的天然高分子芳香族聚合物,它的基本结构是由紫丁香基(S)、愈创木基(G)、对羟苯基(H)3种结构单元通过碳碳键或醚键连接组成,其中醚键是木质素结构中最重要的连接键,最常见的键型有β-O-5、α-O-4、4-O-5、5-5等[2-5]。同时,木质素还含有甲氧基、酚羟基、醇羟基等多种特征官能团。木质素也是自然界中唯一可再生的芳香类物质原料,在一定条件下可降解生成小分子化合物,因此在制备燃料和化学品领域应用广泛[6-7]。然而,由于木质素的结构特殊复杂,木质素难以进一步转化为高附加值化学品,因此,绝大部分木质素只能用作废物或生物质炼厂的低级燃料[8-9]。目前,木质素的降解方法种类繁多,其中催化降解法是利用均相或非均相催化剂,有效裂解木质素结构中的醚键,从而破坏木质素大分子结构,同时,通过加氢或氢化反应,使其形成小分子化合物,并保留木质素的芳香性质,该方法可作为制备具有高附加值的可再生化工原料的方法,是当下降解木质素的有效途径。
近年来,过渡金属盐因在生物质转化中的反应性较强而被广泛用作初级催化剂或协同催化剂[4]。Tri⁃bulova等[10]发现,利用过渡金属硫酸盐水解纤维素可形成单糖等低分子产物,提高纤维素的氧化敏感性。Zakzeski等[11]研究了不同过渡金属盐催化剂对离子液体中木质素的氧化降解;结果表明,过渡金属离子的活性顺序为Co2+>Cr3+>Fe2+>Ni2+>Mn2+>Cu2+。Shu等[12]利用金属氯化盐与Pd/C协同降解木质素,实现了高度可控的产物分布。此外,溶剂在催化裂解醚键中的重要性也备受关注[13-16],其中,甲醇具有明显的溶剂热效应和良好的供氢性能,在温和条件下可加速氢的释放。重要的是,它可以稳定降解过程中产生的单环自由基,从而产生更多的单体芳香基团,降低聚合作用[17-18]。
因此,本研究采用过渡金属硫酸盐NiSO4·6H2O协同Pd/C催化降解玉米芯酶解木质素,考察了金属离子、反应温度、反应时间、NiSO4·6H2O与Pd/C协同作用等对木质素降解率的影响,并通过元素分析、凝胶渗透色谱、红外光谱、气相色谱-质谱联用仪对木质素及其降解产物进行表征,对比了Pd/C、NiSO4·6H2O协同Pd/C催化降解玉米芯酶解木质素的产物分布,并分析了协同催化的作用机理。
1 实 验
1.1 主要试剂
玉米芯酶解木质素,工业级,山东龙力生物科技股份有限公司。Pd/C、NiSO4·6H2O等,分析纯,阿拉丁生化科技股份有限公司。甲醇、乙酸乙酯、四氢呋喃(THF)等,色谱纯,德国默克集团。
1.2 木质素降解
称取1 g的玉米芯酶解木质素(CL)于50 mL高温高压反应釜(聚四氟乙烯涂层)中,加入20 mL的甲醇为反应溶剂,添加一定量的催化剂。接着用氮气吹扫釜内3次,加盖锁紧反应釜,并将反应釜置于超声波仪中超声分散10 min,然后放置于电热鼓风干燥箱中,在反应温度220℃下反应5 h。结束后,待自然冷却30 min后出料,经过洗涤、过滤、分离后得到液体降解产物(LDLP)和固体残渣(LDSR)。实验设置不使用催化剂的体系为对照组。
1.3 催化剂的回收利用
将LDSR用超纯水洗涤3次,对滤液进行离子交换处理以回收镍。然后,用甲醇和THF继续洗涤滤饼直至滤液接近无色,经冷冻干燥后回收得到Pd/C。
1.4 样品处理
CL的乙酰化处理:采用乙酰溴和冰醋酸的混合溶液(1∶9,V/V,10 mL)作乙酰化试剂,加入1.0 g的CL,在烧瓶中密封,在50℃、150 r/min下反应2 h,完成后将溶剂蒸干,所得固体为乙酰化木质素。
1.5 分析方法
采用凝胶色谱仪(GPC,Waters2414,美国Wa⁃ters公司)对样品的相对分子质量和相对分子质量分布进行测定,并用聚苯乙烯(PS)作为标样,以THF为流动相。采用元素分析仪(EA,Vario ELcube,德国Elementar公司)对化合物组成中的C、H、O等元素的含量进行分析表征。采用傅里叶变换红外光谱仪(FT-IR,AVATAR360智能型,美国尼高力仪器公司)对样品的官能团和键型进行分析表征,扫描范围为400~4000 cm-1,扫描次数为32次。采用全二维气相色谱-高分辨飞行时间质谱联用分析仪(GC-MS,Agi⁃lent 6890-59731,美国安捷伦科技有限公司)对样品进行定性和定量检测。将样品充分溶解在乙酸乙酯中,以多氯联苯为内标物。气相色谱检测条件:Rxi-5ms(30 m×0.25 mm×0.25μm)毛细管柱,载气为He,流速1.4 mL/min;初始柱温50℃,保持1 min后,以10℃/min的速率升到300℃,保持10 min;进样温度280℃,进样量1μL,分流比20∶1。
1.6 参数计算
木质素降解率(DL)及产物得率(Yn)分别根据式(1)和式(2)计算。
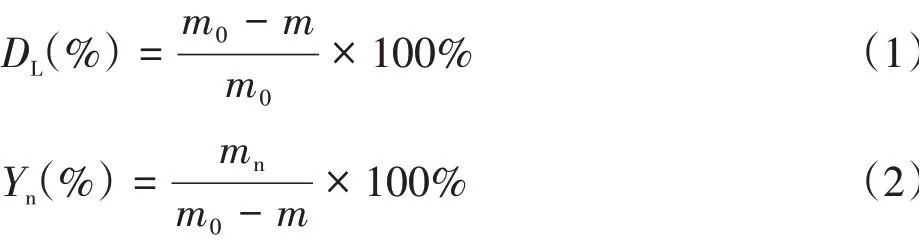
式中,m0为木质素初始投加质量(g),m为LD⁃SR的质量(g),mn为产物质量(g)。
2 结果与讨论
2.1 过渡金属硫酸盐对木质素降解率的影响
2.1.1 过渡金属离子的影响
为了研究不同过渡金属离子对Pd/C催化降解木质素的影响,选择7种过渡金属硫酸盐配合Pd/C作为催化剂,结果如图1所示。
在未使用任何催化剂(对照样)时,木质素的降解率较低(40.6±2.2)%;单独使用Pd/C作为催化剂时,木质素降解率为(51.5±1.5)%;而在使用不同过渡金属硫酸盐协同Pd/C进行催化降解的情况下,木质素的降解率显著提高,说明过渡金属硫酸盐可以有效促进Pd/C催化降解木质素。据相关报道[19-21],路易斯酸催化剂可以催化裂解C—O键,从而有效降解木质素。因此,对过渡金属硫酸盐在甲醇中于220℃反应5 h前后的氢离子浓度进行了检测(见图2);结果表明,过渡金属硫酸盐的甲醇溶液在经过5 h的处理后释放出大量的氢离子,进一步证实了路易斯酸催化剂的本质特征。此外,由图1可知,不同过渡金属硫酸盐对Pd/C催化降解木质素性能的影响不同。NiSO4·6H2O的效果最优(木质素降解率为(86.5±3.3)%),然后依次为CuSO4∙5H2O、FeSO4∙7H2O、ZnSO4∙7H2O、Cr2(SO4)3∙6H2O、CoSO4∙7H2O,MnSO4·H2O的效果最差,说明NiSO4·6H2O与Pd/C的协同效应对催化降解木质素的效果最显著。且由图2可知,具有较高氢离子浓度的反应体系往往表现出较好的性能。然而,木质素降解率与体系氢离子浓度之间并没有显著的正相关关系,这意味着除了氢离子浓度外,过渡金属离子可能在促进木质素的降解中起到关键作用。据相关报道[22],这些体系之间的差异可能是由于在不同金属离子中心存在的情况下,底物-催化剂相互作用的强度不同造成的。因此,考虑到过渡金属中镍元素的电负性最高,可以推断在反应过程中,通过底物-催化剂的相互作用,NiSO4·6H2O除了酸性中心外,还可以产生更多的配位点,提高反应活性。
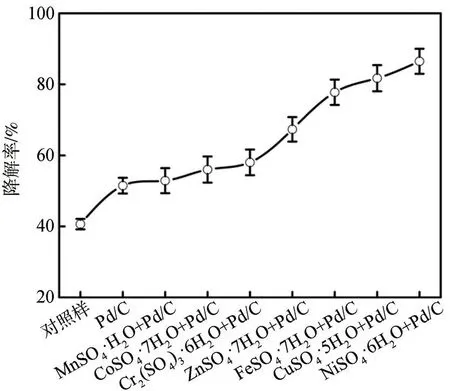
图1 不同过渡金属离子对CL降解率的影响Fig.1 Effectsof different transition metal ionson CL degradation ratio
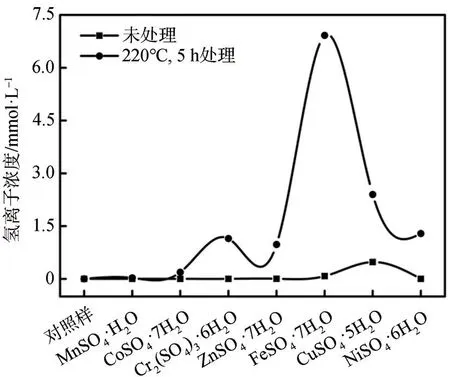
图2 过渡金属硫酸盐的甲醇溶液的氢离子浓度Fig.2 Hydrogen ion concentration in methanol solution of transition metal sulfates
2.1.2 反应温度的影响
在木质素降解过程中,温度在催化剂的活化和醚键的断裂中扮演着至关重要的角色[23]。本研究对反应时间5 h、不同反应温度(180℃~280℃)下的NiSO4·6H2O协同Pd/C催化降解木质素的降解率进行了检测,结果如图3所示。由图3可知,NiSO4·6H2O协同Pd/C催化降解木质素过程对温度的依赖性很强。反应温度低于220℃时,木质素降解率随着温度的升高 而 显 著 提高(由(42.0±1.4)%提 高 到(86.5±3.3)%)。当反应温度继续上升(≥200℃)时,木质素降解率基本保持稳定。根据以往的报道[24],较高的温度会导致部分有机化合物的碳化,甚至催化剂的失活,不利于木质素的进一步降解。
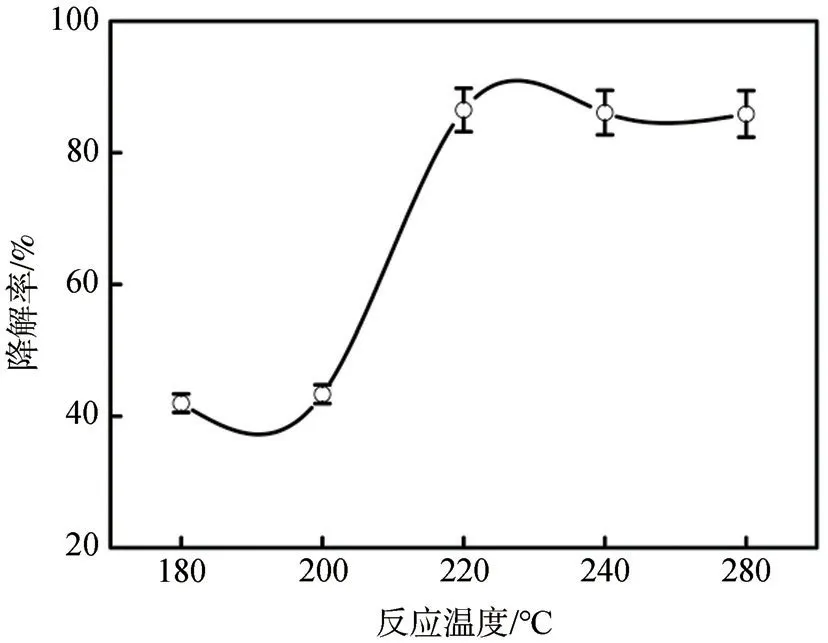
图3 反应温度对CL降解率的影响Fig.3 Effect of reaction timeon CLdegradation ratio
2.1.3 反应时间的影响
在220℃下,研究反应时间对NiSO4·6H2O协同Pd/C催化降解木质素的影响,结果如图4所示。由图4可知,随着反应时间从2 h延长至5 h,木质素的降解率从(43.2±1.4)%提高至(86.5±3.3)%。然而,随着反应时间的继续延长,木质素的降解率反而出现小幅下降,说明过长的反应时间可能会导致催化剂发生一定程度的失活。
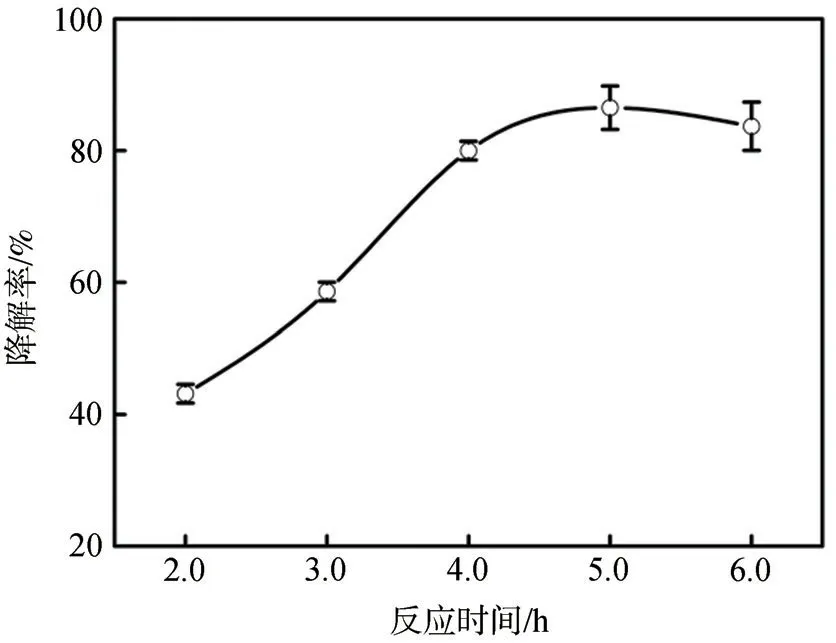
图4 反应时间对CL降解率的影响Fig.4 Effect of reaction timeon CLdegradation ratio
2.1.4 NiSO4·6H2O与Pd/C协同作用的影响
对比了最优工艺条件(220℃、5 h)下未使用催化剂、分别单独使用NiSO4·6H2O和Pd/C,以及NiSO4·6H2O和Pd/C协同作用4种情况下的木质素降解率,结果如表1所示。由表1可知,在未使用催化剂和单独使用NiSO4·6H2O作催化剂的情况下,木质素的降解率分别为(40.6±2.2)%和(43.2±3.0)%,说明单独使用NiSO4·6H2O对于催化降解木质素的效果并不理想。与对照样相比,单独使用Pd/C作催化剂的情况下,木质素降解率有了明显的提高((51.5±1.5)%),这与现有的多数研究结果相符[25-27]。而在加入NiSO4·6H2O协同Pd/C进行催化降解时,木质素的降解率进一步提高至(86.5±3.3)%,这说明NiSO4·6H2O与Pd/C之间存在的协同作用可高效催化降解木质素。
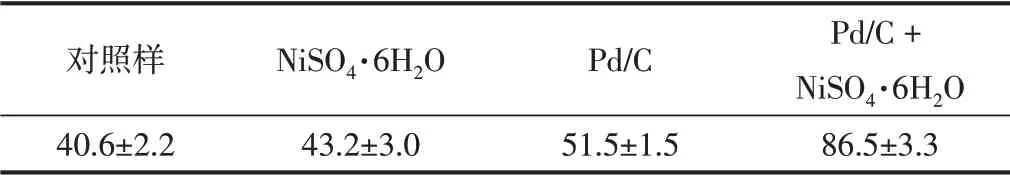
表1 NiSO4·6H 2O与Pd/C协同作用对CL降解率的影响Table 1 Effect of NiSO4·6H 2O and Pd/C synergistic effect on CL degradation ratio %
2.2 过渡金属硫酸盐对降解产物分子质量的影响
为了探究NiSO4·6H2O协同Pd/C对木质素降解产物分子质量分布的影响,采用GPC对木质素及其降解产物的分子质量进行测定,得到木质素及其降解产物的质均分子质量(M w)、数均分子质量(M n)和分散度d(d=M w/M n),结果如表2所示。由表2可知,木质素的M w、M n和d分别为3949、2131和1.91。在未使用催化剂的情况下,木质素降解产物的M w、M n和d并没有显著降低,说明木质素降解率低,且降解产物组分仍以大分子化合物为主,不利于后续的改性应用。单独使用Pd/C作催化剂时,降解产物的M w、M n和d分别降至1241、664和1.65,说明Pd/C有效催化裂解了木质素的大分子结构,降低了降解产物的分子质量。加入NiSO4·6H2O协同Pd/C进行催化降解时,降解产物的M w、M n和d进一步分别降至537、432和1.06,说明NiSO4·6H2O和Pd/C的协同作用进一步催化裂解了木质素的大分子结构,并使其转化为更低分子质量的寡聚体。另外,分散度d的显著降低表明了NiSO4·6H2O的加入使降解产物的分子质量分布区间变窄,均一化程度提高了35.8%,更有利于其进一步的应用开发[28]。
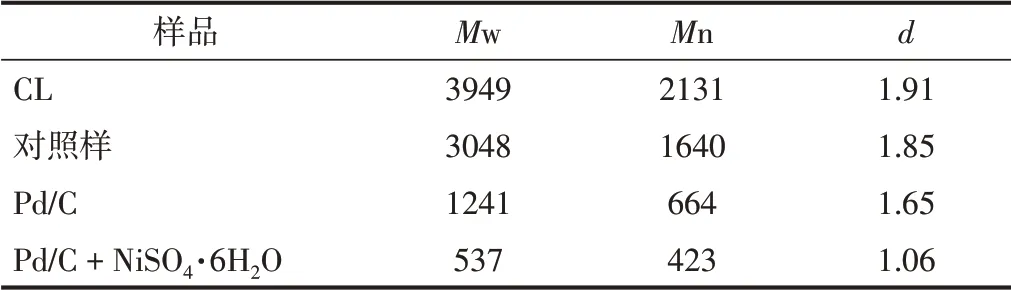
表2 NiSO4·6H 2O与Pd/C协同作用对产物均一化的影响Table 2 Effect of NiSO 4·6H 2O and Pd/C synergistic effect on the products uniformity
2.3 过渡金属硫酸盐对降解产物分布的影响
2.3.1 元素分析
为了进一步了解木质素结构的化学变化,采用元素分析仪对木质素及其降解产物的元素组分进行测定对比,结果如表3所示。
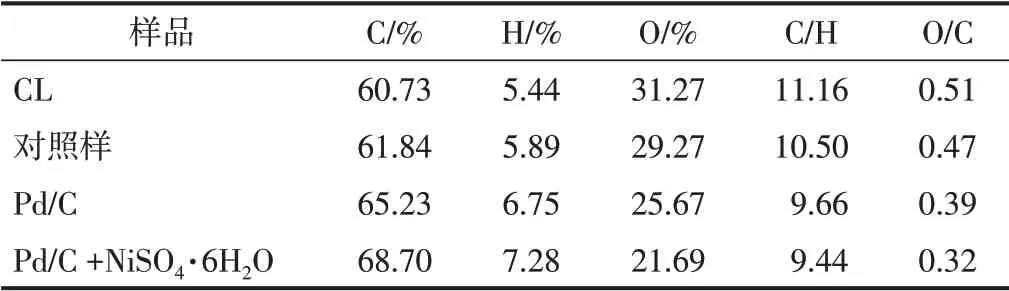
表3 CL和LDLP的元素分析Table 3 EA of CL and LDLP
由表3可知,木质素的C、H、O含量分别为60.73%、5.44%、31.27%,且总占比超过97%,说明在木质素中并没有过多的其他元素,如S、N等。在未使用催化剂的情况下,降解产物中的C/H、O/C比值未见明显变化,说明木质素并未发生明显的化学变化。然而,经NiSO4·6H2O协同Pd/C催化降解得到的产物中的C、H含量均明显增加,而O的含量明显下降,与此同时,C/H和O/C也有所降低。据相关文献报道[29],木质素降解过程中发生了明显的加氢反应,这会导致C/H比值的降低,羟基脱水或甲氧基氢解会导致O/C比值的降低。对比可知,NiSO4·6H2O与Pd/C协同作用可以促进加氢反应,同时,Pd/C与Pd/C+NiSO4·6H2O降解木质素产物组分变化的趋势类似,说明NiSO4·6H2O有效加强了Pd/C的催化降解作用。
2.3.2 FT-IR分析
为了进一步分析木质素及其降解产物的有机组分,对其进行FT-IR表征,结果如图5所示。
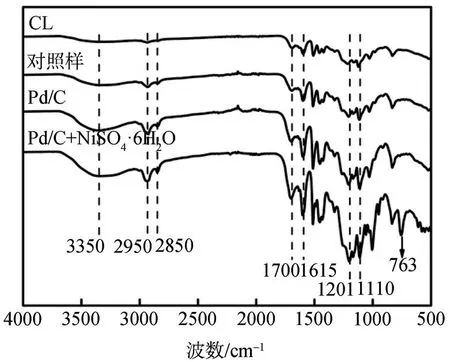
图5 CL和LDLP的FT-IR谱图Fig.5 FT-IRspectra of CL and LDLP
由图5可知,木质素及其降解产物在1595、1513、1450以及833 cm-1处均有吸收峰,这3个位置的吸收峰代表木质素中的苯环骨架振动吸收峰,且峰形基本一致,表明木质素的苯环结构在催化降解的过程中得到了保留。2850 cm-1处的吸收峰对应Ph-OCH3中C—H键的伸缩振动,说明降解产物依然保留有木质素的基本单元结构,如愈创木基、紫丁香基等,进一步说明催化降解主要通过裂解木质素单元结构间的连接键来实现破坏木质素的大分子结构[30]。在未使用催化剂的情况下,降解产物与木质素的峰形基本一致,且并未观察到显著的吸收峰变化,说明降解产物的组分类型相较于木质素并没有明显的变化,进一步证实了在未使用催化剂的情况下并不能有效降解木质素。3350和1201 cm-1处的吸收峰分别为缔合羟基和酚羟基的伸缩振动峰,且由图4可知,NiSO4·6H2O可以有效协同Pd/C催化降解木质素并定向生成酚类化合物。此外,2950 cm-1处的吸收峰对应甲基、亚甲基、次甲基的C—H伸缩振动峰,说明降解产物的苯环结构侧链上可能直接连接甲基官能团或碳碳键结构。1615、1700、1110 cm-1处的吸收峰分别对应酯羰基C=O和C—O—C的伸缩振动峰。而且,相较于仅添加Pd/C体系,NiSO4·6H2O协同Pd/C体系在1201 cm-1处的酚羟基O—H伸缩振动峰强度远高于1110 cm-1处的酯羰基C—O—C伸缩振动峰强度,且酚类区域的吸收峰响应强度与酯类吸收峰的响应强度的差距增大,说明NiSO4·6H2O的加入不仅可以有效提高酚类化合物的得率,还可以一定程度提高酯类化合物的得率,但酚类化合物的增幅明显高于酯类化合物。值得注意的是,763 cm-1处的吸收峰代表一取代苯上的C—H弯曲振动峰,仅在NiSO4·6H2O协同Pd/C催化降解木质素的体系中观察到,这表明在NiSO4·6H2O和Pd/C的协同作用下,Ar—O—R结构中Ar—O键经催化加氢而形成了Ar—OH,进一步证实了产物中含有大量的单酚类小分子化合物[31]。
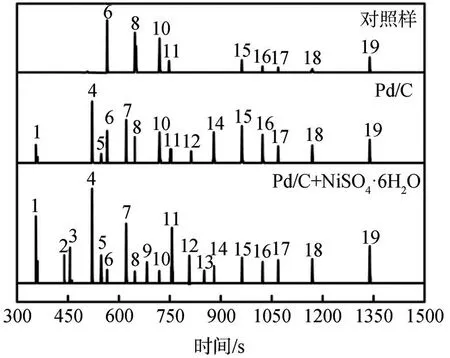
图6 LDLP的GC-MS谱图Fig.6 GC-MSspectra of LDLP
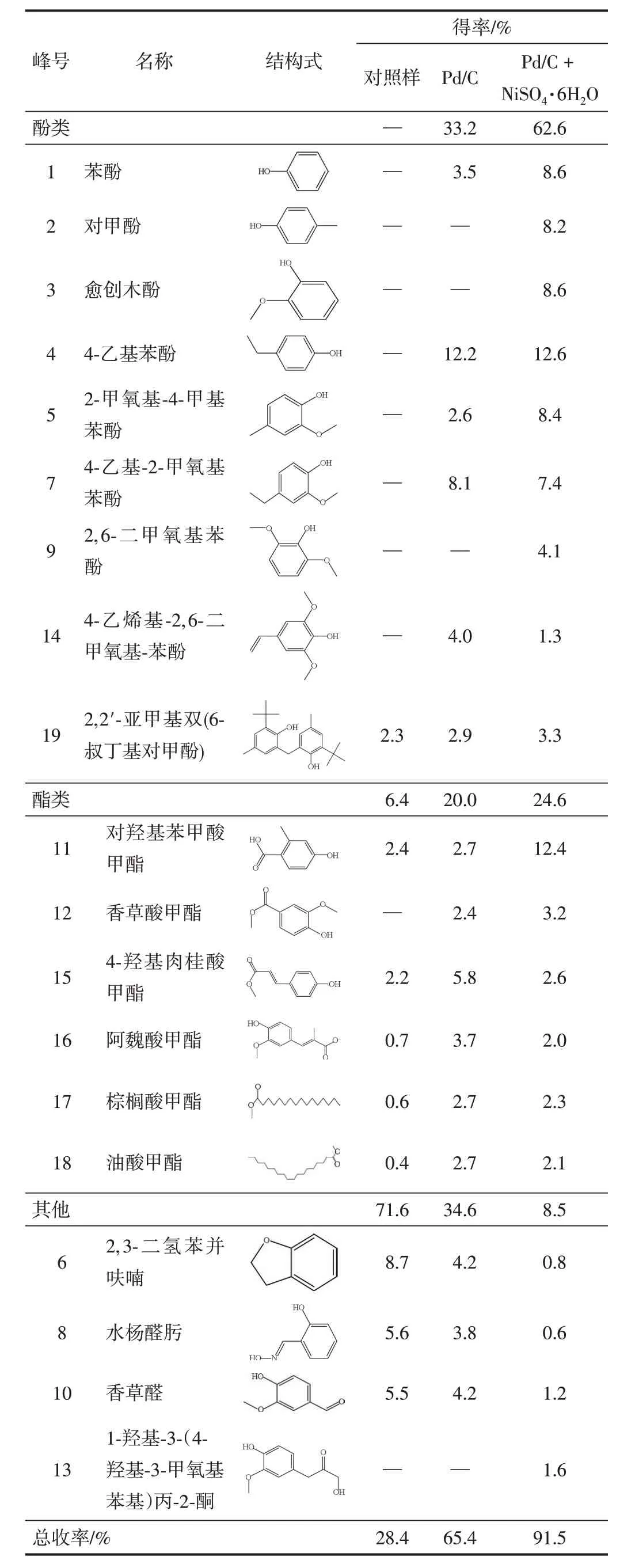
表4 LDLP的主要成分的GC-MS分析结果Table 4 GC-MS analysis results of the primary composition of LDLP
2.3.3 GC-MS分析
为进一步探究NiSO4·6H2O与Pd/C协同作用对降解产物分布的影响,通过GC-MS对木质素降解产物的组分进行定性及定量分析,结果如图6和表4所示。
由图6和表4可知,不同降解条件下得到的降解产物的组分和得率差异较大。未使用催化剂的情况下,降解产物中小分子产物的总收率较低且种类较少,主要包括2,3-二氢苯并呋喃、水杨醛肟、香草醛以及酯类化合物等,且并未观察到酚类化合物的产生。在单独使用Pd/C作为催化剂的情况下,降解产物中小分子产物的总收率增至65.4%;同时,产生了酚类化合物,其得率可达到33.2%,主要包括苯酚、4-乙基苯酚、4-乙基-2-甲氧基苯酚等,说明Pd/C可以有效提高木质素降解率,且诱导木质素催化加氢生成酚类化合物。在使用NiSO4·6H2O协同Pd/C进行催化降解时,木质素小分子的总收率相较于Pd/C体系增加了39.9%,酚类化合物的得率提高了88.6%,且生成了更低分子质量的酚类单体,如愈创木酚、对甲酚、2,6-二甲氧基苯酚等;同时,酯类化合物的得率也有明显的提高,且向相对低分子质量的酯类转化。说明NiSO4·6H2O和Pd/C的协同作用可以促进木质素大分子结构的裂解并诱导加氢反应以提高酚类化合物的选择性。因此,NiSO4·6H2O和Pd/C在木质素催化降解过程中具有良好协同作用效果,可实现对酚类产物的高度可控性。
3 结 论
采用过渡金属硫酸盐NiSO4·6H2O协同Pd/C在甲醇体系中实现定向催化降解木质素,生成以酚类为主的小分子化合物,并进一步提高产物的均一化程度。结果表明,NiSO4·6H2O的路易斯酸特性和镍元素的高电负性,使得木质素的醚键可有效在Pd/C和NiSO4·6H2O酸性催化中心上发生降解,并通过加氢反应,生成以酚类为主体的中间产物。这种低成本、低能耗的木质素降解工艺将为木质素降解产物的可持续利用提供有益的参考。
