六种观赏植物根际土壤微生物菌群结构分析
2021-04-06朱澳云朱骥文祁洪刚周慧刘爱民
朱澳云,朱骥文,祁洪刚,周慧,刘爱民
(安徽师范大学 生命科学学院/基因疾病与健康生物医学安徽省高校重点实验室,安徽 芜湖 241000)
在市场需求和国际竞争的拉动下,发展生物产业、抢占生物经济制高点已成为确保国家安全和产业竞争力的战略重点[1]。微生物资源是国家的重要战略生物资源,微生物产业的产值不断增长,在工业、农业、林业、医药、环境、能源等诸多领域发挥着重要作用。微生物领域具有巨大开发前景,当前我国微生物资源开发应用相较于发达国家,仍旧落后、缺少整体统一性。原因一是微生物的基础研究落后于生产需求,二是对微生物基础资源发掘落后。仅从农业菌种上,美国农业部微生物菌种中心库目前保藏微生物种质资源8万株,而我国农业菌种中心库菌种仅为3 千多株,在数量和质量上差距很大[2]。同时,也没有建立全国性的信息共享平台。基础工作即微生物多样性调查及菌种提取保藏工作的落后将极大牵制应用层面的发展[3]。
根际(Rhizosphere)是指植物根系周围受到根系分泌物影响的区域,表现出的理化性质以及生物学活性明显不同于原土质[4]。根际微生物直接受根系分泌物的影响,形成丰富的微生物群,被认为是一个高度动态系统,且根际向周围环境释放各种化合物[5],从而吸引更多的促进植物生长的菌种。大量研究表明,根系微生物与微生物、植物间的一系列相互关系,影响植物整体健康状况及生长发育,调控根际微生物群落结构[6-9]。植物与根际微生物的互作现象及其机制,是生命科学研究关注的热点,也是农业微生物利用的关键问题[10]。根系微生物对植物的影响可大致分为,有益根系微生物PGPR(plant growth-promoting rhizobacteria)[11]、有害微生物 (含各类病原菌),中性微生物(共生菌)等。本研究通过研究校园观赏树种根际微生物的情况,探寻植物与微生物的相互作用关系,建立校园观赏树种根际微生物菌种资源库,旨在建立菌种库的同时,鉴定分离出PGPR,进一步筛选高效产酶菌株,研究其与植物的互作关系。宏基因组学是专门研究直接从样品中分离基因组DNA 后进行测序分析,能够准确揭示微生物群落多样性、种群结构、进化关系、功能活性及环境之间的相互协作关系,极大地丰富对土壤根系微生物种群结构及其功能的认识[12]。利用未开发的微生物群落鉴定和分离有效的酶是全球学术界的一个活跃领域,作为地球上最古老的生命类型,原核微生物具有显著的生理、代谢和功能多样性,并且是最丰富的遗传多样性资源。经典的方法是通过培养微生物,再筛选所高表达酶的菌种。然而,很多环境微生物不能通过标准实验室技术培养,因而有大量的菌种的功能没有得到发现,而宏基因组测序绕过分离、培养微生物的环节,直接从环境样品中提取基因组DNA,然后对所有的微生物进行测序。宏基因组学逐渐成为开发复杂生态系统遗传和代谢多样性的有力工具[13]。
校区地处北亚热带与中亚热带的交接地带,土壤具有明显的过渡特点,土壤类型复杂多样。校区气候总的特点是受东南季风影响,温暖湿润,光照充足,生长季节较长,干湿季明显。年平均气温在16 ℃左右,年降雨量1 300 mm,全年无霜期达240 d上下,有利于作物生长。校区土壤为普通黄棕壤,其理化性质具有下列特点:表土呈酸性反应,说明淋溶作用比较强烈,有机质和全氮分别属于低量与中等偏下;全磷含量低,全钾含量高,代换量低。发育在砂岩上土壤质地为重壤土,粘粒含量21.08%,发育在安山凝灰岩上,质地为轻粘土,粘粒含量36.59%[14]。
校区共有65 种植物,其中观赏植物约41 种。研究选取校园内日本樱花、石楠、枫杨、银杏、夹竹桃、紫楠六种常见植物根际土壤,对根际土壤进行菌种分离纯化、鉴定保藏;对所分离纯化的菌种进行酶活检测,分析发现PGPR,筛选出高效的产酶菌种,初步建立校园菌种库;并通过宏基因组检测,对根际微生物群落构成等进行分析研究,探讨根际微生物与植物生长的关系。
1 材料与方法
1.1 样品采集
土样采集于根系旁表层下处。取样时去除表层杂物,取15 cm土层的根区土壤,每个样品分为3份:一份立即于-20 ℃保存,用于测定根际微生物数量;一份立即带回室内测定土壤水分含量(烘干法);第三份自然风干,用于测定土壤酶活性。
1.2 实验仪器与材料
台式高速离心机(X-22R);琼脂糖电泳仪(JYSPC);土壤基因组DNA 提取试剂盒(离心柱型);手提式高压蒸汽灭菌锅(DSX-30L);电子天平(AR224CN)。
牛肉膏蛋白胨培养基:牛肉膏3 g,蛋白胨5 g,琼脂18 g,去离子水1 000 ml,pH 7.0-7.2;高氏I号培养基:可溶性淀粉20 g,KNO31 g,K2HPO40.5 g,MgSO40.5 g,FeSO4·7H2O 0.01 g,NaCl 0.5 g,琼脂 18 g,pH 7.2-7.4,去离子水 1 000 ml。
马铃薯葡萄糖琼脂培养基(PDA):马铃薯(去皮)200 g,葡萄糖20 g,去离子水1 000 ml;无菌水;链霉素;10%酚。
1.3 土壤微生物分离与数量统计
菌种分离:制备土壤悬液,对土壤悬液进行梯度稀释后,涂布于牛肉膏蛋白胨培养基、高氏I号培养基、PDA 培养基,根据菌种特性于28 ℃,放置2~10 d。根据菌落形态、色素、干燥等特征[15],挑取形态差异较大的菌落进行平板划线再次纯化并保存。
真菌采用马铃薯培养基培养,细菌采用牛肉膏蛋白胨培养基培养,放线菌采用高氏1号培养基培养。培养后采用稀释平板法进行计数。
1.4 基因组DNA 提取与鉴定
1.4.1 实验试剂
1%琼脂糖凝胶液;5×Tris-乙酸(TAE)缓冲液:2 mol/L Tris 碱,0.5 mol/LEDTA(pH=8.0),去离子水,1 mol/L 冰乙酸;加样缓冲液:0.25%溴酚蓝;40%(W/V)蔗糖水溶液;0.5 ug/ml 溴化乙锭;100倍电泳缓冲液:4 mol/L Tris-HCl(pH=8.0),2 mol/L醋酸钠,200 mmol/L EDTA。
1.4.2 基因组DNA 提取
依照TIANamp Soil DNA Kit(离心柱型)所示步骤,进行研磨、漂洗、离心、吸附等一系列处理。
1.4.3 基因组DNA 检测
移出土壤中砾石、植物组织等,称取250 mg 土壤,按照DNeasy R PowerSoil R Pro Kit 说明书提取微生物宏基因组DNA,NanoDrop 2 000 分光光度计测定DNA 浓度和纯度,1%琼脂糖凝胶电泳检测基因组DNA 条带。采用PCR 扩增基因组DNA 细菌16S rRNA V3-V4 区域。PCR 产物用2%琼脂糖凝胶电泳检测,产物鉴定合格后交由上海生工生物工程有限公司进行宏基因组分析。
2 结果与分析
2.1 观赏树种根际微生物分离
本实验采用的分离方法为传统的菌种分离手段,利用不同的培养基对土壤悬液进行菌种分析,再进行平板划线将单个菌落分离出来,镜检,再斜面保存于-20 ℃冰箱中。细菌是土壤微生物中数量最多的微生物种群,参与有机质的分解、氨化作用等;真菌参与土壤中有机质的分解和腐殖质的形成,参与土壤中的氨化作用以及团聚体的形成;土壤放线菌参与土壤有机物的分解并能分泌抗生素拮抗土壤中的病原菌。根据镜检结果,由表1可见,共分离出86株明显优势菌种,根据每种土壤的分离结果,可以看出各个观赏树种中土壤菌群不同,如日本樱花,夹竹桃和紫楠,它们的根际微生物放线菌数目种类较多。
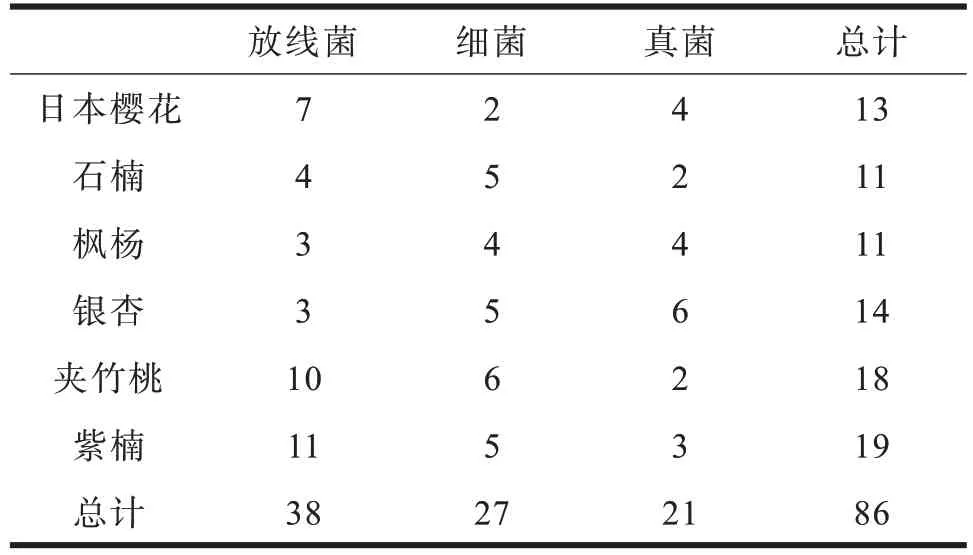
表1 菌株分离纯化种数Table 1 The species number of strains isolated
2.2 菌种丰富度
选取了日本樱花,枫杨,石楠,夹竹桃四种观赏树种的根际微生物进行了宏基因组分析,分别用1,2,3,5进行编号,从不同角度分析菌种丰富度。基于土壤样本的宏基因组分类,使用DIAMOND 将基因及蛋白序列与Nr数据库进行blastp同源性比对,得到功能注释和同源物种信息,筛选条件:E-value<1e-5,Score>60。同时根据NCBI 的微生物分类学信息数据库,获得基因的物种分类注释信息,并在Kingdom(界)、Phylum(门)、Class(纲)、Order(目)、Family(科)、Genus(属)、Species(种)各个分类学水平上统计物种的相对丰度。根据基因层面上对于物种的分类,大概有十余种不同的物种,比对以上各物种的基因数目差距也比较大,见图1(不同颜色代表不同物种,扇形面积代表比对上该物种的基因数目)。
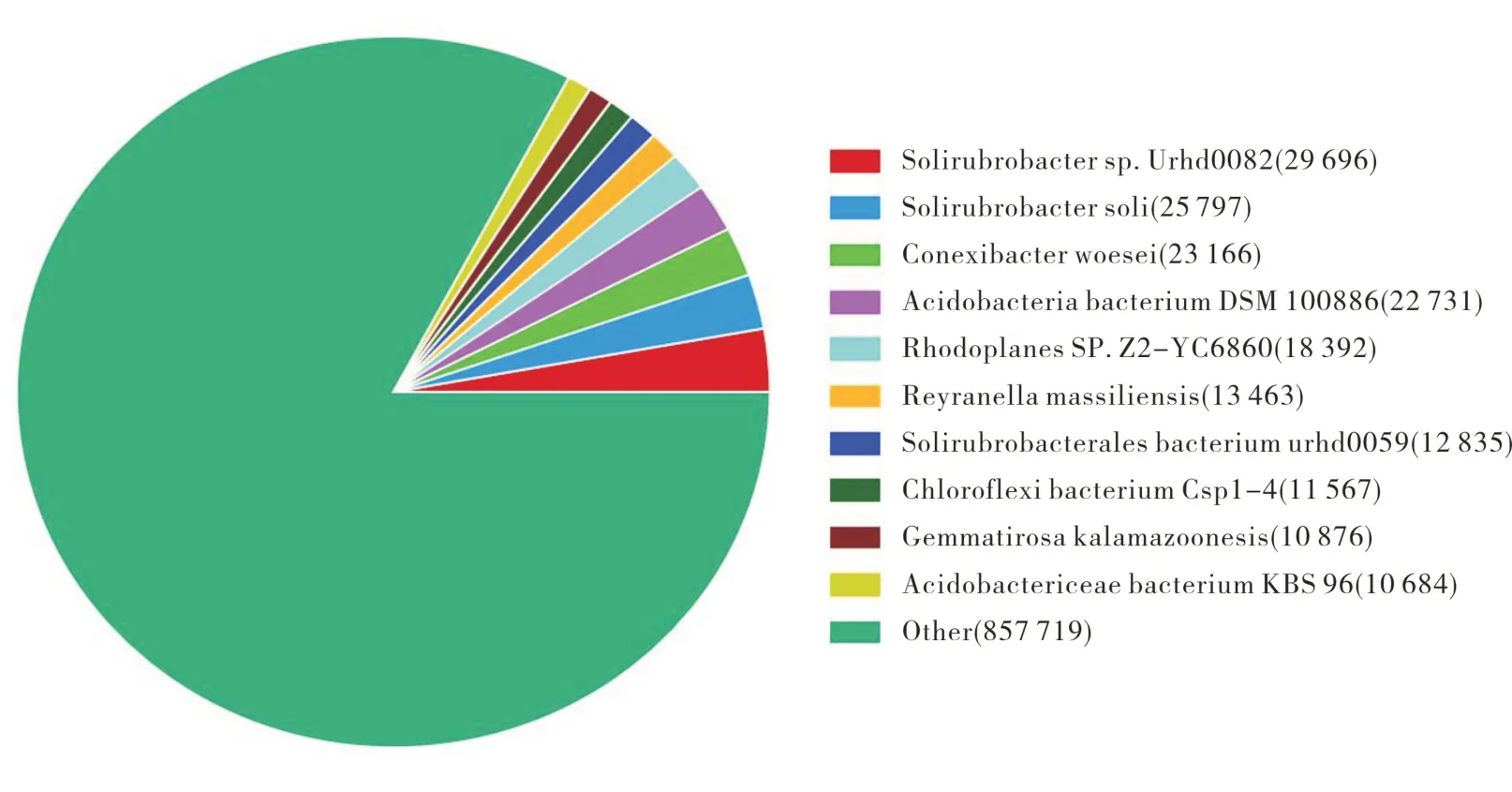
图1 同源物种统计饼图Fig.1 Homologous species pie chart
2.3 观赏树种根际土壤细菌群落结构
在门水平上,根据物种或功能相对丰度,将所有样本结构组分图比较绘制柱状图。由图2 可见,颜色对应门分类学水平下各物种名称,不同色块宽度表示不同物种相对丰度比例。根据样品中相似程序进行排布,绘制了对应样本聚类树状图反应样本中功能组分的柱状图。四种不同的观赏树种土壤根际微生物排名前八的物种,均有所不同。放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)均属于四种样本都大量存在的常见菌种所在的门,日本樱花和夹竹桃土壤样本中均占50%以上。而绿弯菌门(Chloroflexi)、拟杆菌门(Firmicutes)、Bacteria_noname则是较多存在于5号夹竹桃的根际土壤中,1 号日本樱花根际土壤中存在很少甚至没有。奇古菌门(Thaumarchaeota)只存在于枫杨和石楠的根际土壤中。图3 中左侧是相似性树状图,样本间差异越小,样本便会处在相近的同一个分支,样本颜色按分组信息区分。右侧柱状图,展示样本中的物种分布,不同颜色代表不同物种。由图2、图3 可以看出,枫杨和石楠的土壤根际微生物比较相近,而日本樱花的土壤根际微生物则与其它三种样本菌种有较大的差别。这种差别主要来源于植物根系的影响,为建库及以后研究的采样提供了依据。
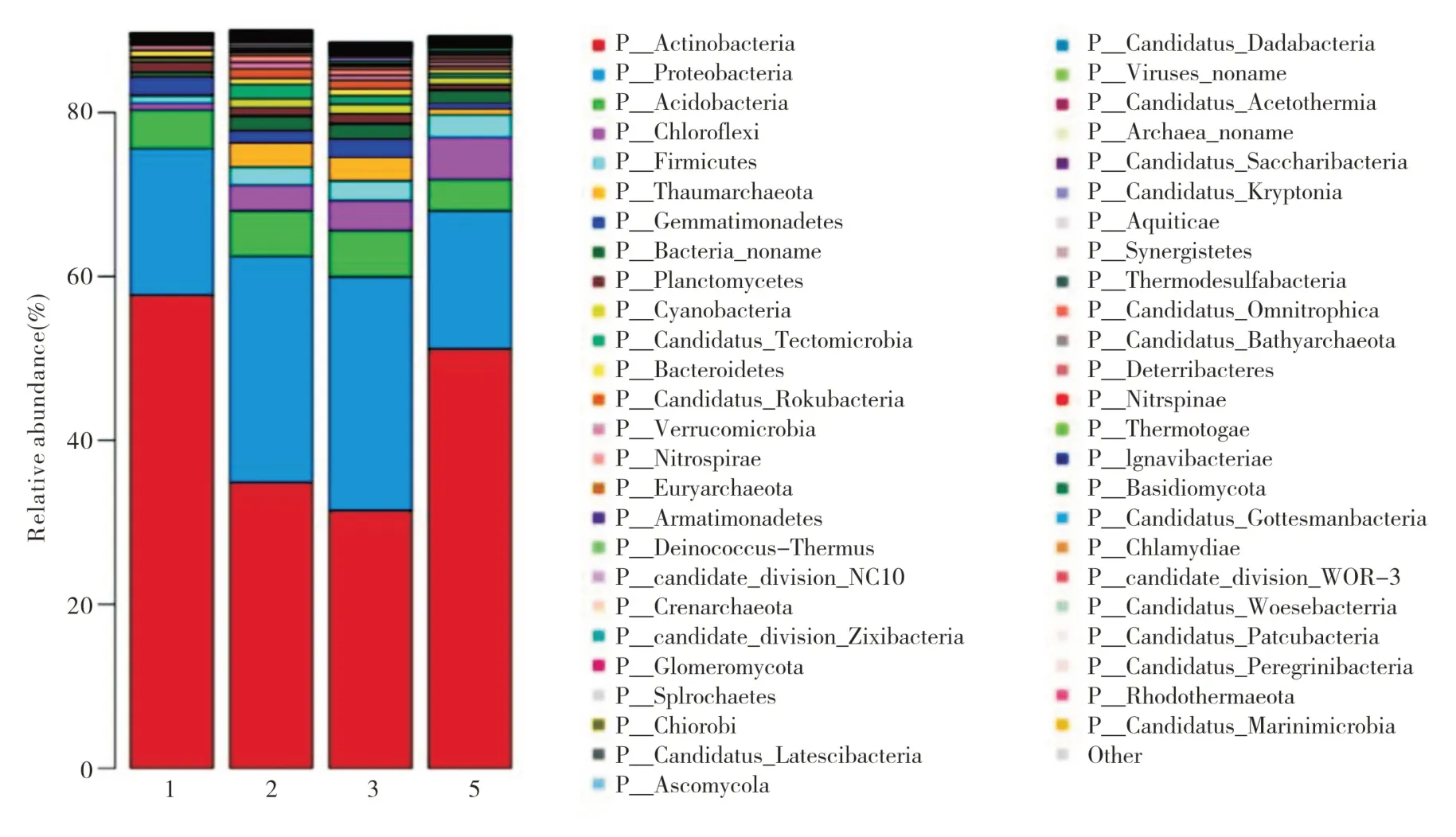
图2 门分类水平上相对丰度柱状图Fig.2 Relative abundance histogram on the phylum classification level
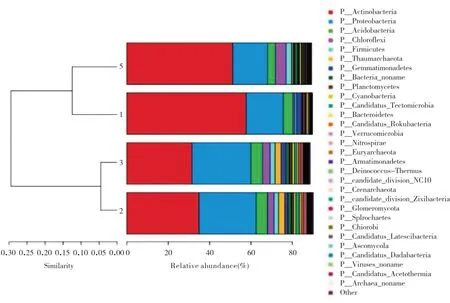
图3 样品聚类树与柱状图组合分析图Fig.3 Sample cluster tree and histogram combined analysis diagram
2.4 样本根际土壤群落的多样性分析
为进一步探究四种观赏植物土壤根际微生物的区别和联系,从物种分类水平上继续探究。使用统计算法bray curtis 计算样本间距离,距离反应样本间总体特征分布上的差异。然后进行层次聚类 (Hierarchical cluatering)分析,构建树状结构,得到树状关系,图4 中树枝的长度代表样本间的距离,越相似的样本会越靠近,样本按分组以不同颜色区分。样本编号分别为1号日本樱花,2号枫杨,3号石楠,5 号夹竹桃。如图4 所示,2 号枫杨和3 号石楠土壤之间的样本距离最小,与1 号日本樱花之间样本距离最大,它们根际土壤菌群有明显的差异。
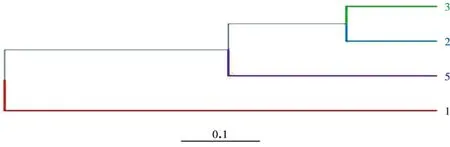
图4 物种分类水平上Hcluster 层次聚类树Fig.4 Hcluster clustering tree on the species classification level
每个样本都存在共有和特有的组分,本研究使用venn 图统计多个样本中共有或独有的物种、基因或者功能成分数目,直观的表现出样本成分组成相似性及重叠情况,重叠部分越多代表土壤样本越相似,见图5(不同样本用不同颜色表示,图中数字代表特异或共有的组分数目)。
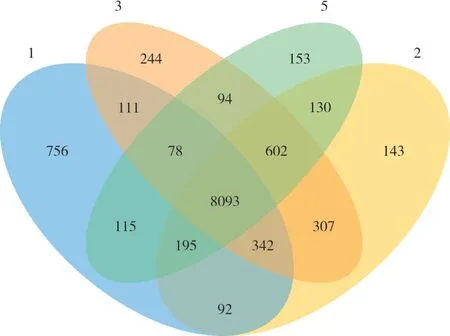
图5 物种分类水平上多样本比较Venn 图Fig.5 The Venn diagram for multiple comparisons on the species classification level
2.5 建库
根据每个样本或多个样本的分类学比对结果,选出优势物种的分类,从整个分类系统上了解样本中优势微生物的进化关系和丰度差异,如图6所示(不同颜色代表不同的样品,颜色的扇形面积越大,说明在该分支上该样品的丰度越高。支点附近分别为该分类名称和其对应平均丰度数值)。根据差异和样本的物种分类结果,将其转化为可供参考的校园观赏植物根际微生物资源信息库,为以后微生物的采样分离研究提供理论依据。
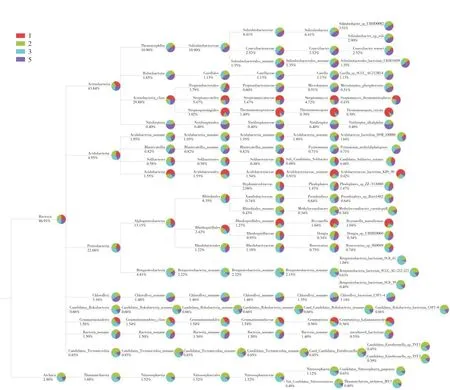
图6 所有样品分类学系统组成树状图Fig.6 The taxonomic system of all samples consists of a tree diagram
2.6 碳水化合物的活性酶
碳水化合物活性酶(Carbohydrate-active enzymes,CAZymes)参与了复杂碳水化合物和糖复合物的组装和分解[16]。本试验仅对微生物的碳水化合物的活性酶进行了分析,包括能催化碳水化合物降解、修饰、以及生物合成的相关酶系家族。其包含五个主要分类:糖苷水解酶(Glycoside Hydrolases,GHs)、糖基转移酶(GlycosylTransferases,GTs)、多糖裂解酶(Polysaccharide Lyases, PLs)和糖类酯解酶(Carbohydrate Esterases, CEs)、氧化还原酶(Auxiliary Activities,AAs)。此外,还包含与碳水化合物结合结构域 (Carbohydrate-Binding Modules,CBMs)[16]。由图7 可见(从左到右,从上到下,样本编号分别为1号日本樱花,2号枫杨,3号石楠,5号夹竹桃),1号日本樱花、2 号枫杨、3 号石楠和5 号夹竹桃根际四种土壤样品中糖苷水解酶、糖基转移酶、糖类酯解酶相关基因所占序列数较多,是大部分菌种生长所必须的基因。
3 讨论与结论
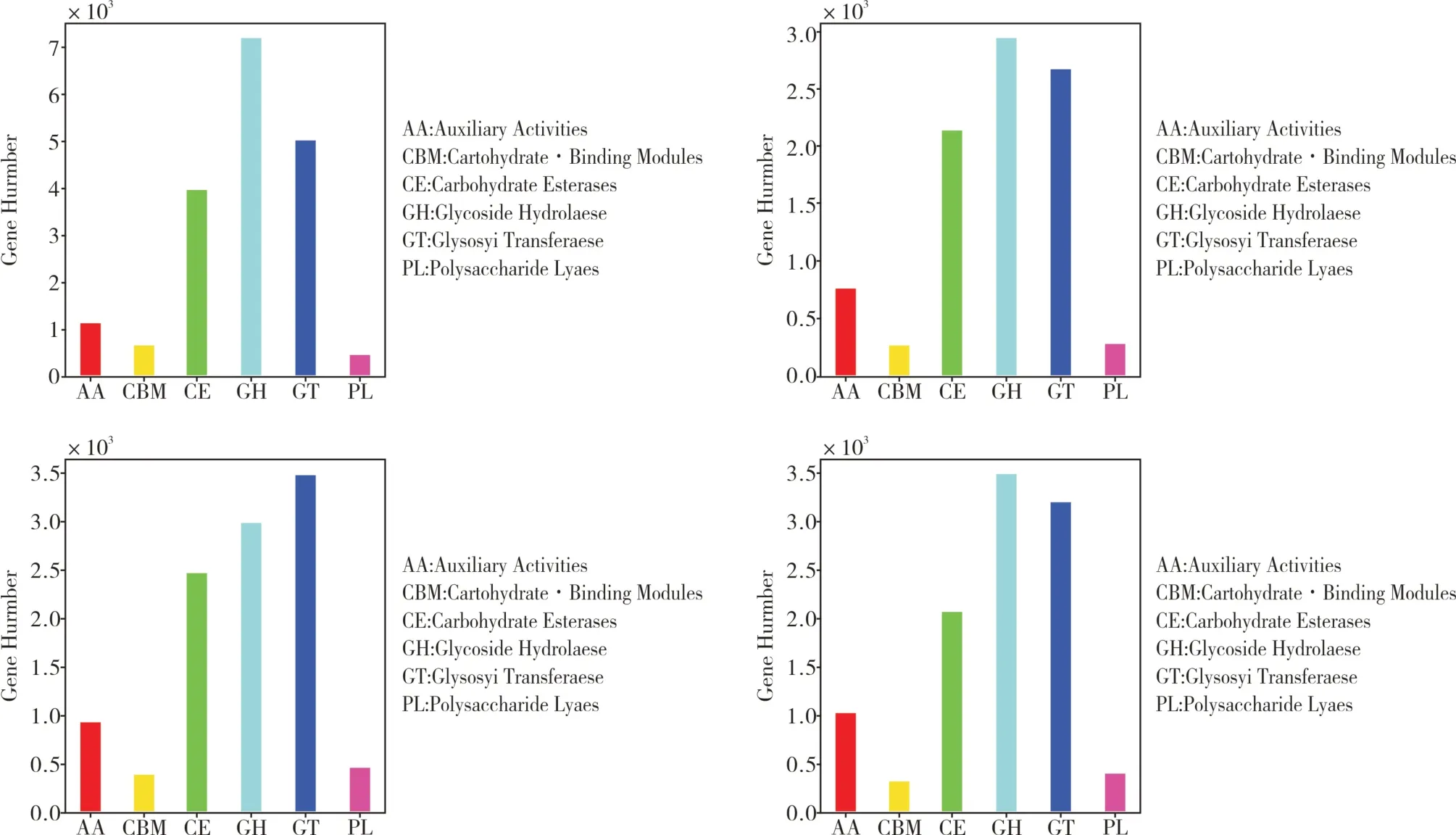
图7 碳水化合物的活性酶CAZymes 功能分类统计柱状图Fig.7 CAZymes functional Classification histogram
植物根际土壤中聚集着大量微生物,数量巨大,种类丰富,其中有有益微生物,也有病原微生物。传统微生物提取技术对于菌种的分离获取有很大的局限,能分离出的菌种数占土壤总的菌种数比例极低。细菌、真菌、放线菌是土壤中的主要微生物,但不同植物种类或品种、土壤条件和环境气候条件会形成的特定的微生态系统,导致植物根际微生物群落结构发生改变。土壤微生物对土壤健康状况也有重大影响[17],根际微生物同样可以分泌一些物质[18],会影响根际土壤的理化性质,同时根际环境也会影响根际微生物的定殖。根系分泌物中含有丰富的糖类、氨基酸、维生素等,能为根际微生物的生长和繁殖提供充足的碳源、氮源和其他一些营养元素,同时,根际分泌物也通过各种途径影响着土壤微生物的数量、种类以及在土壤中的分布[19]。根系土壤中蕴含着丰富的微生物资源,碳水化合物的活性酶(CAZymes)对碳水化合物代谢具有很重要作用,具有潜在的应用价值。但目前人们对根系微生物的基因组、代谢、多样性及其与植物根部之间的关系所知甚少[20]。在研究影响观赏树种生长因素的时候,不可忽略根际土壤微生物菌落结构的影响。未来将在宏基因组数据的指导下,可以有针对性的对土壤菌种进行进一步的提取分离鉴定,有效率地进行相关酶学检测,系统地揭示微生物的生理代谢途径成为可能。同时,针对样品的微生物的群落结构、代谢功能等特点,对宏基因组数据进行进一步挖掘,可以更有效地寻找根系微生物中存在潜在的联系及其与植物间的互作机制。
同为校园生境中日本樱花、石楠、枫杨、银杏、夹竹桃、紫楠六种植物根系土壤微生物菌群结构有明显差异,可能不同植物的根际分泌物影响着土壤微生物的数量、菌群结构和代谢功能。根据观赏植物根际土壤微生物的分支及丰富度初步建立了校园菌种库,后续可根据此进行微生物的功能研究。不同植物根际土壤微生物菌群结构不同,为探讨根际土壤微生物与植物生长关系提供了参考。
