溃疡性结肠炎合并非酒精性脂肪肝的临床特征及危险因素分析
2021-04-06王琛潘鹏贺涛宗蕾孙善明
王琛 潘鹏 贺涛 宗蕾 孙善明
溃疡性结肠炎(Ulcerative colitis,UC)是一种以慢性、复发性为特征,免疫异常介导的结肠疾病,其病变主要限于大肠黏膜与黏膜下层,呈连续性弥漫性分布,其病因目前尚不明确,可能与免疫反应、感染、遗传因素、肠道菌群改变等有关。非酒精性脂肪肝(Non-alcoholic fatty liver disease,NAFLD)为最常见的慢性肝病之一,发病可从单纯性脂肪变性到非酒精性脂肪性肝炎(NASH),再到NASH 相关性肝硬化,进而发展为肝细胞癌。除代谢综合征外,UC 特有的危险因素包括营养不良、肠道炎症、肠道微生物群的改变、类固醇的暴露和药物所致的肝毒性,也可能是NAFLD 的发病机制之一[1]。NAFLD作为UC 相关肝病之一,与亚临床全身性炎症状态和胰岛素抵抗的发展密切相关[2]。UC 通常被认为是一种以吸收不良和消瘦为特征的消耗性疾病,但最近研究表明,UC 患者的NAFLD 患病率相比普通人群高[3]。肠道炎症活动、疾病持续时间、长期使用激素、应用免疫抑制剂、应用生物制剂、肠道手术史可能与UC 发生NAFLD 有关[4]。目前,UC 与NAFLD 的关系尚不明确,本研究采用回顾性调查方法,探讨UC 合并NAFLD 患者的临床特征及UC 发生NAFLD 的危险因素,现报道如下。
1 材料与方法
1.1 一般资料选择2018年10月~2020年3月于潍坊市人民医院住院治疗的 UC 患者,根据是否合并NAFLD 分为NAFLD 组与对照组。共入选159例患者,其中男82 例,女77 例;NAFLD 组42 例,对照组117 例。患者均自愿参与调查研究,并签署知情同意书,本研究经我院伦理委员会审批通过。
1.2 纳入与排除标准纳入标准:①入组患者均完善结肠镜检查,符合《炎症性肠病诊断与治疗的共识意见(2018年,北京)》[5]中对UC 的诊断标准,确诊为UC;②NAFLD 组患者符合《中国非酒精性脂肪性肝病诊疗指南(2010年修订版)》[6]中NAFLD 的诊断标准,确诊为NAFLD;③年龄>18 岁。排除标准:①肝炎病毒标志物阳性;②既往诊断为自身免疫性、胆汁淤积性、遗传性、药物性肝病等慢性肝病;③乙醇摄入量女性>70g/周,男性>140g/周;④肠内营养;⑤妊娠与哺乳者。
1.3 方法收集患者入院时性别、年龄、吸烟史、糖尿病史、高血压史、冠心病史、激素应用史、结肠镜表现等一般资料,并抽取晨起空腹静脉血,应用全自动生化分析仪分析谷草转氨酶(AST)、谷丙转氨酶(ALT)、谷氨酰转肽酶(GGT)、白细胞(WBC)、血红蛋白(Hb)、血小板(PLT)、C 反应蛋白(CRP)、血沉(ESR)、高密度脂蛋白(HDL)、甘油三酯(TG)、总胆固醇(CHOL)。UC 病变范围采用蒙特利尔分型,UC活动性采用改良Mayo 评分系统。
1.4 统计学方法采用SPSS 21.0 统计学软件处理数据。呈正态分布的计量资料以±s表示,两组间比较采用t检验;非正态分布的计量资料以M(P25,P75)表示,两组间比较采用秩和检验;计数资料以率(%)表示,采用χ2检验;多因素分析采用二元Logistic 回归分析。P<0.05 表示差异有统计学意义。
2 结果
2.1 一般资料比较UC 患者NAFLD 的发生率为26.42%。在年龄、性别、吸烟史、冠心病、激素应用史、病变范围、Mayo 评分、GGT、WBC、PLT、Hb、CRP、HDL、TG 方面,NAFLD 组与对照组比较差异均无统计学意义(P>0.05);在糖尿病、高血压、AST、ALT、ESR、CHOL 方面,NAFLD 组与对照组比较差异有统计学意义(P<0.05)。见表1。
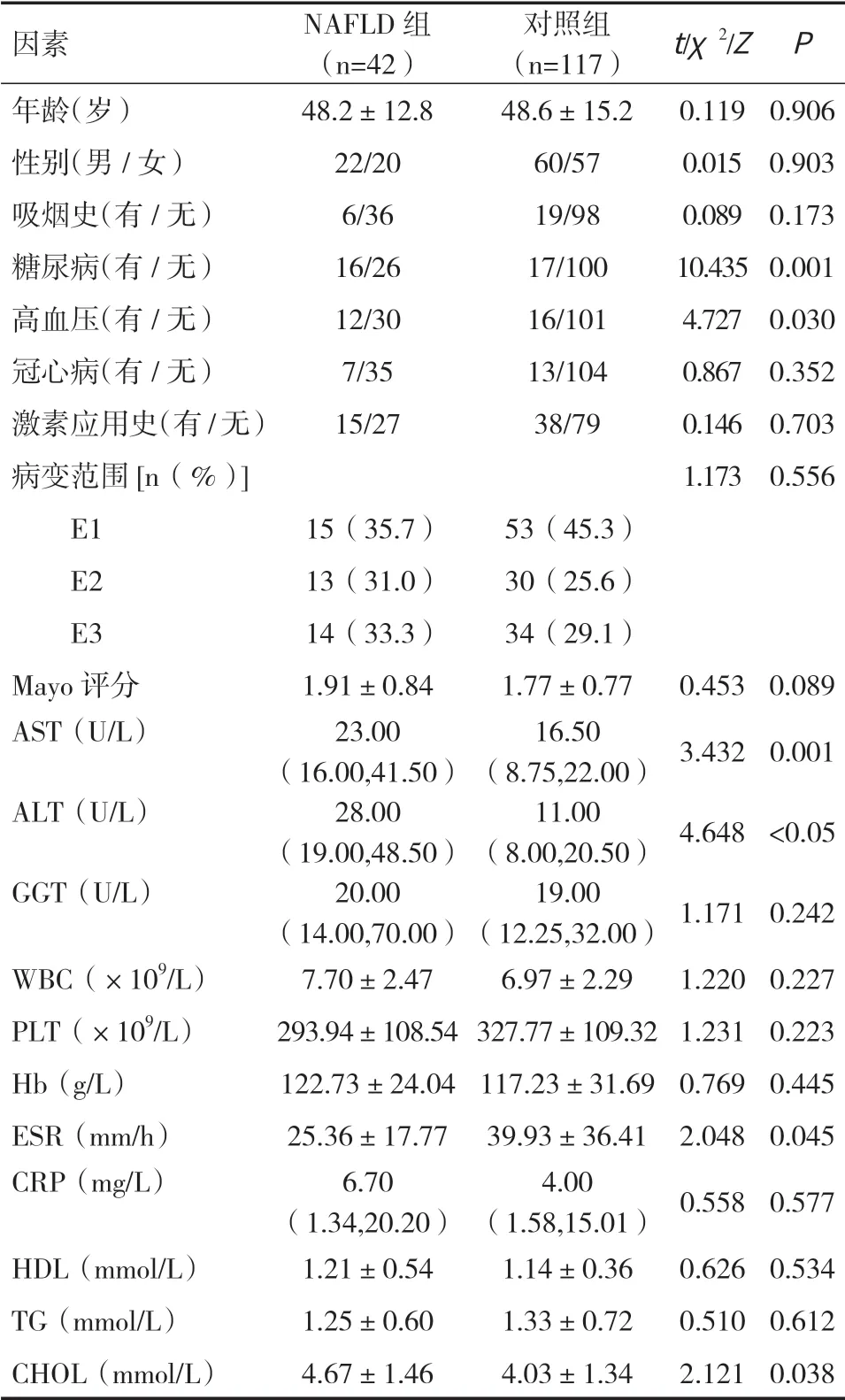
表1 两组一般资料比较
2.2 Logistic 回归分析结果对糖尿病、高血压、AST、ALT、ESR、CHOL 进一步行多因素Logistic 回归分析,结果显示合并糖尿病、高AST、高ALT 是UC 发生NAFLD 的危险因素。见表2。

表2 UC 发生NAFLD 的Logistic 回归分析
3 讨论
全球UC 的患病率为5.50/10 万~24.30/10 万,其中北美和欧洲等发达地区UC 的患病率较高,约24.30/10 万和19.20/10 万,亚洲和中东地区的UC患病率较低,约为6.30/10 万,而中国大陆地区UC的患病率约为11.60/10 万[7,8]。随着人们生活水平的提高,NAFLD 发病率逐年上升,由于人群和地域的不同,NAFLD 的发病率也存在较大差异[9]。一项来自我国的研究表明,随着年龄的增高NAFLD的发病率逐渐升高, 而<60 岁男性的发病率明显高于女性[8]。全球NAFLD 的平均患病率已经达到25%[10]。横断面研究表明,UC 患者中NAFLD 的患病率为6.2%~40%[11]。
目前,UC 与NAFLD 的关系尚不明确,结合现有研究可知两者存在一定的相关性。1998年马歇尔首次提出了“肠-肝轴”的概念,表明了肠道与肝脏的密切相互作用[12]。有研究表明,NAFLD 的发生与肠道菌群紊乱有关,如高脂饮食会降低菌群多样性,使普氏菌属数量减少,厚壁菌门与拟杆菌门的比率增加,使肠道吸收能力提高。肠道微生物通过参与难消化食物的发酵,与肠黏膜免疫系统相互作用,影响肠道屏障功能,导致信号改变,参与NAFLD 的发生。同时,微生物代谢产物不仅影响肠道内的信号转导途径,而且影响肝脏的代谢[12]。而肠道微生物的改变,可能影响自身免疫反应,UC 作为自身免疫性疾病,与NAFLD 患者均存在肠道菌群紊乱,从而使两者存在一定相关性。UC 较长的病程增加了患NAFLD 的风险,活性氧的氧化应激也可能是NAFLD 和UC 的共同致病因素[11]。
本研究通过分析发现,UC 合并NAFLD 患者同时合并糖尿病、高血压的发病率较单纯UC 患者高,并且AST、ALT、CHOL 水平也较单纯UC 患者高,ESR 水平较单纯UC 患者低,这些因素可能与NAFLD 的发生有潜在的联系。NAFLD 已经被证明是在没有血清转氨酶升高的情况下发展起来的,所以UC 患者转氨酶升高应高度重视是否合并NAFLD。Mariabeatrice 等[13]研究表明,代谢综合征、糖尿病、空腹血糖和腹围是UC 合并NAFLD 的危险因素。Iannone 等[14]研究表明,在UC 患者中,合并NAFLD 与胰岛素抵抗、腰围、BMI、GGT、空腹血糖直接相关。有研究阐述UC 患者应用生物制剂,特别是肿瘤坏死因子抑制剂在NAFLD 发展中的作用,有不同结果。Glassner 等[15]研究表明,应用生物制剂,如肿瘤坏死因子抑制剂、皮质类固醇、免疫调节剂与NAFLD 的发展无明显关系,但UC 合并NAFLD 患者的生物制剂应用减少。而有研究表明肿瘤坏死因子抑制剂通过减轻UC患者的炎症状态,促进粘膜愈合,使营养吸收增加和食欲增强,从而导致体重增加,出现肥胖相关炎症和代谢综合征[16]。来自活性氧的氧化应激也可能是导致NAFLD 和IBD 共存的常见致病因素,手术史或许也与NAFLD的发生独立相关[17]。Verdugo-Meza 等[18]认为,UC患者肠道屏障的破坏增加了微生物在肠粘膜下的浸润,从而增加了肠源性代谢物从肠道转移到肝脏和胰腺的可能性。Jovanovic 等[19]的一项横断面研究表明,合并代谢综合征的UC 患者其临床与组织学表现较轻,在代谢综合征患者中,促炎症介质Gal-3和IL-10 水平较高,这可能是限制UC 炎症过程和组织损伤的机制之一。本研究表明,合并糖尿病、高AST、高ALT 是UC 发生NAFLD 的危险因素,其中糖尿病作为危险因素,与上述研究结果一致。
综上所述,本研究发现有糖尿病、高AST、高ALT 为UC 发生NAFLD 的危险因素,因此,对于UC 患者应注意监测血糖及AST、ALT 水平,及时筛查患者是否有NAFLD,为疾病预防、诊断、治疗提供一定依据。但本研究样本量小,纳入指标不全面,对患者的病程、治疗过程、肠外表现、饮食等未分析,存在一定局限性,仍需进一步研究。
