免疫检查点抑制剂相关不良反应的管理专家共识
2021-04-06牛志成汪治宇
牛志成,王 雷,汪治宇*
(1.河北医科大学第四医院肿瘤免疫科,河北 石家庄 050011;2.河北医科大学第四医院胸二科,河北 石家庄 050011)
免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)通过阻断免疫检查点通路,重新激活T细胞介导的抗肿瘤免疫,逆转免疫逃逸现象,从而促进肿瘤细胞死亡[1]。目前被批准用于治疗晚期恶性肿瘤的ICIs主要包括细胞毒性T淋巴细胞抗原4(cytotoxic T lymphocyte antigen 4,CTLA-4)抑制剂[伊匹木单抗(Ipilimumab)]、程序性细胞死亡(programmed cell death 1,PD-1)抑制剂[纳武利尤单抗(Nivolumab)和帕博利珠单抗(Pembrolizumab)]、程序性细胞死亡1配体(programmed cell death ligand-1,PD-L1)抑制剂[阿替利珠单抗(Atezolizumab)和德瓦鲁单抗(Durvalumab)]。除此之外,PD-1抑制剂还包括特瑞普利单抗、卡瑞利珠单抗、信迪利单抗和替雷利珠单抗。这些药物已被证明在晚期肺癌、恶性黑色素瘤、泌尿系统肿瘤、胃肠道肿瘤等多种恶性肿瘤中有效。除此之外,全世界仍有上百个关于ICIs治疗不同恶性肿瘤的临床试验正在开展,这将为恶性肿瘤的治疗策略带来新的选择。随着ICIs药物的不断发展以及药物可及性的不断提高,免疫治疗相关不良反应(immune-related adverse events,irAEs)也逐渐被人们发现和关注。但临床实践中对ICIs所致的irAEs的管理有待进一步加强。因此,本研究参考相关临床数据以及已发表的指南,包括欧洲肿瘤学大会、癌症免疫治疗协会毒性管理工作组、国家综合癌症网络(National Comprehensive Cancer Network,NCCN)指南和中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)指南,对irAEs进行总结讨论,以便更好地指导临床上ICIs的应用。
1 irAEs概述
1.1irAEs的分级 肿瘤的治疗势必会发生相关的不良事件。不良事件通用术语标准(common terminology criteria for adverse events,CTCAE)是由美国国家癌症研究所癌症治疗评估计划制定的,是对治疗的患者所经历的不良事件进行定义和分级的多学科协同努力的全球标准。CTCAE分级的依据是不良事件对临床管理、日常生活活动、药物剂量调整或停药的潜在影响。本研究根据CTCAE标准,将毒性大致分为五个级别[2]见表1。

表1 药物不良反应分级
1.2irAEs的流行病学研究 CTLA-4和PD-1除了在限制肿瘤免疫应答方面的作用外,还是重要的免疫检查点,有助于调节组织特异性自我抗原的外周耐受性。对这些检查点的治疗性封锁破坏了耐受性和免疫性之间的平衡。因此,受irAEs影响的器官系统范围很广,几乎可影响所有器官,但是发生的频率和严重程度各不相同[3]。其中最常见的irAEs是疲劳、瘙痒、腹泻和皮疹[4]。疲劳的出现率为16%~20%,瘙痒和皮疹的发生概率大约为10.6%和9.3%。irAEs大部分为轻度至中度,停药之后可自行缓解,无需特殊治疗,但有时会出现一些严重的不良反应,如免疫相关性肺炎、免疫相关性心肌炎、免疫相关性神经毒性以及致死性腹泻等,危及患者的生命安全(CTLA-4抑制剂:1.08%;PD-1抑制剂:0.36%;PD-L1抑制剂:0.38%)。CTLA-4抑制剂导致的死亡多由于结肠炎引起(70%);而PD-1抑制剂和PD-L1抑制剂导致的死亡常见于肺炎(35%)、肝炎(22%)及神经毒性(15%)[5]。CTLA-4抑制剂与PD-1抑制剂联合使用时毒性增加,死亡率可达1.23%,其中最常见的死亡原因为结肠炎(37%)和心肌炎(25%)。值得注意的是,心脏毒性如心肌炎,虽然发生率低(纳武利尤单抗为0.06%;纳武利尤单抗联合伊匹木单抗为0.27%),但一旦发生,其病死率高达50%[6]。
不同类型的ICIs引起irAEs的发生率和毒性谱都有所区别。在一项对36个Ⅱ期和Ⅲ期随机对照试验数据的系统回顾和meta分析中,通过比较几中不同的ICI药物导致irAEs发现:阿替利珠单抗在所有级别和3级不良事件中不良事件风险最低(分别为66.4%和15.1%),其次是纳武利尤单抗(1.8%和14.1%)、帕博利珠单抗(75.1%和19.8%)和伊匹木单抗(86.8%和28.6%)[7]。CTLA-4抑制剂与PD-1抑制剂常见的毒性类型有所区别。接受CTLA-4抑制剂治疗的患者更容易出现结肠炎、垂体炎和皮疹,而接受PD-1抑制剂治疗的患者更易出现肺炎、甲状腺炎[8]。不同的PD-1/PD-L1抑制剂毒性谱也存在区别,纳武利尤单抗更常见导致内分泌毒性,帕博利珠单抗所致关节炎、肺及肝脏毒性更常见,而PD-L1单抗阿替利珠单抗引起的甲状腺功能减退、恶心、呕吐的风险更容易。国产PD-1单抗卡瑞利珠单抗则容易引起反应性皮肤毛细血管增生症[9]。
在用于不同类型的肿瘤治疗时,同一种ICIs所致irAEs毒性谱不同。一项系统综述和meta分析根据肿瘤类型和ICIs等级确定了irAE的类型和发生率。该研究对比了PD-1抑制剂在肺癌、黑色素瘤和肾癌三大瘤种的irAEs发生率,结果发现,肺癌比黑色素瘤患者消化道和皮肤毒性发生可能更低、肺炎发生可能性更高,肾癌比黑色素瘤患者关节炎和肌痛的发生可能更低,而常发生肺炎和呼吸困难[8]。
在发生时间上,ICIs相关的毒性可以在接受治疗后的任何事件发生,但通常出现在治疗后的1~6个月,胃肠道及皮肤毒性往往最早出现[10]。但是有些irAEs会在停药数月甚至数年后才表现出来。因此临床医生必须对 irAEs 的不同临床表现以及延迟性的irAEs保持高度警惕。
2 irAEs的管理
2.1基线评估 在ICIs治疗开始之前,建议进行严格的临床检查,包括对每个患者的基线情况的评估。基线的影像学检查对于判断甲状腺、垂体和肺等器官的毒性非常有帮助。有报道显示,影像学检查可及时发现74%的irAEs。任何新出现的症状或已存在症状的恶化必须仔细监测,必要时还应探索病因,排除继续进行免疫治疗可能导致病情恶化的可能。为了限制其持续时间和严重程度,早期识别和治疗免疫相关不良事件是必要的。因此,在基线(开始免疫治疗前)进行的体格检查、实验室检查和影像学检查将作为治疗过程中发生的任何临床、生物学或影像学异常的参考[11]。在免疫治疗前需要完善的基线检查,见表2。

表2 启动免疫检查点抑制剂治疗前的基线检查
2.2毒性分级管理原则 临床上处理毒性是按照不良反应事件分级的原则进行管理的。根据不良事件的严重程度,可能暂停免疫治疗和(或)使用糖皮质激素。危及生命或复发的严重不良事件可导致终止免疫治疗。一般来说,对于轻度的不良反应,可以选择口服糖皮质激素,但是对于有致死性风险的不良反应,如腹泻、心肌炎等,要尽早使用大剂量的静脉滴注激素,并且要延长激素的使用时间。如果需要用糖皮质激素进行长期免疫抑制来治疗严重的不良反应,患者可以接受抗生素预防,以防止机会性感染。激素减量也要缓慢进行,最好可以大于6~8周。剂量减少过快可能导致复发或不良反应恶化[12]。毒性分级管理的大致原则见表3。
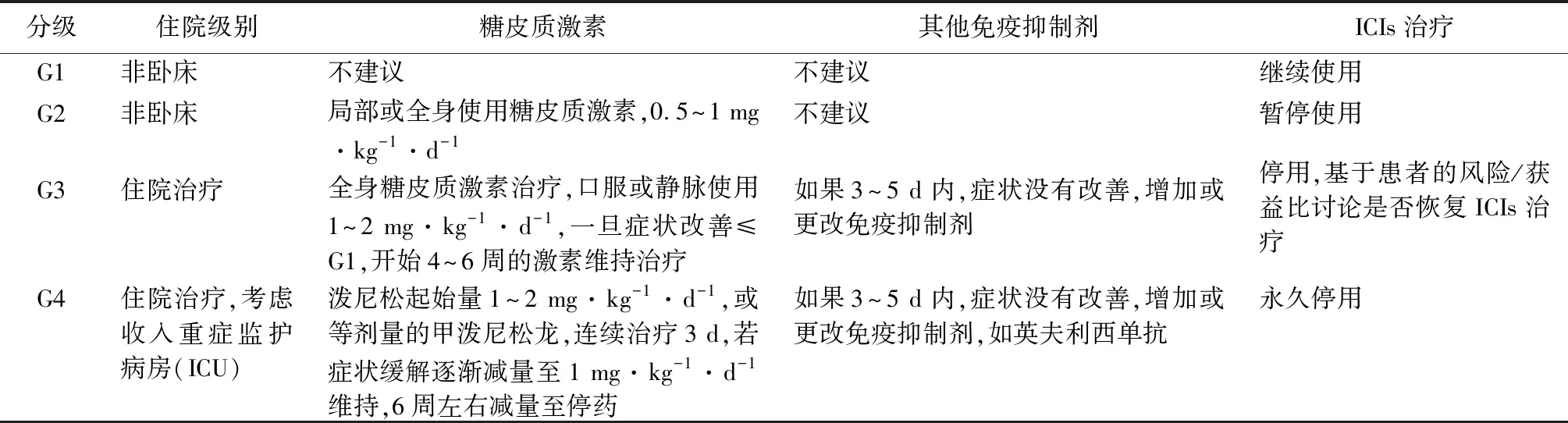
表3 毒性分级管理原则
在整个免疫治疗期间,都应密切监测患者,因为irAEs可能在任何时候发生,包括在治疗开始时,在治疗期间,甚至在治疗结束后。建议在停止免疫治疗后继续监测1年。由于其免疫抑制作用,糖皮质激素可能降低免疫治疗的疗效。但是初步数据似乎表明,在使用纳武利尤单抗的黑色素瘤中观察到,接受全身免疫抑制治疗的患者与未接受免疫抑制治疗的患者表现出类似的缓解时间和客观缓解率。虽然有研究显示,应用肾上腺糖皮质激素处理irAEs并未降低免疫治疗的效果,但是仍不建议预防性使用糖皮质激素或免疫制剂药物[13-15]。针对具体的不良反应的管理方法,可以参考NCCN指南、CSCO指南等。
3 常见的irAEs
3.1皮肤irAEs 在所有接受ICIs治疗的患者中,有三分之一到一半以上的患者受到皮肤毒性的影响。皮疹、瘙痒和白癜风是最广泛的皮肤毒性,并且在那些接受抗CTLA-4抗体和抗PD-1抗体的患者中更为常见。ICIs联合治疗与较单药治疗更易发生皮肤相关毒性,其发生率和严重程度均高于单药治疗。部分研究认为,皮肤irAEs预示PD-1抑制剂治疗效果可能有效;白癜风的发生与较好的肿瘤反应和晚期黑色素瘤患者的预后有关[16]。皮肤 irAEs发生的中位时间大约为5周。多数皮肤毒性疗程较为短暂,5~6周即可痊愈[7],基本不影响ICIs的继续使用。
大部分ICIs引起的皮肤红斑为黄斑丘疹,体表面积大约为30%,时而有滤泡性、脓疱性、水疱性和痤疮样等表现[7]。其他皮肤表现包括ICIs诱导的皮肌炎、药物反应伴嗜酸粒细胞增多和系统症状(drug response with eosinophilia and systemic symptoms,DRESS)和肉芽肿、地衣样、脂膜炎样和狼疮样反应[14-15]等,并不常见。反应性皮肤毛细血管增生症(reactive cutaneous capillary endothelial proliferation,RCCEP)在卡瑞利珠单抗中时常发生,病理学证实RCCEP是一种良性的毛细血管增殖性病变。在临床上,RCCEP的形态学表现大致分为“红痣型”、“珍珠型”、“桑葚型”、“斑片型”和“瘤样型”5种,其中,“红痣型”和“珍珠型”最为多见[17]。需要注意的是,既往有银屑病史或有银屑病家族史的患者,在接受ICIs治疗后,会出现银屑病加重的情况。
3.2内分泌系统irAEs 甲状腺毒性是内分泌系统最常见的irAEs。虽然甲状腺irAEs常见,但出现3级以上的概率很低。而原发性肾上腺功能减退、垂体炎这些不良事件虽然少见,但是却有20%~35%的可能性出现3级以上irAEs。内分泌毒性相较于其他毒性,出现的时间较晚,但ICIs联合治疗所致的内分泌毒性会显著提前。
甲状腺功能障碍通常与抗PD-1抑制剂相关。研究发现,接受抗PD-1抗体治疗的患者中,近20%的患者伴有甲状腺功能障碍,这通常发生在治疗的早期,中位发病时间为首次治疗后6周。大多数甲状腺病变无症状,表现为轻度甲状腺毒症或与破坏性甲状腺炎相关的原发性甲状腺功能减退,或较少见的与自身免疫性甲状腺疾病(Graves病)相关的甲状腺毒症。对于出现甲状腺功能亢进的患者可以继续使用ICIs、β受体阻滞剂可以用于缓解症状。对于持续性甲状腺功能减退的患者,应在排除肾上腺功能不全后开始使用左甲状腺素替代。甲状腺功能恢复后,大部分患者是完全康复(真甲状腺炎),但少数患者会发展为其他持续性甲状腺功能减退(桥本样甲状腺炎)[7]。
垂体炎在接受伊匹木单抗的患者中更常见。虽然发病率较低,但如果没有及时发现或者尽早干预,可能导致致死性的严重后果。当接受ICIs的患者出现疲劳、虚弱、头痛、视觉障碍、低血压和恶心的发展或恶化,应考虑为垂体炎,并需要立即评估垂体功能状态。在病程早期应进行垂体MRI检查,以消除垂体转移,作为鉴别诊断。中枢(垂体)来源的肾上腺功能不全通常是持续性的,即使在垂体炎症消退后也难以恢复功能。然而,通过适当的治疗,有三分之一到一半的患者可以恢复垂体甲状腺轴的功能,而有一半的患者能恢复性腺轴。但很少患者会出现尿崩症[7]。
3.3消化系统不良反应 在消化道方面,不良反应主要表现为腹泻/结肠炎,发生率为9.47%,3级及以上腹泻/结肠炎发生率为0.59%,但常常是导致ICIs治疗中断的原因。在接受伊匹木单抗治疗的患者中,结肠炎是最常见的irAE,发生率为10%~20%。大多数病变累及乙状结肠和直肠。内镜检查通常显示黏膜弥漫性溃疡,以及可能影响整个结肠的水肿。结肠活检标本的检查显示典型的淋巴细胞和中性粒细胞混合浸润与凋亡的黏膜上皮细胞和隐窝脓肿。浆细胞和嗜酸粒细胞的存在也很常见。然而,由于该irAEs的急性性质,与炎症性肠病的病理相反,上皮的结构通常被保留下来。即使没有肉眼可见的疾病,也应获得活检样本,以评估潜在的显微镜下结肠炎的可能性[7]。
肝脏irAEs通常在接受伊匹木单抗和接受抗PD-1抗体的患者中发病率相似(5%~10%),但接受伊匹木单抗的患者更倾向发生严重的肝炎。肝脏毒性主要表现为单纯的转氨酶升高,若是合并高胆红素血症和凝血功能障碍,常常提示预后不佳。肝脏irAEs的典型组织学特征是全小叶以淋巴细胞为主混合免疫细胞浸润,有时会有局灶性合并坏死、胆汁淤积与门脉单核细胞浸润等征象[18-19]。根据目前的指南,对于转氨酶水平升高2级(定义为3~5倍正常值)的患者应暂停ICIs,当转氨酶水平超过这一临界值时应永久停止ICIs。所有转氨酶水平中度至重度升高(大于正常值上限的3倍)的患者都应获得肝活检样本,以排除其他原因,如自身免疫性肝炎[7]。
3.4呼吸系统irAEs 接受PD-1抑制剂的患者比那些接受CTLA-4抑制剂的患者更有可能发生免疫相关性肺炎,并且常常危及生命[20]。免疫相关性肺炎的高危人群包括:接受EGFR-TKI联合ICIs治疗的驱动基因敏感突变阳性的非小细胞肺癌患者和既往存在慢性肺部疾病的患者[21-22]。免疫相关性肺炎的临床表现为发热、咳嗽、胸痛、呼吸困难,严重时会出现呼吸衰竭。影像学表现各异,可表现为非特异性间质性肺炎的隐原性组织性肺炎(cryptogenic organizing pneumonia,COP)、超敏性肺炎、急性间质性肺炎、结节型反应和磨玻璃样肺炎[23-24]。支气管肺泡灌洗可显示淋巴细胞增多,结节样病变患者中可发现CD4+T细胞与CD8+T细胞比值倒置[7]。在所有肺炎病例中,72%的患者为1~2级,大部分需要停药和免疫抑制治疗才能得到缓解或治愈[22]。
3.5类风湿性/骨骼肌irAEs 2017年,Naidoo等[25]发表了一篇关于风湿性和肌肉骨骼关节炎的综述,报告了关节痛和肌痛的发生率有相当大的差异,分别从4%~22%不等,可见临床上诊断这类疾病非常具有挑战性。类风湿性/骨骼肌毒性的临床表现常包括:关节疼痛、肿胀;晨僵持续约半小时。关于此类毒性的治疗,包括局部治疗,关节内使用低剂量的糖皮质激素以及免疫抑制剂的使用,比如甲氨蝶呤和英夫利西单抗的使用。建议所有中度症状以上的患者转风湿科治疗。
4 罕见不良反应
4.1心脏毒性 在一项回顾性研究中,研究人员报道了ICIs引发的心肌炎的患病率为1.14%。但由于与该irAEs存在高死亡风险,需要对此更加警惕。ICIs引起的心肌炎的临床表现多种多样,主要包括胸痛、心律不齐、急性呼吸困难和(或)急性循环衰竭。组织学解剖检查显示,CD8+T细胞浸润为主,同时有一些CD4+T细胞和稀疏分布的B细胞。接受ICIs治疗的患者出现任何心功能不全或胸部不适的迹象都应进行全面的心脏评估。此外,在开始使用ICIs治疗前,建议进行基线心电图检查、血清肌钙蛋白测定以及心脏超声等检查。确诊为心肌炎的患者应该尽早接受大剂量激素治疗,并立刻终止ICIs治疗[26]。
4.2神经系统irAEs 免疫相关性神经系统毒性不常见,接受抗PD-1抗体的患者发生率为6.1%,接受抗CTLA-4抑制剂的患者发生率为3.8%[27]。总的来说,有这些症状的患者通常出现在开始治疗的6周内(范围为2~12周)。主要包括:重症肌无力、无菌性脑膜炎/脑炎、吉兰-巴雷综合征等。重症肌无力或坏死性肌炎常见的症状表现为肌痛,包括上睑下垂,复视伴肢带肌营养不良和轴向(主要是颈部)无力。常规需要检查血清肌酸激酶和肌钙蛋白水平。肌肉活检标本的肌内膜和肌膜周区域经常被巨噬细胞密集浸润,并有CD8+、CD4+和CD20+免疫细胞聚集。神经肌电图和肌肉活检样本的检查也是区分重症肌无力和坏死性肌炎的有用方法。脑炎和(或)无菌性脑膜炎的患者会有中枢神经系统症状,如癫痫、精神错乱、共济失调甚至失忆,应进行广泛的诊断检查,以排除感染性、代谢性和(或)毒性并发症、副肿瘤现象以及中枢神经转移的可能性。脑脊液检查可显示多克隆淋巴细胞增多和蛋白质浓度升高。脑部MRI上经常没有明显的异常[28-29]。
4.3血液系统irAEs 与其他抗肿瘤治疗相比,接受ICIs的患者的血液疾病发病率并不高[30]。尽管这种现象很罕见,但却有多种表现形式:主要包括抗体介导的溶血性贫血、血栓性血小板减少性紫癜、获得性血友病A、自身免疫性中性粒细胞减少症和自身免疫性血小板减少症等。噬血细胞淋巴细胞增多症是一种罕见但非常严重的并发症,由于病死率高而值得注意。因此,当出现伴有发热、细胞减少和脾肿大的严重炎症综合征的患者应进行全面的临床检查,包括骨髓细胞学和(或)活检样本判断是否存在噬血细胞迹象[7,31]。
除此之外,罕见的irAEs还包括肾脏毒性以及眼毒性等,因发生率较低,这里不再赘述。
5 特殊人群的irAEs
5.1自身免疫性疾病患者 在涉及ICIs治疗的临床试验中,患有自身免疫性疾病的患者通常会被排除在外,因为此类患者发生严重irAEs的风险更高。然而,三项回顾性研究的数据表明,在同时患有自身免疫性疾病的黑色素瘤或非小细胞肺癌患者中,约50%的患者可以安全使用ICIs,无需停止治疗,只有少数患者自身免疫性疾病恶化,永久性停用ICIs也是罕见的。此外,在排除已有自身免疫性疾病患者的临床试验中,3级irAEs的发病率范围为7%~15%,这与一项回顾性分析数据中报道的56例接受了抗PD-1抗体且已有自身免疫性疾病的非小细胞肺癌患者的发病率相似(11%)[32]。由此可见,患有自身免疫性疾病患者接受ICIs治疗,不良反应是可控的,但仍需要对这部分患者进行密切监测。
5.2慢性病毒性肝炎患者 在KEYNOTE-224临床试验中,评估了帕博利珠单抗治疗肝细胞癌的疗效。研究发现接受免疫治疗的患者未出现乙型肝炎病毒或丙型肝炎病毒的发作,且报道的最常见的免疫介导不良事件是甲状腺功能减退、肾上腺功能不全和低频率甲状腺炎,这与免疫治疗在其他癌症类型中所看到的效果一致[33]。同样的结果在一项针对25例丙型肝炎病毒相关肝细胞癌患者的小型研究中,用CTLA-4抑制剂显示出抗肿瘤作用以及可控制的毒性[34]。在一项Ⅰ~Ⅱ期临床试验中,PD-1抑制剂纳武利尤单抗在乙型肝炎病毒和丙型肝炎病毒感染和未感染的晚期肝细胞癌患者中也显示了良好的疗效和可耐受的安全性[35]。因此可见肝细胞癌合并病毒性肝炎(携带乙型肝炎病毒或丙型肝炎病毒)的患者使用ICIs,在严格控制病毒性肝炎的前提下,疗效与未感染者无显著差别。
5.3妊娠期患者 由于胎盘外膜高度表达PD-L1,妊娠期患者如果接受ICIs治疗,有可能打破免疫耐受,导致流产、死胎等风险,特别是在妊娠中期和晚期。因此,对妊娠期肿瘤患者的治疗决策面临巨大挑战,因为通过宿主对肿瘤的反应来提供成功的免疫治疗,同时将胎儿从这些反应中拯救出来,在生理学上似乎是不可行的。但是有研究报道了妊娠期恶性黑色素瘤患者接受CTLA-4抑制剂治疗后,成功分娩的病案报道[36-37]。尽管如此,我们仍不推荐妊娠期患者常规使用ICIs治疗。
5.4老年患者 随着人口老龄化和越来越多的老年癌症患者出现,了解ICIs在老年癌症患者中的风险和益处是非常必要的。一项回顾性研究表明,在≥80岁的患者中,接受ICIs治疗的无进展生存期和总生存期都低于其他年龄组,但在毒性方面没有差异。甲状腺炎、皮炎和肺炎是最常见的疾病,这与其他研究结果一致[38]。因此常规推荐老年患者使用ICIs治疗,但是慎重选择ICIs联合治疗。
6 重启ICIs治疗
irAEs恢复后考虑再次进行ICIs治疗是一种常见的临床问题,但再治疗的安全性和益处尚不清楚。需要根据患者的临床背景和具体临床需求,小心谨慎地作出重启ICIs的决定。一项临床研究对比了接受抗PD-L1治疗的患者(再治疗组)和停止治疗的患者(停止治疗组)的晚期肺癌患者的生存获益,结果显示:在出现irAEs前未观察到部分反应的患者中,再治疗组的无进展生存期和总生存期更长。相反,对于那些在irAEs之前有客观反应的患者,再治疗组和停止治疗组的无进展生存期和总生存期相似。总之,数据表明,对在发作前没有治疗反应的irAEs患者进行再治疗可能会获益[15,39]。而且在重启ICIs治疗后,有50%的可能性会再次出现irAEs[18,40],因此,还要充分考虑到患者的耐受性以及发生irAEs的严重程度。为尽量减少发生率,可以选择不同类型的ICIs治疗药物(如将抗CTLA-4抑制剂改为抗PD-1或PD-L1抑制剂)[41]。
7 总 结
未来几年,肿瘤免疫治疗的发展将继续塑造治疗的格局,新的药物将继续进入临床。这些将改变irAEs的人口统计和流行病学,并加强对有效的毒性管理策略和合格的多学科团队的需求。如果要在肿瘤学这个新的和复杂的领域解决这些新出现的需求,就必须提高认识,培训新一代具有诊断和管理irAEs特殊技能的医生,并鼓励多学科交流来了解它们引起的不良反应类型和发生率。需要进一步探索早期毒性生物标志物以及如何在不影响ICIs疗效的情况下,尽量减少irAEs的发生。只有对不良反应及时有效地控制管理,才能更加安全地进行肿瘤免疫治疗。
