中性粒细胞/淋巴细胞比值对微小病变型肾病发生激素性骨坏死的预测价值
2021-04-04申娅董奕君陈雅卓高静歌盛晓笑肖静赵占正程根阳
申娅,董奕君,陈雅卓,高静歌,盛晓笑,肖静,赵占正,程根阳
近年来微小病变型肾病(minimal change disease,MCD)患病率逐年上升,成为成人肾病综合征的第三大原发性肾脏疾病[1]。中国专家组建议将糖皮质激素(以下简称为激素)用于MCD肾病综合征患者的初始治疗[2];但是,糖皮质激素的使用给患者造成许多不良反应,包括体液及电解质紊乱、影响肌肉骨骼系统、胃肠道反应、皮肤病、代谢紊乱等。目前糖皮质激素诱发的骨坏死发病率不断增高,筛查患者发生激素性骨坏死风险的主要手段为糖皮质激素基因检测,但此方法存在检验耗时及检查费用昂贵等缺点,因此寻找一种新的评估MCD患者发生激素性骨坏死风险的指标具有重要临床意义。
Bhat等[3]研究表明中性粒细胞/淋巴细胞比值(NLR)作为一种简易的参数,能够反映全身炎症情况,从而成为评估疾病预后的有效指标。有研究发现NLR与骨骼系统疾病相关[4−5],但目前尚未见NLR与MCD患者发生激素性骨坏死关系的相关报道。本研究旨在探讨血NLR水平预测MCD患者发生激素性骨坏死的价值。
1 对象与方法
1.1 研究对象及分组选取2014年1月—2019年8月郑州大学第一附属医院肾脏内科经皮肾脏穿刺活检术诊断为MCD的患者作为研究对象。纳入标准:(1)经我院肾穿刺活检证实的MCD患者。(2)年龄≥16岁。排除标准:(1)合并急性感染性疾病、系统性自身免疫性疾病、心血管系统疾病、血液系统疾病、肿瘤等。(2)近3个月内有输血史或服用影响骨代谢药物如巴比妥类、抗惊厥药、膦酸盐、雌激素、降钙素、甲状腺激素、噻嗪类利尿药等。(3)外伤骨折、长期酗酒、肾移植术后等其他因素所致的骨坏死。(4)肾脏活检的肾小球数<10个。(5)临床资料不完整或随访时间<3个月。激素性骨坏死诊断标准:(1)患者有激素应用史,以腹股沟、臀部、大腿或膝关节等部位为主的关节痛,关节屈曲、内旋、外旋活动受限。(2)MRI检查证实骨坏死改变,T1WI显示带状低信号或T2WI显示双线征[6]。最终纳入329例患者,其中45例发生激素性骨坏死。根据受检者工作特征(ROC)曲线确定NLR诊断MCD发生激素性骨坏死的最佳截断值,以截断值为界将研究对象分为低NLR组(NLR≤3.321)262例和高NLR组(NLR>3.321)67例。
1.2 研究方法所有患者从经皮肾脏穿刺活检术诊断为MCD开始随访至发生激素性骨坏死或2019年11月30日。收集患者肾穿刺当次住院的一般资料及实验室检查作为基线资料,包括性别、年龄、血常规、血生化、骨代谢指标、24 h尿蛋白量,以CKD−EPI公式估算肾小球滤过率(eGFR),髋关节及膝关节MRI结果,患者激素累积剂量、累计使用时间,以及合用钙剂、活性维生素D3情况等资料。所有人口学、基线临床资料均由郑州大学第一附属医院数据库获得,相关实验室检查均由本院检验科检测,MRI结果由本院磁共振科至少2位医生核查。
1.3 统计学方法采用SPSS 21.0软件进行统计分析。正态分布的定量资料用x±s表示,组间比较采用t检验,非正态分布的定量资料采用M(P25,P75)表示,组间比较采用Mann−WhitneyU检验;定性资料用例(%)表示,组间比较采用卡方检验。采用Spearman相关分析NLR与MCD患者发生激素性骨坏死之间的相关性。绘制Kaplan−Meier生存曲线,用Log−rank法比较低NLR组和高NLR组间关节生存率的差异。利用多因素Cox回归模型分析MCD患者发生激素性骨坏死的危险因素。P<0.05为差异有统计学意义。
2 结果
2.1 NLR用于诊断MCD发生激素性骨坏死的ROC曲线ROC曲线结果显示NLR诊断MCD患者发生激素性骨坏死的最佳截断值为3.321,敏感度为42.22%,特异度为79.93%,曲线下面积(AUC)为0.615,95%CI为0.524~0.705,见图1。高NLR组发生激素性骨坏死17例(25.37%),较低NLR组的28例(10.69%)明显升高(χ2=9.747,P<0.01)。
2.2 2组间基线资料比较高NLR组的年龄、白细胞计数(WBC)、单核细胞计数(M)、C反应蛋白(CRP)、红细胞沉降率(ESR)、纤维蛋白原、骨钙素(OST)、β胶原特殊序列(β−CTX)、血尿素氮(BUN)及血肌酐(Scr)均较低NLR组高(P<0.05),高NLR组比低NLR组的eGFR降低(P<0.05),见表1。2组激素累积剂量、累计使用时间,以及合用钙剂、活性维生素D3情况比较差异无统计学意义,见表2。
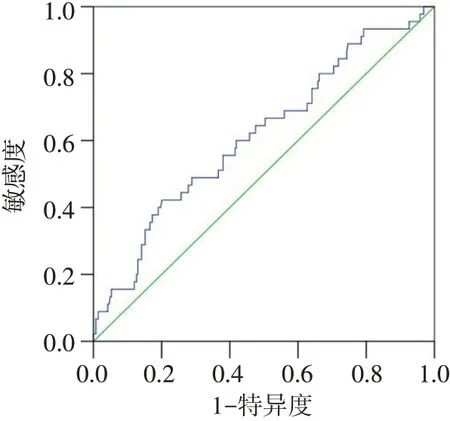
Fig.1 The ROC curve of NLR for diagnosing glucocorticoid induced osteonecrosis图1 NLR用于诊断MCD发生激素性骨坏死的ROC曲线
2.3 NLR与MCD患者激素性骨坏死相关性血NLR水平与发生激素性骨坏死呈正相关(rs=0.137,P<0.01)。
2.4 血NLR水平对MCD患者髋关节生存的影响总中位随访时间为38个月。Kaplan−Meier生存曲线分析结果显示,高NLR组的关节累积生存率明显低于低NLR水平组(χ2=10.130,P<0.01),见图2。高NLR组与低NLR的1年、3年、5年关节生存率分别 为82.9%和93.5%、76.3%和88.9%、65.2%和85.6%。以血NLR水平(连续性变量)、单核细胞、纤维蛋白原、血肌酐及eGFR为自变量,以MCD患者应用激素后的转归为因变量(未发生激素性骨坏死=0,发生激素性骨坏死=1),纳入Cox回归模型,多因素Cox回归分析结果显示,高NLR及低eGFR是患者发生激素性骨坏死的独立危险因素(P<0.05),见表3。以血NLR水平[分类变量:低NLR组(NLR≤3.321)=0,高NLR组(NLR>3.321)=1]、单核细胞、纤维蛋白原、血肌酐及eGFR作为自变量,因变量同上,纳入Cox回归模型,多因素Cox回归分析结果显示,高NLR及低eGFR仍是MCD患者发生激素性骨坏死的独立危险因素(P<0.05),见表4。
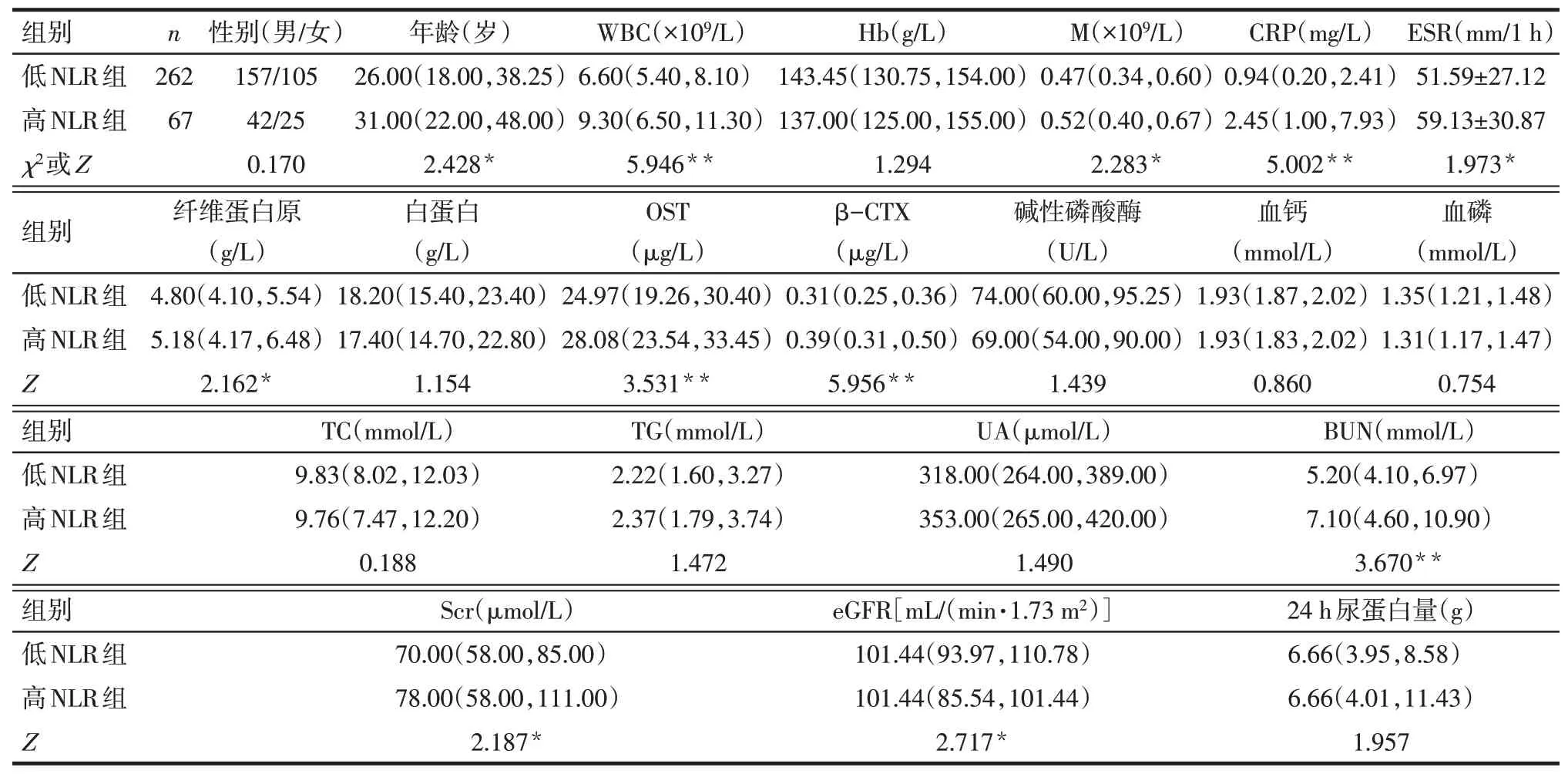
Tab.1 Comparison of the baseline data between the two groups表1 低NLR组与高NLR组的基线资料比较

Tab.2 Comparison of the drug use between the two groups of patients表2 低NLR组与高NLR组用药情况比较
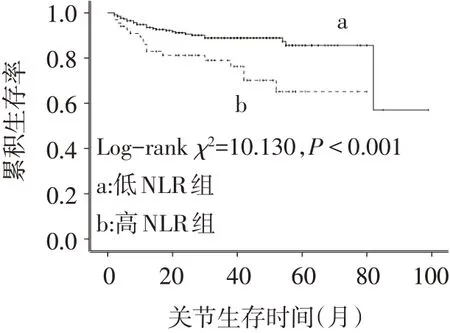
Fig.2 Comparison of the joint survival rate between the two groups图2 2组患者关节生存率比较
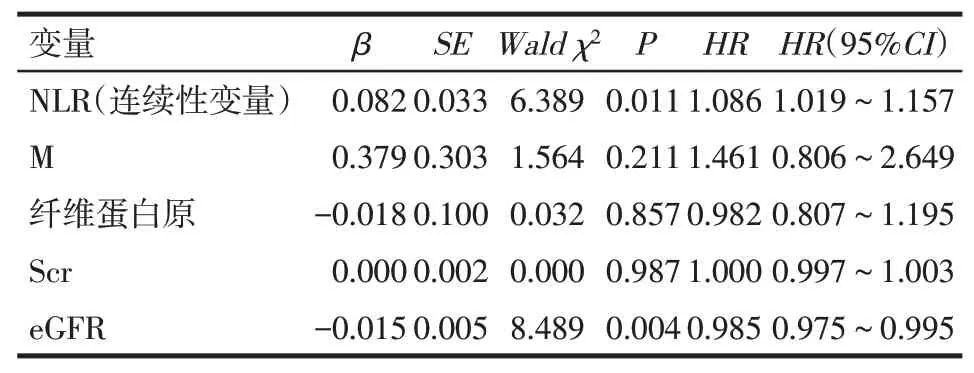
Tab.3 Multivariate COX regression analysis of influencing factors of poor joint outcome in MCD patients(NLR is a continuous variable)表3 MCD患者关节转归不良影响因素的多因素Cox回归分析(NLR为连续性变量)

Tab.4 Multivariate COX regression analysis of influencing factors of poor joint outcome in MCD patients(NLR is a classification variable)表4 MCD患者关节转归不良影响因素的多因素Cox回归分析(NLR为分类变量)
3 讨论
MCD是肾病综合征常见的病理类型,临床上主要表现为大量蛋白尿、低蛋白血症、水肿及高脂血症,发病机制目前尚未完全阐明。其主要的组织学特征是电镜下有广泛的肾小球脏层上皮细胞足突融合,因此许多研究都集中于发现破坏肾小球滤过屏障完整性的介质,大多认为是一种或多种循环因子增加其通透性,从而导致蛋白尿[7−8]。MCD的初始治疗以糖皮质激素为主,其完全缓解率高,但复发率也高,长期反复使用激素可引起许多不良反应,其中骨坏死是严重影响患者生存质量的主要因素之一,因此早期预测发现骨坏死有助于优化MCD患者的治疗方案,从而防止骨塌陷和保留关节,提高患者生活质量。
骨坏死是指骨骼特定区域的血供中断或受损,引起骨细胞、骨髓成分死亡及修复,导致骨骼结构改变,引起关节疼痛、关节功能障碍[6]。髋关节最常受累,其次为其他负重关节,如膝关节等。骨坏死按照病因可分为创伤性和非创伤性两大类,其中非创性骨坏死的病因包括大剂量糖皮质激素应用、乙醇中毒、减压病、吸烟、超重或肥胖等,其中糖皮质激素引起的非创伤性骨坏死即为激素性骨坏死[9−10]。近年来,NLR被认为是比WBC、中性粒细胞及CRP更能反映体内炎症状态的一个指标,已有许多研究证实NLR与各种炎性疾病、心血管疾病以及实体肿瘤等疾病的预后相关[11−12]。尽管目前有关NLR与MCD患者发生激素性骨坏死的研究较少,但已有较多报道证明NLR水平与骨质疏松相关[13−14]。
既往研究认为激素性骨坏死主要与激素的应用剂量及时间有关[9,15],通常在治疗开始后0.5~3年发生,其风险剂量为泼尼松或其等效物2~3个月内累积>2 g。但本研究发现2组患者激素累积剂量及累计使用时间未见有明显差异,可能与MCD患者使用的具体激素种类、每日剂量、给药途径以及是否加用免疫抑制剂等因素有关[16]。激素性骨坏死的发病机制尚未完全阐明,既往有研究提出脂肪栓塞、血管血栓或出血等机制[10,17]。近来低纤维蛋白溶解造成的高纤维蛋白原血症也被认为是其危险因素[18−19]。本研究结果显示高NLR组患者的纤维蛋白原明显高于低NLR组,这可能与MCD患者血中促聚集、促凝因子增加,而抗聚集、抗凝和纤溶机制受损有关[20],且MCD患者本身存在高脂血症及低蛋白血症,这些因素共同导致患者处于高凝状态,增加了MCD患者血栓形成的风险,使骨骼血供中断,骨坏死的风险增加。研究表明单核细胞可作为前体成骨细胞促进血管生成和成骨过程[21],也可作为前体破骨细胞参与关节炎和骨关节损害等疾病过程[22]。本研究结果显示,高NLR组患者的单核细胞水平明显高于低NLR组,提示当MCD患者微环境处于炎症状态时,单核细胞易于向破骨细胞分化,进而参与骨坏死过程。有报道称激素性骨坏死患者OST及Ⅰ型胶原C端肽均较对照明显升高,β−CTX作为Ⅰ型胶原C端肽的分解片段可间接反映其水平的升高[23−24]。本研究结果显示,2组钙磷水平及碱性磷酸酶无明显差异,而高NLR组的OST及β−CTX均较低NLR组升高,提示MCD高NLR组患者的骨代谢活跃、加快。本研究高NLR组的WBC、ESR、CRP以及发生激素性骨坏死的比例较低NLR组明显升高,且高NLR水平是MCD患者发生激素性骨坏死的独立危险因素。原因可能如下:(1)在炎性环境下,中性粒细胞接受脂多糖刺激后会大量表达核因子κB受体活化因子配体(RANKL),进而激活破骨细胞导致骨吸收,而淋巴细胞则抑制RANKL诱导破骨细胞的成熟和分化[25−26]。因此,当MCD患者的NLR水平升高时,即当中性粒细胞升高、淋巴细胞降低时,会造成RANKL表达增加,破骨细胞更为活跃,骨量丢失,增加MCD患者发生激素性骨坏死的风险。(2)炎症反应初期引发骨愈合和血管生成过程,炎症反应中期炎性因子水平下调,并表达抗炎因子如白细胞介素(IL)−10、转化生长因子−β(TGF−β),同时促进血管生成的相关因子如血管内皮生长因子(VEGF)、缺氧诱导因子−1α(HIF−1α)开始表达,启动血管生成反应,但是若延长炎症过程,血管生成将明显滞后[27−28],可见当MCD高NLR组患者长期处于炎症状态时血管生成修复滞后,造成骨骼血供不良,从而引起骨坏死的发生。(3)激素性骨坏死发生发展过程中还可激活炎症反应,促进炎症介质的释放[29]。本研究显示NLR每增加1,MCD患者发生激素性骨坏死的风险增加8.6%,且NLR水平高于3.321的MCD患者发生激素性骨坏死的风险明显增加,是低NLR组的2.155倍,关节生存率明显下降。由此可见激素性骨坏死进程与炎症反应相互促进,呈恶性循环,提示可以通过监测NLR水平,早期筛查应用激素的MCD患者,及时调整激素用药方案,降低骨坏死发生风险,保留骨关节,提高患者生活质量。多因素Cox回归分析显示eGFR水平降低是激素性骨坏死发生的危险因素,提示除NLR以外,MCD本身也对激素性骨坏死的发生起一定作用[30]。eGFR水平降低提示存在肾脏损伤、肾小球滤过功能受损,可使白蛋白排出增多,造成低蛋白血症。笔者认为MCD患者本身存在因低蛋白血症导致有效循环血容量减少的高危因素,提示高NLR组患者可能存在有效血容量减少,进而导致骨骼灌注不足,促进骨坏死的发生。
综上,MCD患者的NLR基线水平可以粗略评估其发生激素性骨坏死的风险。目前常用于评估激素性骨坏死风险的基因检测步骤复杂、耗时长且价格昂贵;与之相比,NLR检测更加简便易行、经济,且其与单一的WBC参数相比,受脱水、稀释以及血液标本处理等因素的影响小,因而稳定性更强。本研究存在一定局限性,首先,所有样本均来自同一个中心;其次,本研究属于回顾性研究,缺乏长期的临床观察。NLR对于MCD患者发生激素性骨坏死的临床应用价值还需前瞻性、大样本及多中心的研究进一步评估。
