双泵双氧合机械灌注设备应用于热缺血损伤猪肝脏低温灌注的可行性研究
2021-04-03何锡然谭晓宇刘华敏邝伟键梁铭炬周伟津郭家钘陈素平
何锡然,谭晓宇,张 琳,刘华敏,邝伟键,梁铭炬,周伟津,郭家钘,陈素平,霍 枫*
(1.广东顺德工业设计研究院(广东顺德创新设计研究院)生物医学部,广东佛山 528311;2.南部战区总医院肝胆外科,广州 510010;3.广东丁沃生医疗器械有限公司研发部,广东佛山 528311)
0 引言
对于终末期肝脏疾病患者,肝移植已成为唯一有效的治疗手段[1]。目前全球已有200 余个肝移植中心,迄今已完成累积超过10 万余例肝移植手术,并且每年以8 000~10 000 例次的速度递增[2]。临床肝移植的快速发展使供肝短缺的情况日趋严重。目前,供肝短缺的情况迫使临床医生更多地使用缺血损伤肝脏等边缘供肝。但是来源于边缘供体的器官可能引起更高的移植物早期功能障碍、原发性无功和肝内胆管并发症等的发生率[3-4],从而影响患者的长期生存率。同时,边缘供体的器官对冷保存相关的缺血损伤更加敏感[5]。因此,在器官供应短缺的情况下,这种高危供体器官的使用仍然有限。鉴于此,肝移植领域需要一种新的器官保存技术。低温机械灌注(hypothermic machine perfusion,HMP)在4 ℃下提供持续的循环灌注,可以提供代谢底物和去除代谢废物。研究表明,HMP 结合供氧能够恢复细胞的能量水平,减缓再灌注损伤时的线粒体损伤和活性氧释放[4]。目前,已进入临床应用阶段的肝脏HMP 设备有荷兰Organ Assist公司的Liver Assist[6-7]和美国Organ Recovery Systems公司[8-9]的LifePort Liver Transporter。对于携氧低温灌注,目前产品化比较成功的设备是Liver Assist,该设备的肝动脉和门静脉均采用压力控制模式。但是该设备运输受限,供肝获取后需要经静态冷保存运输至移植中心后才能连接设备进行灌注,因此为了避免冷缺血时间过长,使用Liver Assist 的灌注时间需要控制在1~2 h。但是静态冷保存结合短时间低温灌注的模式不适合幅员辽阔的中国国情,因此本项目组构建了一台离体肝脏双泵双氧合机械灌注设备DEVOCEAN-LIVER 2000,是兼具常温机械灌注与HMP 的离体机械灌注设备。本设备对门静脉的控制采用恒流模式,且设备将计划应用于救护车,故未来的应用模式为器官获取组织在临床上获取供肝后,首先进行修肝,然后连接设备,随后放置于救护车上,转运至移植中心。这种模式能够缩短静态冷保存的时间,延长携氧低温灌注的时间,更好地改善肝细胞的缺氧情况,减轻移植后的再灌注损伤。本实验研究为设备研发的初始阶段,目的是验证设备的稳定性和较长时间携氧低温灌注的可行性。
1 材料与方法
1.1 实验动物与材料
实验动物:健康巴马小型猪3 只,雌性,体质量45~50 kg,由南部战区总医院实验动物中心提供。所有实验猪在实验前禁食12 h,禁止饮水6 h。实验操作过程均符合动物中心的伦理要求。
灌注设备:离体肝脏双泵双氧合机械灌注设备DEVOCEAN-LIVER 2000,由广东顺德工业设计研究院(广东顺德创新设计研究院)、南部战区总医院、广东丁沃生医疗器械有限公司联合研发,可以对离体肝脏进行肝动脉和门静脉双重氧合灌注。该灌注设备主要包括:2 个离心泵(Revolution,索林集团意大利有限公司)、2 个氧合器(EU5032 Trilly 婴儿型,意大利Eurosets)、1 个温度传感器、2 个压力传感器、2 个流量传感器、2 个血栓过滤器、1 个温控水箱,以及自制的储肝器、灌注管路、胆管插管等,通过管路连接形成肝动脉循环和门静脉循环。其原理图如图1 所示。
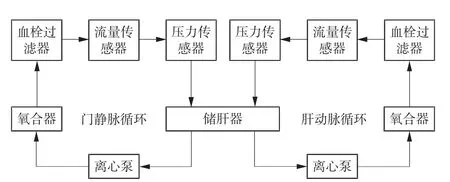
图1 离体肝脏双泵双氧合机械灌注设备原理图
实验仪器与试剂:呼吸机(S1100 型,南京舒普思达医疗设备有限公司)、多参数监护仪(M-9000S,深圳市艾瑞康医疗设备有限公司)、全自动雪花制冰机(IMS-70,常熟市圣海电器有限公司)、全自动生化分析仪(Pointcare M3,天津微纳芯科技有限公司)、血气分析仪(i-STAT300,Abbott Point of Care Inc)、电子称(HY-809B,至尊)、一次性医用静脉留置针(24G,江西丰临医用器械有限公司),导尿管(16Fr双腔,湛江事达实业有限公司)、硫酸阿托品注射液(天津金耀药业有限公司)、舒泰50(法国维克有限公司)、丙泊酚乳状注射液(西安力邦制药有限公司)、氯化钾注射液(湖北科伦药业有限公司)、高渗枸橼酸盐嘌呤溶液(上海输血技术有限公司)、UW 机械灌注液(美国Bridge to Life 公司)、肝素钠注射液(江苏万邦生化医药集团有限责任公司)、注射用头孢西丁钠[国药集团致君(深圳)制药有限公司]、猪IL-6 ELISA 试剂盒(ELP-IL6,RayBio)、猪TNF-α ELISA试剂盒(ELP-TNF-α,RayBio)以及组织固定液(江苏世泰实验器材有限公司)。
1.2 实验分组
本实验为单臂设计,所有实验动物的肝脏均采用离体HMP,用于验证离体肝脏双泵双氧合机械灌注设备DEVOCEAN-LIVER 2000 的可操作性及稳定性。
1.3 猪肝脏的获取
耳后肌内先注射硫酸阿托品注射液0.05 mg/kg,15 min 后注射舒泰50 溶液2~3.5 mg/kg 进行基础麻醉。基础麻醉后,猪耳缘静脉留置套管针,建立静脉输液通道,利用微量注射泵每小时泵入丙泊酚乳状注射液2~5 mg/kg 维持麻醉。进行气管插管,利用呼吸机辅助呼吸。腹部正中线切口进腹,切口上抵胸骨剑突,下达耻骨联合,游离腹主动脉、下腔静脉及门静脉。耳缘静脉注射1 g 氯化钾注射液,使心脏骤停。静置实验猪60 min,建立热缺血60 min 模型。60 min 后,结扎胸主动脉,向腹主动脉置入已剪开口的16Fr 导尿管进行在体冷灌注,灌注液为4 ℃的高渗枸橼酸盐嘌呤溶液,体积为1 L;同时进行门静脉插管,剪开肝静脉出口进行在体冷灌注,灌注液为4 ℃的高渗枸橼酸盐嘌呤溶液,体积为1 L。快速取下肝脏,将其置入装有4 ℃生理盐水的容器。修整肝门区域多余组织,剔除肝门区域的淋巴结,进行肝动脉和胆道插管,随后记录肝脏质量。
1.4 HMP
开始灌注之前,灌注管路内用1.5 L UW机械灌注液进行预充,排除管路中的气泡。随后加入6 250 U 肝素钠注射液和1 g 注射用头孢西丁钠,开始接通氧气瓶。肝脏连接设备,灌注温度为4 ℃,氧气体积分数为100%。肝动脉采用压力控制模式,设定为25 mmHg(1 mmHg=133.32 Pa);门静脉采用流量控制模式,设定为0.5 mL/[min·g(肝重)]。在灌注过程中,持续监测肝动脉流量及门静脉压力,灌注时间为8 h。
1.5 监测项目
在灌注过程中,观察设备的稳定性,记录灌注流量与灌注压力。同时每2 h 取灌注液行血气分析,观察pH 值、血糖(Glu)和乳酸(Lac)水平。另外,在灌注的第0、2、4、6、8 h 分别从肝上随机选取2 份样品,一份组织样本进行白介素6(IL-6)和肿瘤坏死因子α(TNF-α)水平的检测,另一份进行组织学检查,用福尔马林固定后进行苏木精-伊红染色(HE 染色)。根据铃木评分[10]以及其他文献结果[11-13],从空泡化、坏死、水肿以及肝窦扩张方面进行评分,每个方面分为无、轻度、中度和重度,分别评分0、1、2、3 分;每张切片随机选取3 个视野进行双人评分,最后统计每项得分。
1.6 统计分析
采用IBM SPSS Statistics 23.0 统计学软件进行实验数据分析。所有计量资料以均数±标准差()表示,所有计数资料以百分数表示。
2 结果
2.1 肝脏灌注前的情况
灌注前肝脏平均质量为(888.00±41.33)g,获取肝脏后需要(69.33±3.38)min 进行修肝。
2.2 灌注参数
灌注过程中,设备没有出现故障。肝动脉的压力稳定维持在24.09~24.65 mmHg,肝动脉流量则从灌注初期的0.04 mL/[min·g(肝重)]逐渐升高至0.09 mL/[min·g(肝重)]。门静脉的流量稳定维持在0.47~0.50 mL/[min·g(肝重)],灌注初期平均门静脉压力为2.79 mmHg,灌注最后1 h 平均门静脉压力为1.84 mmHg,呈下降趋势,结果如图2 所示。
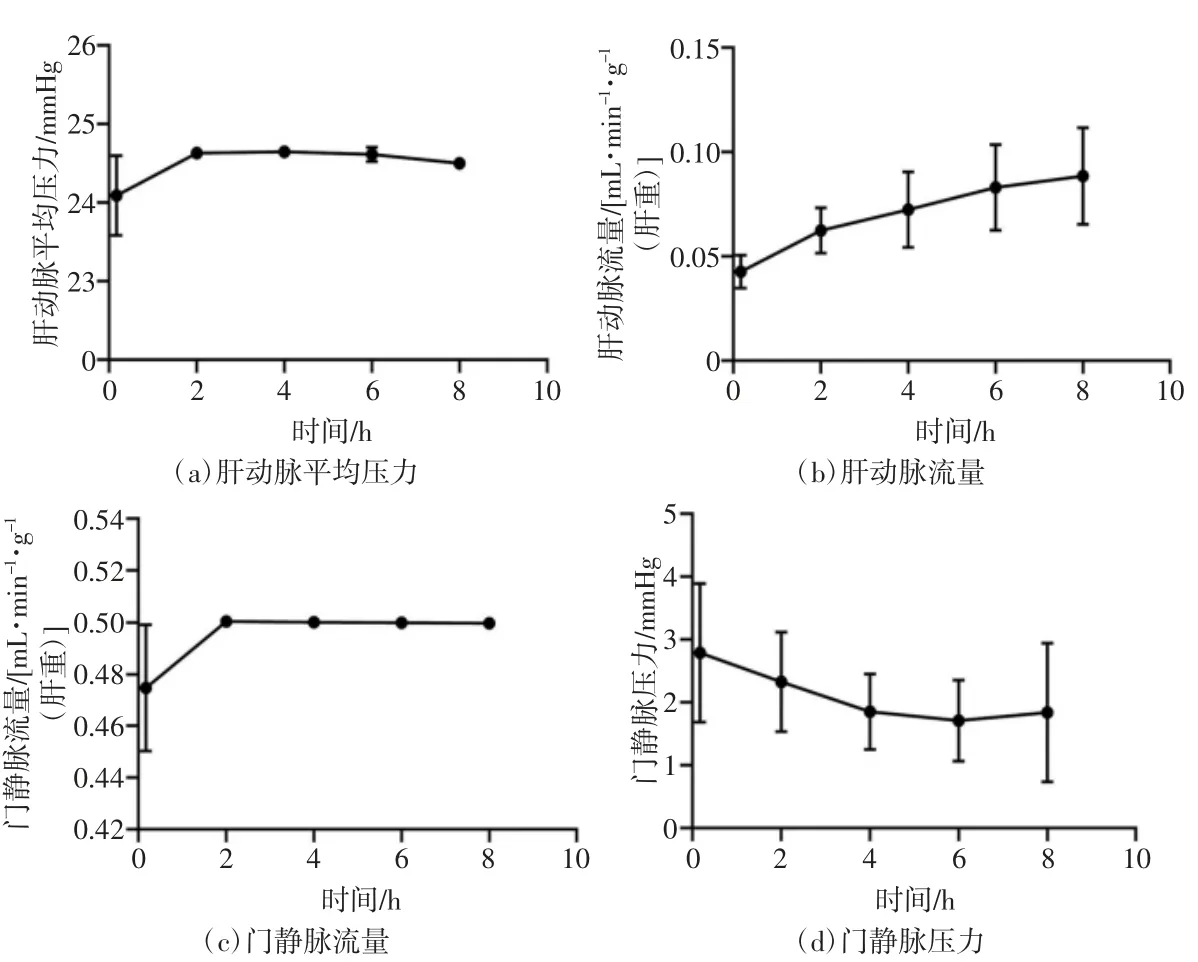
图2 携氧HMP 的灌注参数
2.3 灌注液的血气结果
从灌注初期至灌注结束,灌注液的pH 值维持在7.16~7.19;对于Lac 水平,灌注初期为(0.63±0.21)mmol/L,随后稳定在1.31 mmol/L 左右;Glu 水平则在7.83~9.13 mmol/L。灌注液的血气结果如图3所示。
2.4 肝组织IL-6 以及TNF-α 的变化
灌注初期肝组织的IL-6 的平均值为665.97pg/mL,灌注结束时平均值为606.91 pg/mL。对于TNF-α 水平,灌注初期平均值为0.038 ng/mL,灌注结束时平均值为0.050 ng/mL,结果如图4 所示。
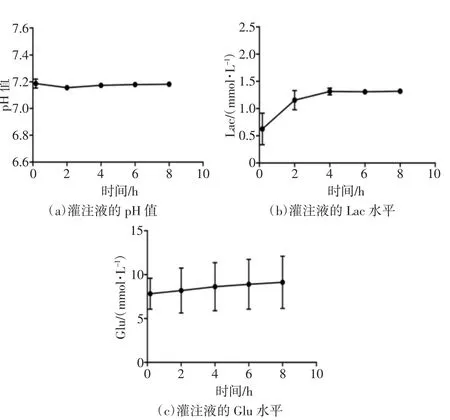
图3 灌注液的血气结果

图4 肝组织的IL-6 以及TNF-α 水平
2.5 肝组织的病理学及外观评价
肝组织的空泡化评分呈下降趋势,从灌注初期的(2.44±0.40)分下降至灌注结束时的(1.00±0.33)分。而肝组织的坏死评分则在灌注结束时轻度升高,灌注初期为(1.22±0.15)分,灌注结束时为(1.58±0.42)分。肝细胞水肿评分在灌注前后变化轻微,灌注初期为(1.38±0.29)分,灌注结束时为(1.33±0.67)分。对于肝窦扩张评分,灌注结束时为(1.66±0.33)分,比灌注初期([1.50±0.25)分]轻度升高。肝组织的病理学评价结果如图5 所示,灌注过程的肝脏外观如图6 所示。
3 讨论
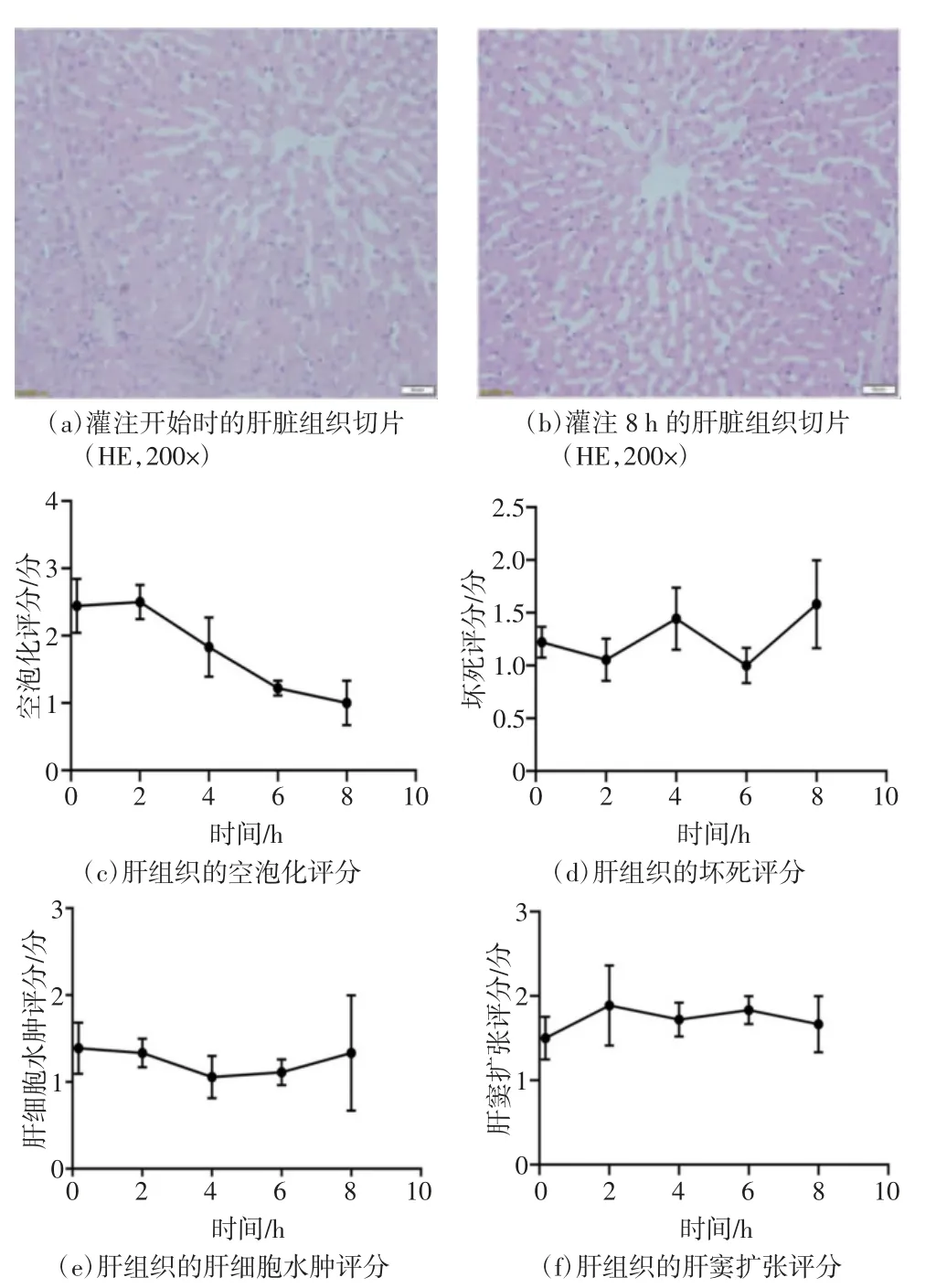
图5 肝组织的病理学评价
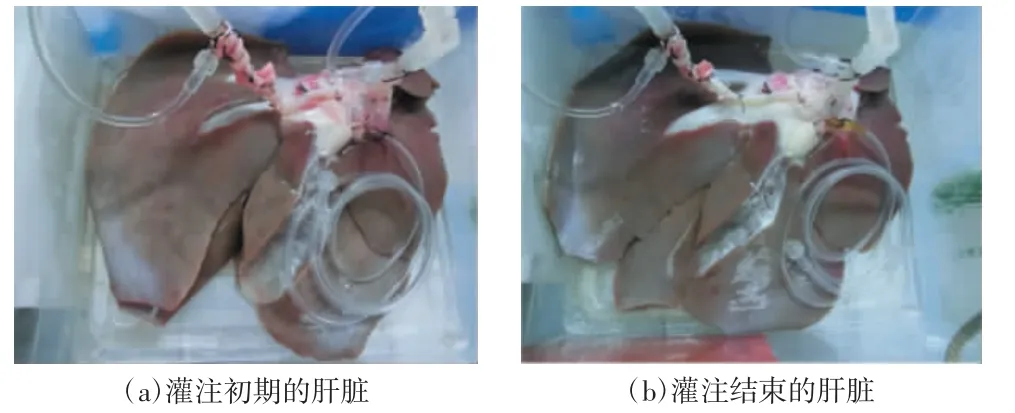
图6 灌注过程的肝脏外观
随着我国公民器官捐献工作的开展和器官需求的不断增加,我国的器官移植技术需要向高质量发展,使更多等待移植的患者受惠,因此各地的器官获取中心需要比传统静态冷保存更先进的技术用于器官保存。HMP 是目前兴起的器官保存技术之一。相关研究的临床试验的结果表明,HMP 能够恢复肝细胞的三磷酸腺苷(adenosine triphosphate,ATP)水平,减轻移植再灌注损伤,降低移植物早期功能障碍发生率,同时使胆管并发症发生率下降,缩短住院时间和提高移植物存活率[6-9,14-15],这均提示其具有良好的应用前景。目前,国外已有关于HMP 技术应用于临床肝移植的报道,如Liver Assist[6-7]和LifePort Liver Transporter[8-9]的应用。本研究中的HMP 设备为国内拥有自主知识产权的DEVOCEAN-LIVER 2000,具有产品化的设计,并配备完整的耗材,未来可应用于临床,其与LifePort Liver Transporter、Liver Assist 的比较详见表1。
本研究的结果表明,在肝动脉恒压控制模式和门静脉恒流控制模式下,本设备能够在8 h 内稳定维持压力和流量水平,说明设备运转的稳定性良好。同时,肝动脉的流量呈现上升趋势,而门静脉压力表现出下降趋势,说明肝组织在灌注过程中的阻力在降低。Zeng 等[18]使用LifePort Liver Transporter 对无缺血损伤大鼠肝脏进行门静脉HMP,灌注流量为0.5 mL/[min·g(肝重)],数据表明灌注3 h 内能够显著降低阻力指数,随后稳定3 h 灌注阻力稳定。李弦等[19]使用LifePort Liver Transporter 探究HMP 对不同热缺血时间下心脏死亡大鼠供肝的灌注效果,结果发现HMP能够降低热缺血30 min 肝脏的阻力指数,但是未能降低热缺血45 min 肝脏的阻力指数。本研究使用的DEVOCEAN-LIVER 2000 能够使热缺血60 min 肝脏的灌注阻力下降,提示HMP 有助于改善热缺血损伤严重的肝脏的内部通畅程度,有利于移植后肝细胞获得充分的血液灌注,表明本设备的性能比Life Port Liver Transporter 更优良。同时,灌注过程中的pH 值、Lac 水平和Glu 水平基本稳定。研究表明,热缺血损伤会导致Lac 和Glu 水平升高[20],故灌注初期的Lac和Glu 水平较高。由于肝脏处于低代谢状态,其代谢Lac 和Glu 的能力下降,所以Lac 和Glu 水平维持稳定证明设备能够使肝脏稳定处于低代谢水平。

表1 LifePort Liver Transporter、Liver Assist 与DEVOCEAN-LIVER 2000 的比较
器官经历缺血后,尽管缺血细胞需要氧气生存,但是如果进行常温复流灌注常会导致再灌注损伤[21-22]。复流引起的损伤主要由线粒体来源的活性氧造成[23-24]。线粒体活性氧会导致危险相关分子模式的释放,活化库普弗细胞,最后激活炎症反应,导致器官损伤[25-26]。曾承[27]利用大鼠的肝脏进行HMP 和冷保存的对比研究,HMP 较冷保存组可以更为有效地为细胞供氧,增加ATP 合成,提高超氧化物歧化酶活性,抑制核转录因子NF-κB-p65 相关炎性反应通路的活性,从而减轻心脏死亡肝脏的缺血再灌注损伤。另一项研究结果提示携氧HMP 能够抑制炎症小体信号通路,降低IL-1β 和IL-18 的表达,同时控制TNF-α 和IL-6 的分泌,从而减轻肝脏的缺血再灌注损伤[28]。本研究中肝组织的IL-6 和TNF-α 水平稳定,未见升高,提示本设备的携氧HMP 有助于抑制炎症反应。其他机制研究表明,氧合HMP 可以维持组织的ATP 水平[7,25,28-29]和抑制脂质过氧化[30]。另外,HMP 具有促进肝细胞再生的潜能,研究表明,HMP 能够提高细胞增殖抗原Ki67、增生细胞核抗原以及细胞周期基因的表达[31]。而在本研究中,病理学评价表明低温氧合灌注能够防止肝细胞坏死恶化,项目组将在后续的实验中探究低温氧合灌注对肝细胞再生的影响。器官在离开供体后会遭受缺血和缺氧,研究表明,空泡化可反映肝组织缺血和缺氧损伤的程度[32-33]。Lee 等[34]发现携氧HMP 能够抑制热缺血30 min 肝脏的空泡形成,维持肝小叶结构正常。有研究使用LifePort Liver Transporter 对无缺血损伤大鼠肝脏进行门静脉的HMP,灌注流量为0.5 mL/[min·g(肝重)],组织学评价表明灌注明显扩张了肝窦,且由于LifePort liver Transporter 设备属于非携氧灌注,肝组织的空泡化水平未出现改善[18]。但在另一项研究中,与静态冷保存相比,非携氧HMP 亦能够降低肝细胞的空泡化水平,同时改善肝窦淤血情况[31]。本研究的结果提示低温氧合灌注可降低肝组织的空泡化水平。未来需要更多的实验来探讨HMP 对肝组织病理学改变的影响。
综上所述,离体肝脏双泵双氧合机械灌注设备DEVOCEAN-LIVER 2000 在离体猪肝模型中获得了比较稳定的结果,说明了设备的安全性和稳定性,不仅能维持肝脏的低代谢状态,还能降低灌注阻力和改善肝细胞缺氧。未来项目组将设计灌注后肝移植实验或者模拟复流实验,并以静态冷保存为对照组,进一步评价HMP 系统的安全性和有效性,为其日后的临床应用提供理论支持。
