吲哚菁绿荧光实时成像联合术中超声技术在特殊部位腹腔镜肝癌切除术中的应用
2021-04-01鲁葆春杨建辉唐海军朱志杨
鲁葆春,杨建辉,唐海军,朱志杨
(绍兴市人民医院/绍兴文理学院医学院第一附属医院 肝胆胰外科,浙江 绍兴 312000)
自1991 年Reich等[1]完成世界首例腹腔镜肝切除术后,随着技术的提升和手术器械的改进,腹腔镜肝切除的安全性、有效性、微创性得到广泛认可,适应证进一步拓宽。然而腹腔镜手术缺乏触觉反馈、视野角度不能随意调整,对于特殊部位的肝肿瘤不仅无法很好定位、暴露,而且手术切线易偏离。因此特殊部位肝肿瘤腹腔镜切除迫切需要一种辅助工具对手术部位进行精准标识和引导。吲哚菁绿(indocyanine green,ICG)能够对肝肿瘤进行荧光实时显像,对于特殊部位的肝肿瘤腹腔镜手术中可以显影、标识,对切缘实时引导,但ICG仅有0.6~0.8 cm的穿透深度,对于特殊部位肝实质内的肿瘤仍无法直接起到标识和引导作用。我们团队将ICG荧光实时成像技术和术中超声技术相结合并应用到特殊部位腹腔镜肝癌切除术中,效果满意,现报道如下。
1 资料和方法
1.1 一般资料
选择2018年1 月至2020 年5 月在绍兴市人民医院肝胆胰外科诊断为特殊部位肝实质内肝恶性肿瘤患者20 例。纳入标准:(1)肿瘤位于肝特殊部位如VI、VII、VIII段,且肿瘤位于肝实质内,肝表面无法显露;(2)未接受过其他治疗。20例患者中男13例,女7例,中位年龄53.8岁(32~78岁),术前均行超声、增强CT、MRI检查和甲胎蛋白检测明确诊断。肿瘤均为单发,其中位于VI段6 例,VII段3 例(见图1),VIII段3例,VI段、VII段4例(见图2),VI段、VII段、VIII段4例,肿瘤直径2.5~5.0 cm(见图3)。就诊时临床症状均不典型;12例患者合并程度不等的乙型肝炎后肝硬化,术前肝功能均为Child A级。
1.2 手术方法
术中超声机器选用BK-Pro Focus 2202,荧光导航高清腹腔镜系统选用史赛克 Pinpoint。(1)所有患者术前经实验室和影像学检查明确肝硬化程度,根据肝硬化程度于术前2~5 d经外周静脉注射0.5 mg/kg ICG注射液(丹东医创药业有限公司)。(2)均采用腹腔镜下5 孔法肝肿瘤切除,体位为头高、左倾45°,切肝前均行腔镜下超声检查明确肿瘤位置和标识安全切肝线,切肝过程间断荧光引导确保切肝线不偏离。记录显影效果、手术时间、术中出血、术后胆漏和出血等情况。
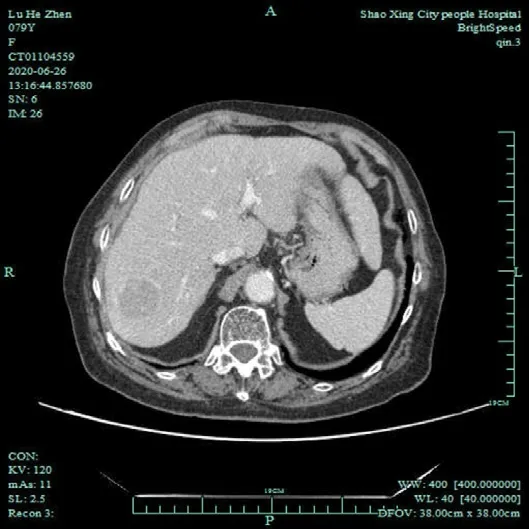
图1 CT提示肝VII段肿瘤
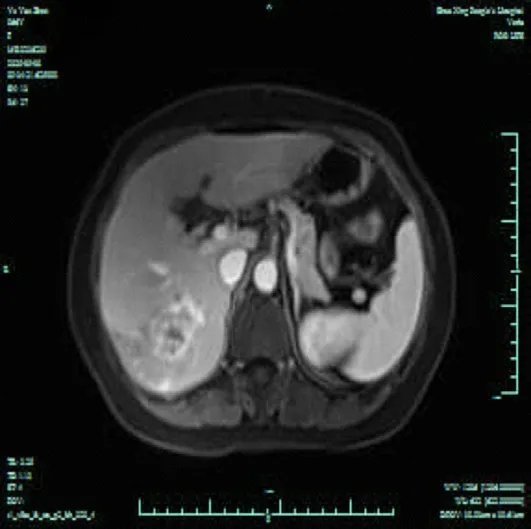
图2 MRI提示肝VI、VII段肿瘤

图3 大体标本:显示荧光深度和肿瘤切缘
2 结果
2.1 术中及术后情况
19 例患者在ICG荧光实时成像联合术中超声技术的帮助下顺利完成腹腔镜肝肿瘤切除术,1 例由于肿瘤位于VII段背侧、暴露不佳且合并肝硬化,无手术路径而中转开腹。19 例患者的手术时间为(165±38)min,术中出血量(280±26)mL。术中肝切缘病理检查均提示切缘阴性。术后1例出现胆漏,每天引流量最多不超过80 mL,术后带管出院,28 d后顺利拔管,术后未出现出血等其他严重并发症。术后复查增强CT均提示:肿瘤完整切除,未见肿瘤残留。19例术后均行两次TACE治疗,术后随访3~26个月,2例残肝出现新病灶,但均不位于切缘,其余17例未见复发。
2.2 术前ICG注射时间、肝硬化程度、荧光成像结果与病理结果
本组19例患者术中应用ICG荧光实时成像联合术中超声技术完成手术,术后病理和肝硬化情况为:肝细胞肝癌15例,合并肝硬化9例;胆管细胞癌2例,均无肝硬化;混合型肝癌2例,均合并肝硬化。术前2 d注射ICG 8例,均无肝硬化,荧光显像失败1例,为胆管细胞癌;术前3 d注射ICG 7 例,荧光显像失败1例,为混合型肝癌;术前4、5 d注射ICG各2例,荧光显像均成功。
3 讨论
随着腹腔镜技术提升和手术器械改进,腹腔镜肝切除的安全性、有效性、微创性得到广泛认可,在肝癌领域的应用也进一步拓宽。由于肝恶性肿瘤的生物学特性:容易发生肝内转移、肿瘤周围合并子灶,大多数肿瘤无包膜、边界不清,而腹腔镜手术缺乏触觉反馈、视野角度不能随意调整,腹腔镜肝癌手术为了达到R0切除并符合精准肝切除理念,临床上迫切需要一种辅助工具既能对手术部位进行精准标识和引导,又能发现肝内转移病灶及肿瘤周围子灶。ICG作为一种红外荧光染料,注入人体后被肝细胞摄取,在特殊波长的外来光源照射下可产生红外光而显示肝胆结构[2];同时不同肝组织对ICG的摄取率和代谢率不同,产生红外光和显示肝胆结构的时间点也不同。通过ICG荧光成像技术引导实施腹腔镜肝切除是近年来腹腔镜肝外科的重要进展之一,已被广泛应用于腹腔镜术中肝脏肿瘤定位和切缘定界、肝段染色、胆漏检测和胆管辨识中[3],对于发现肝表面小转移病灶、确保手术足够切缘的作用尤为显著。
ICG荧光成像技术在对肝脏结节的显像方面具有较高敏感性,但荧光对肝脏组织的穿透性有限,文献报道[4]腹腔镜下ICG荧光仅可显示距肝表面0.6~0.8 cm的肿瘤,因此ICG荧光对于发现肝脏表面的肿瘤效果明显,包括小的转移灶和播散灶[5]。但对于特殊肝段、位置较深的肿瘤,ICG荧光无法直接显示,仅在肝脏切开后才能起到ICG荧光的作用。本组19例特殊部位肝实质内的肝肿瘤在切肝前均无法发挥ICG荧光成像技术的作用,因此切肝前无法明确肿瘤位置和切肝线。而术中超声却不受肿瘤深度和位置的影响,能很好反映肿瘤周围的结构并确定切肝线。但术中超声使用时也存在局限性:(1)外科医师基本无超声影像的资质,超声检查和解读水平有限,如让超声科医师术中全程陪同不切实际;(2)超声探头频繁介入不仅影响手术连贯性,耽误时间,而且无法真正做到全程实时成像指导手术;(3)超声对于肝表面肿瘤及肝实质切开后成像效果不佳。而ICG荧光成像技术却能很好弥补术中超声的不足,确保手术精准导航、连贯性和R0切除。将两项技术联合应用于本组19例特殊部位肝实质内肝肿瘤患者手术中,不仅确保了足够切缘,19 例患者切缘均阴性;而且手术流畅性好,缩短了手术时间,19 例患者的手术时间为(165±38)min,术中出血量(280±26)mL。考虑到肝脏病理学状态影响ICG荧光在肝内代谢时间,术前ICG荧光注射时间若不根据肝硬化程度进行调整,术中荧光显像将失败[6]。合并肝硬化的患者若术前2 d注射ICG,术中荧光成像基本失败。本组19例患者我们在术前根据增强CT及MRI明确是否合并肝硬化及程度,并以此指导术前注射ICG荧光的时间,结果19例患者中17例ICG荧光显像成功,失败2例,1例为胆管细胞癌,1例为混合型肝癌。
如何更好地将两项技术的特点有机结合并应用于手术中,我们体会如下:(1)前入路切肝患者在切肝体位确定后行超声明确肿瘤位置、肿瘤距肝表面深度和切肝线,以免体位改变影响切肝平面;非前入路切肝患者一般在肝周韧带游离结束、肝脏暴露彻底的情况下再行超声检查明确肿瘤位置、肿瘤距肝表面深度和切肝线,以免肝脏搬动影响切肝平面;(2)肝实质切开后即间断应用ICG荧光成像技术结合预设的切肝线来指引切肝平面,避免手术过程中的牵拉影响切肝平面导致肿瘤不能达到R0切除;若荧光染色肝组织范围和预设切肝线有较大偏差,必须再行超声检查确定准确的切肝平面;(3)为确保肿瘤的完整切除,一方面肿瘤切除后的残肝必须行超声检查,明确无肿瘤残留,另一方面离体肿瘤必须切开明确切缘的宽度和肿瘤荧光显像是否完整(见图3)。但ICG荧光成像技术在腹腔镜肝脏手术中的应用也存在以下几个尚待解决的问题:(1)假阳性率,硬化肝脏的ICG代谢率低,再生结节也能表现为荧光显像,假阳性率高、特异性低[7];(2)ICG的最佳用量和最合适的术前注射时间,目前尚在临床研究中,还无明确、能提供科学依据的数据,临床上基本依靠文献总结的经验执行;(3)探测深度不够,目前技术仅能探测到深度在0.6~0.8 cm范围内的肿瘤。我们期待ICG荧光成像技术进一步改进,使其在特殊部位腹腔镜肝切除中的应用更方便、更精准和更有效。
总之,目前对于特殊部位肝实质内肝肿瘤的腹腔镜手术只有很好地利用ICG荧光成像和术中超声技术,才真正体现精准、微创肝切除理念。
