ARTP诱变对三角帆蚌外套膜细胞生长活性及其生物矿化相关因子的影响
2021-04-01陆阿利曹玉香李文娟施志仪夏煌慧杨婧漪
陆阿利 曹玉香 李文娟 , 施志仪 , 夏煌慧 杨婧漪
(1.水产种质资源发掘与利用教育部重点实验室, 上海 201306; 2.上海海洋大学农业农村部淡水水产种质资源重点实验室,上海 201306; 3.上海海洋大学水产科学国家级实验教学示范中心, 上海 201306)
在珍珠的培育进程中外套膜组织是不可或缺的组织之一[1—4]。在生产实践上, 培育珍珠(有核珍珠和无核珍珠)的过程均需进行外套膜组织或细胞植片, 被移植的外套膜组织或细胞小片的上皮细胞经迁移、增殖和包裹(珠核)形成珍珠囊, 继而分泌珍珠质形成珍珠[2]。可见, 提高外套膜组织或细胞的活力及其分泌机能是缩短育珠周期的关键因素。
长期以来, 国内外学者一直致力于贝类外套膜组织或细胞培养的研究。1983年石安静[5]首先报道了离体外套膜组织块的上皮细胞能够在体外存活并具有体外增殖及分泌珍珠质的能力。2002年施志仪等[6]针对三角帆蚌外套膜组织及细胞分别进行了培养, 探明离体组织块迁移的上皮细胞的增殖能力更强, 又在2007年证明离体外套膜细胞具有与蚌体内细胞相同的生物学结构、增殖能力及分泌珍珠质的生物活性[7]。2011年靳雨丽等[4]通过优化培养基成分, 添加促细胞生长因子显著提高了离体外套膜细胞的活性及珍珠质沉积的速度。2014年,Ren等[1]研究证明三角帆蚌离体外套膜组织及珍珠囊组织均具有分泌珍珠质的能力, 李倩[8]通过改良缓冲液及培养基成分, 利用乙酰基亚硝基脲及紫外线辐照处理外套膜细胞, 不仅大大提升了离体外套膜细胞的活力, 更有效地控制了杂菌的污染与生长。但是, 三角帆蚌外套膜组织或细胞在后继的体外培养中因增殖迟缓, 至今仍停留在原代。利用新技术提高离体外套膜细胞活力并且使其持续保持较强增殖活性是珍珠产业化转型的关键[9,10]。
近年来, 氦气诱变作为新型育种技术即ARTP技术, 在保持较低的处理温度下, 其突变率高于紫外辐射或化学诱变[11,12], 故广泛应用于生物界, 特别是微生物[13]。然而目前, 尚未检索到有关于使用ARTP诱变海洋无脊椎动物细胞的研究。本研究以我国特有的优质淡水珍珠贝——三角帆蚌为研究材料, 利用ARTP技术对三角帆蚌外套膜细胞进行诱变, 以期进一步提高离体外套膜细胞的活力和珍珠质分泌的生物学活性, 克服后继增殖滞缓的问题, 并加快育珠进程, 为珍珠养殖产业的生产实践提供指导。
1 材料与方法
1.1 实验材料
一龄三角帆蚌购于湖南省常德市养殖基, 平均体重36 g, 置于装满曝水的水族箱中饲养7d。待泥沙吐尽后, 挑选体质健康的180只蚌进行实验。
1.2 实验方法
外套膜细胞获取与氦气诱变三角帆蚌在终浓度为2%的双抗中暂养3d, 使用肥皂水清洗蚌壳后, 将三角帆蚌按照诱变组进行分组, 每组60只,并使用75%酒精对其局部进行杀菌处理。参考靳雨丽等[4]的方法直接获取外套膜组织, 用灭过菌的滤纸去除其表面黏液进行梯度清洗, 在抑菌除菌后,加入0.25%胰酶过夜冷消化12h左右, 再加入0.5%透明质酸酶, 37℃热消化25min; 加入含10%血清的M199基础培养基(杭州吉诺)终止消化10min后过300目细胞筛网收集细胞沉淀(离心速度均为1500 r/min, 10min); 并在细胞沉淀中加入M199增殖培养基重悬细胞于26℃孵育4h, 离心收集细胞沉淀, 再分别向细胞沉淀中加入渗透压稳定剂与M199基础培养基调整其浓度为2×106至1×107/mL, 将2种细胞接种到用多聚赖氨酸(江苏碧云天)包被的90 mm培养皿中, 参考Ottenheim等[13]的研究选用氦气气量为10、12和15 SLM对外套膜细胞分别处理36s、72s、126s、180s、360s、540s、720s和900s, 再分别使用等体积的渗透压稳定剂及M199基础培养基重悬细胞后, 直接加入等体积的M199增殖培养基, 吹打混匀于26℃培养箱进行外套膜细胞培养。本实验将外套膜细胞分为未诱变组(NC)和10、12和15 SLM诱变组(简称10 SLM组、12 SLM组和15 SLM组; M199细胞组(M)及渗透压稳定剂细胞组(C))且每诱变组生物学重复3次。
细胞活性与显微观察将诱变后的细胞悬液放入26℃生化培养箱中培养, 根据cell counting kit-8(CCK-8)试剂盒说明书(大连美仑)进行三角帆蚌外套膜细胞活力检测, 活力=(诱变组OD值-空白孔OD值)/(未诱变组OD值-空白孔OD值), 空白孔值使用M199培养基进行测定。细胞形态观察采用台盼蓝(上海生工)对诱变后外套膜细胞进行染色于倒置显微镜下(Olympus, 日本)观察并拍照记录。
细胞总SOD酶活性检测三角帆蚌外套膜细胞总SOD酶活性测定根据江苏碧云天总SOD酶活性检测试剂盒(WST-8法)说明书测得, 根据厂商指示计算不同诱变时间点外套膜细胞总SOD酶活力。
微核实验氦气对外套膜细胞处理后, 离心(1500 r/min, 5min)收集细胞沉淀, 通过改进梁栋[14]的实验方法, 进行微核实验, 其中在将样品处理过程中, 离心速度调整为1800 r/min, 5min; 细胞固定改为冰上固定3次, 每次30min; 制片时改用27℃恒温箱蒸干水分30min左右; 另在染色前将样品依次进行70%、90%和100%酒精梯度脱水, 每个梯度3min, 来固定细胞内染色体形态, 并待染色体玻片完全干燥, 依据珠海贝索生物瑞氏吉姆萨染色液操作指南进行染色, 其中每处理组细胞至少3个平行样, 随机选取1000个细胞, 利用普通光学显微镜(Olympus, 日本)观察并记录微核形成情况。
细胞周期检测收集不同处理组的三角帆蚌外套膜细胞(细胞数量≥1×106/mL), 用PBS清洗2次(1500 r/min, 5min), 最后留少量PBS重悬细胞,逐滴加入到500 μL预冷的70%酒精中, -20℃过夜固定20h, 依据PI/RNase Staining Buffer(BD, 美国)使用说明进行细胞染色, 37℃避光孵育20min后, 按照流式细胞仪BD FACSVerseTM操作规范, 慢速收集1×105个细胞, 利用激发光488 nm接收通道进行细胞周期分选, 实验重复3次。周期数据使用Novo Express软件进行分析, 用Excel整理数据, 计算每个样品细胞增殖指数(Proliferation index;PI)即PI=(S+G2/M)/(G0/G1+S+G2/M)。
Fluo-4/AM 钙离子荧光强度测定收集上文处理的外套膜细胞, 参考周子睿等[15]的方法进行样品孵育与处理, 使用BD FACSVerseTM慢速收集1×105个细胞进行检测, 检测标准与周子睿等[15]一致。
ALP和CA活性测定碱性磷酸酶(Alkaline phosphatase; ALP)、碳酸酐酶(Carbonic anhydrase;CA)和BCA蛋白测定试剂盒分别购自南京建成、上海晶抗和江苏碧云天, 按其说明书进行操作并计算相对应的酶活。
cDNA制备与qRT-PCR检测根据李文娟等[16]的方法进行总RNA的提取, 纯度和完整性检测。使用HiScript III RT-PCR SuperMix(Vazyme,Nanjing)按照供应商的建议扩增cDNA, 并保存在-20℃冰箱中。根据NCBI数据库公布的三角帆蚌EF1α(GW694601), 转录组数据库筛选到的ALP基因设计定量引物(表1); 同时使用周子睿等[15]、李文娟等[16]和祁晓翔等[17]的HcCA、CAM和EFCB1定量引物序列(Genewiz, Suzhou)在PCR仪(CFX96 TouchTMRT- PCR Detection System, Bio-Rad, US)上测定以上基因在三角帆蚌不同外套膜细胞样品中的表达情况。反应体系、程序及数据处理与周子睿等[15]一致。生物学重复3次, 技术重复2次。
1.3 数据统计与分析
实验数据采用SPSS 19.0软件中的One-Way方差分析(ANOVA), 数值表示为平均值±标准差(Mean±SD), 不同组间使用Dunnett’s multiple comparisons进行差异表达分析, 显著水平为P<0.05, 极显著水平为P<0.01。实验结果用Sigmaplot 12.5进行作图分析。
2 结果
2.1 氦气诱变对三角帆蚌外套膜细胞活力的影响
不同作用时间对三角帆蚌外套膜细胞活力的影响通过CCK-8法检测发现, 与NC组相比, 在10、12和15 SLM组, 外套膜原代细胞的活力均有不同的变化趋势(表2), 其中, 10、12和15 SLM组在氦气处理时间达到360s、540s、720s和900s时, 细胞活力显著增大(P<0.05)且呈上升趋势, 除10 SLMC组外, 细胞活力在720s与900s均显著性升高(P<0.05)且与其他各组差异显著, 但二者未达到显著性水平(P>0.05); 10 SLM-C组细胞活力在720s时上升至最大值, 但在900s时细胞活力显著下降, 以上分析表明360—900s时间段能够对外套膜细胞增殖能力及生长活性产生显著的诱变影响(P<0.05)。
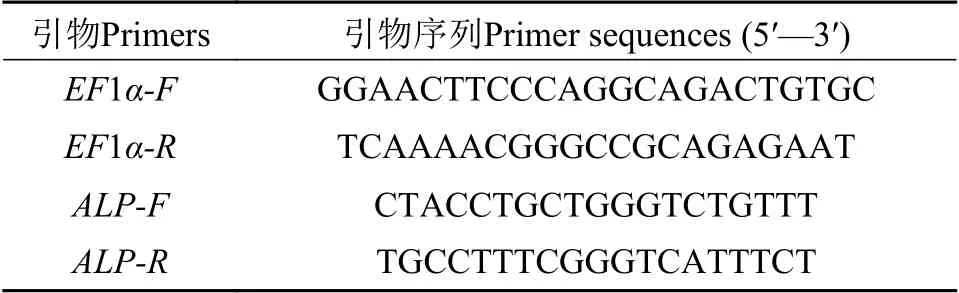
表1 三角帆蚌定量引物序列Tab.1 Primers used in the study
不同氦气气量对三角帆蚌外套膜细胞活力的影响氦气作用时间在36—360s时, 以NC组细胞为参照, 各处理组细胞活力略有降低且渗透压稳定剂组(C)与M199组(M)细胞活力显著性差异较小(表2), 说明渗透压稳定剂的存在对细胞几乎没有毒副作用, 但在有效作用时间段内(360—900s), 随着氦气气量增大, 12 SLM组和15 SLM组的C组细胞活力显著高于M组(P<0.05), 且照射时长720s和900s均能使细胞活力提高3倍左右(P<0.01)且趋于饱和; 而在10 SLM组, 辐照时间长达720s和900s时,细胞活力对渗透压稳定剂的刺激更为敏感。由细胞显微观测可以看出(图1), 与NC组相比(图1A),氦气诱变720s的细胞状态发生显著性变化, 首先细胞形态以椭圆形为主, 部分细胞膜破坏, 因诱变作用强度较大(12 SLM和15 SLM), 培养基酸碱度不稳定, 出现了细胞团块和碎片(图1C和图1D)。基于以上可知, 氦气诱变的条件为12 SLM和15 SLM,处理时间为720s, 处理组为渗透压稳定剂。
氦气诱变后三角帆蚌外套膜细胞培养进程中的活力分析外套膜细胞的损伤程度主要受氦气气量及照射时长的影响。本研究进一步将360—900s的渗透压稳定剂组的细胞短暂培养至24h, 利用CCK-8法检测了不同培养进程中细胞的活力, 以期探究氦气诱变后外套膜细胞的损伤程度。研究结果显示(图2), 在不同气量处理下, 细胞的活力均在0达到最大值(P<0.05)且同一气量下与NC组对比,0的细胞活力均有显著增高的趋势(P<0.05), 然而与0相比, 各处理组细胞活力随着培养时间的延长(6—12h)而下降。在短暂培养24h后, 结果显示与NC组相比, 辐照720s的各处理组细胞活力显著增高(P<0.05), 其中10 SLM组720s的细胞活力在培养6h后, 细胞活力恢复至原有细胞活力水平(即NC组细胞活力水平, 下同)并在整个培养进程中趋于稳定(图2A), 12 SLM组720s细胞在培养24h时恢复至原有细胞活力水平(图2B), 15 SLM组720s细胞有可能在较长的培养进程中完成自我修复(图2C)。以上结果表明, 氦气处理后外套膜细胞活力受到不同程度的损伤, 在细胞短暂培养24h后, 根据细胞培养结果发现不同气量处理下细胞恢复程度也不尽相同, 且处理时间较短时(<720s), 细胞活力恢复至正常水平速度整体较快, 以处理900s的各组外套膜细胞恢复能力最弱, 故进一步确定氦气诱变气量为12 SLM, 适宜诱变时长为720s。
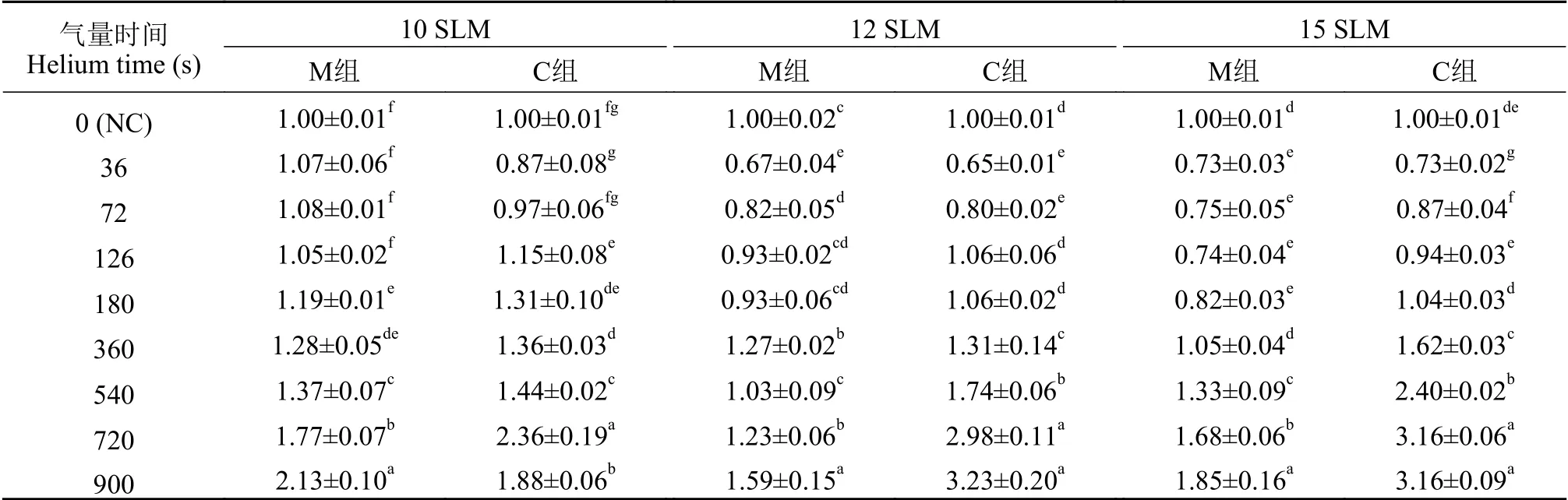
表2 氦气处理对外套膜细胞活力的影响Tab.2 The effect of helium on cells viability in mantle cells
氦气诱变对三角帆蚌外套膜细胞周期及增殖指数PI的影响为了进一步探究不同处理组对细胞周期的影响, 本研究分别用10、12和15 SLM的氦气对外套膜细胞辐照720s。结果显示(表3和图3), 与NC组相比, 随着氦气浓度增大, G1期占比呈先减小后增大的趋势(图3A), 而PI呈先上升后下降趋势(图3B), 当氦气浓度为12 SLM时, S和G2/M期细胞占比最多(表3;P<0.05), 其细胞增殖指数PI最大(0.77±0.04; 图3B;P<0.05), 而氦气浓度达到15 SLM时, G1/S比值最高(图3A;P<0.05), 其细胞增殖指数PI最低(表3;P<0.05)。基于以上分析可知, 高气量(15 SLM)处理外套膜细胞会引起G1期延长。
2.2 氦气诱变对三角帆蚌外套膜细胞损伤程度的影响
氦气诱变对三角帆蚌外套膜细胞SOD酶活力的影响为了研究氦气对三角帆蚌外套膜细胞内的氧化应激水平的影响, 本研究分别用10、12和15 SLM的氦气对细胞暴露720s, 结果显示(图4), 当氦气辐照720s时, 与NC组相比, SOD酶活力随着气量的增大呈显著下降趋势(P<0.05), 其中15 SLM处理组的SOD酶活力显著降至最低水平(P<0.05), 12 SLM次之。
氦气诱变对三角帆蚌外套膜细胞DNA损伤的影响为了研究氦气对三角帆蚌外套膜细胞DNA损伤的影响, 分别用10、12和15 SLM的氦气对外套膜细胞处理720s, 并以NC组为对照, 用吉姆萨染色后观察细胞内染色体损伤情况。如图5A、5B和5C所示, 当氦气为10 SLM时可见微核形成(如黑色箭头所示)。氦气处理组与NC组相比, 其微核数量随着氦气气量的升高呈上升趋势, 当氦气浓度达到15 SLM时, 微核率为23.68%, 出现了显著性升高(图5D,P<0.05), 但与12 SLM组微核率的形成无显著性差异。

图1 不同处理组外套膜细胞形态观察Fig.1 The comparison diagram between the cells with helium and without helium
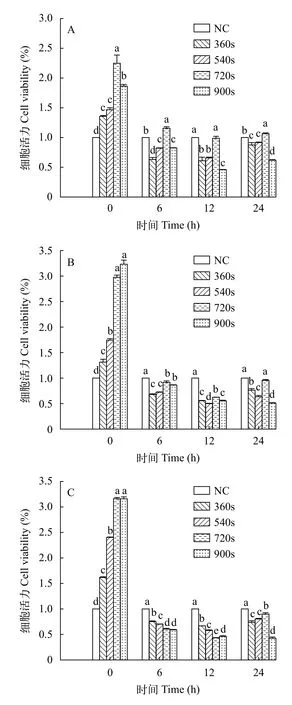
图2 培养进程中不同处理组外套膜细胞的活力分析Fig.2 The viability of mantle cells in different culture proceeding after helium
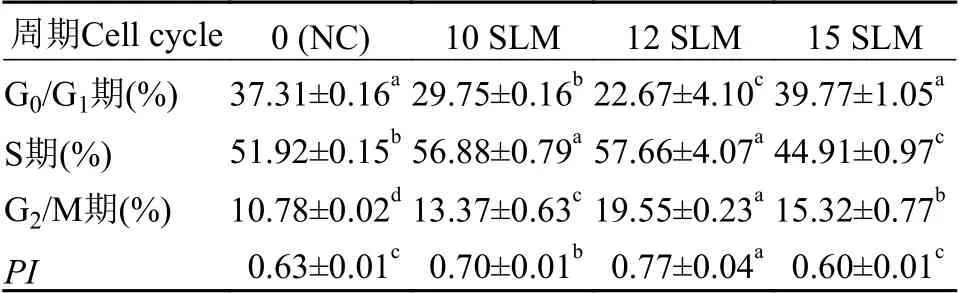
表3 不同处理组外套膜细胞时相分布和增殖指数分析Tab.3 The phase distribution and proliferation index in mantle cells from different treatments
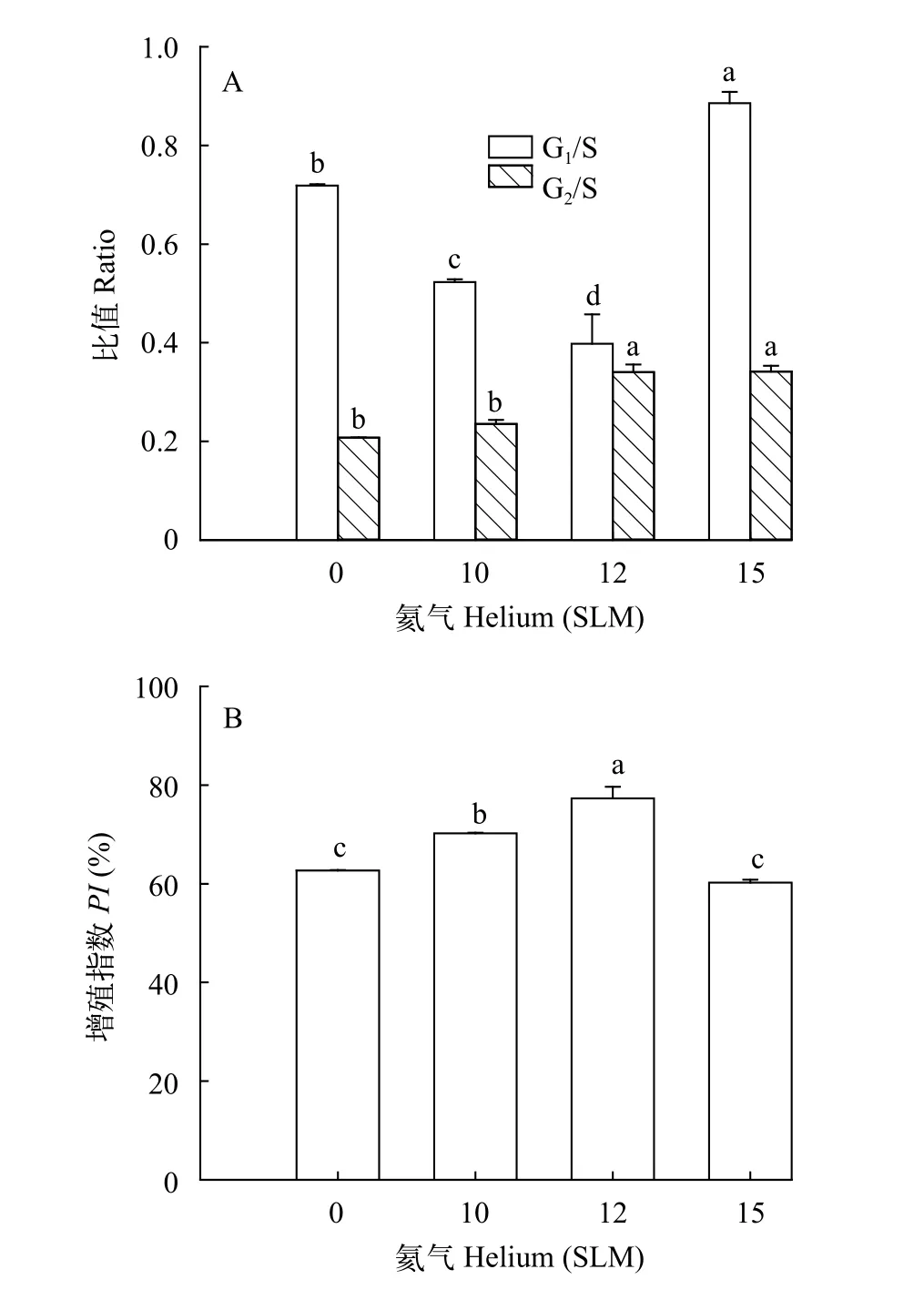
图3 不同处理组外套膜细胞周期及PI分析Fig.3 The analysis of Helium on cell cycle and PI in mantle cells from different treatments
2.3 氦气诱变对三角帆蚌外套膜细胞生物矿化相关因子的影响
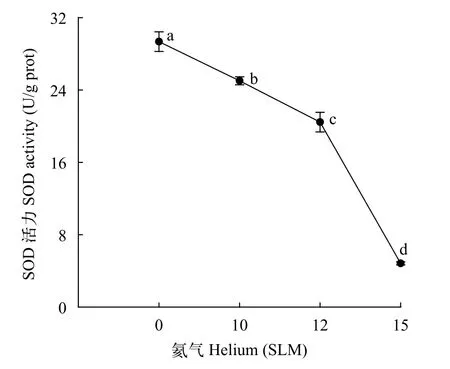
图4 不同处理组外套膜细胞SOD酶活力分析Fig.4 The SOD activity of mantle cells under different helium treatments
氦气诱变对三角帆蚌外套膜细胞胞内Ca2+摄取的影响经流式细胞仪检测发现, 与NC组相比, 外套膜细胞Ca2+荧光强度随着氦气浓度增大呈显著上升趋势(P<0.05), 在12 SLM和15 SLM组, 外套膜细胞Ca2+的荧光值分别提升了1.17倍和1.13倍,但二者未达到显著性水平(P>0.05, 图6)。
氦气诱变对三角帆蚌外套膜细胞CA与ALP的活力影响如图7所示, 与NC组相比, CA活力在10 SLM到12 SLM均呈显著上升趋势(P<0.05), 且外套膜细胞CA活力在12 SLM组达到最大值(22.46 U/g prot;P<0.05), 在15 SLM组虽出现显著下降(P<0.05),其CA活力是NC组的1.94倍。
气量为10、12和15 SLM的氦气分别对外套膜细胞处理720s后, ALP活性呈先下降后上升再下降的趋势, 其中10 SLM组ALP活性显著下降至最低水平(P<0.05), 12 SLM组的外套膜细胞ALP活性显著高于其他处理组(P<0.05), 且高达347.29金氏单位/g prot。但随着气量的增大, 15 SLM组细胞ALP活性显著下降, 与NC组相比未达到显著水平(P>0.05)。
氦气诱变对HcCA、ALP、CAM与EFCB1基因表达水平的影响使用气量为10、12和15 SLM的氦气分别对外套膜细胞处理720s后,HcCA表达量如图8所示, 与NC组相比, 10 SLM组HcCA表达量显著下降(P<0.05), 12 SLM组的外套膜细胞HcCA表达量达到最大值(P<0.05), 但15 SLM组细胞HcCA表达量与NC组比较无显著性差异(P>0.05)。
ALP基因由qRT-PCR结果可知, 在不同处理组外套膜细胞中的表达水平存在显著性差异(图8,P<0.05), 与NC组相比, 12 SLM组ALP表达量最高(P<0.05), 15 SLM组次之, 而氦气气量为10 SLM时,外套膜细胞ALP表达量显著降至最低(P<0.05)。
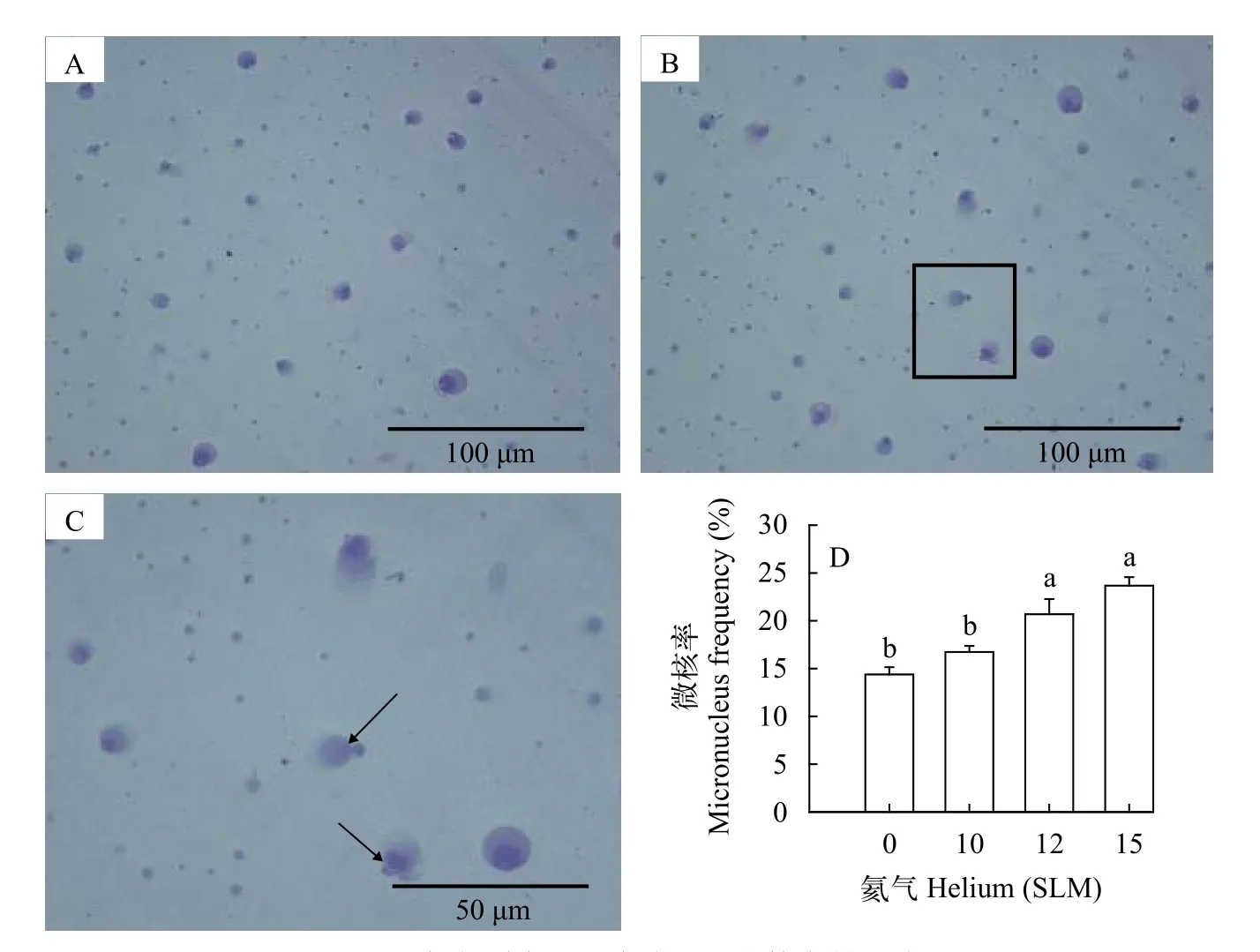
图5 氦气诱变对外套膜细胞微核率的影响Fig.5 The effect of helium on micronucleus frequency in mantle cells
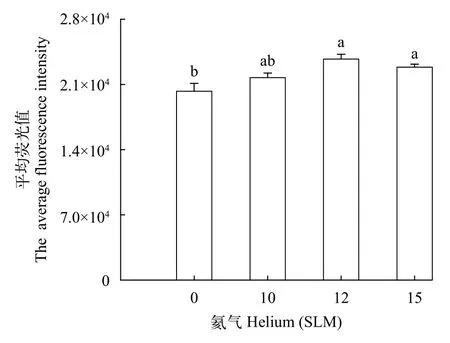
图6 不同处理组外套膜细胞内Ca2+荧光强度分析Fig.6 The intracellular Ca2+ fluorescence intensity in mantle cells of different helium treatments
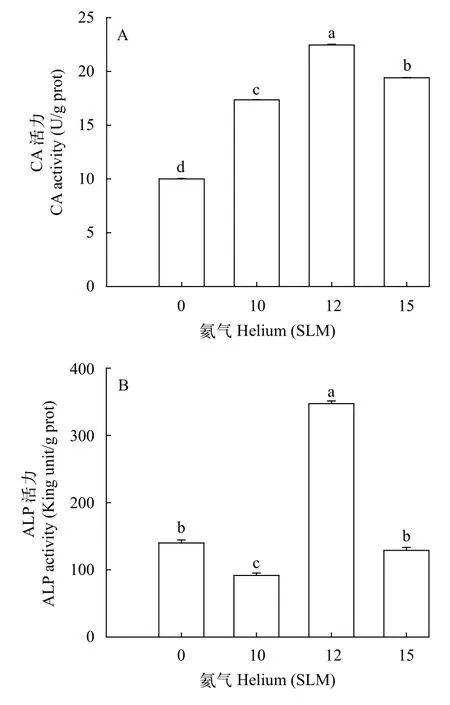
图7 不同处理组外套膜细胞CA和ALP的活力分析Fig.7 The activity of CA and ALP in mantle cells after helium treatment
CAM基因表达分析结果表明, 随着氦气气量的增高, 其表达水平呈先升高后下降的趋势(图8), 其中, 与NC组相比, 10 SLM组与12 SLM的CAM基因表达量略有升高, 且在12 SLM其达到最大值, 但二者均未达到显著性水平, 在15 SLM组,CAM基因表达量大幅度下降但无显著性差异。
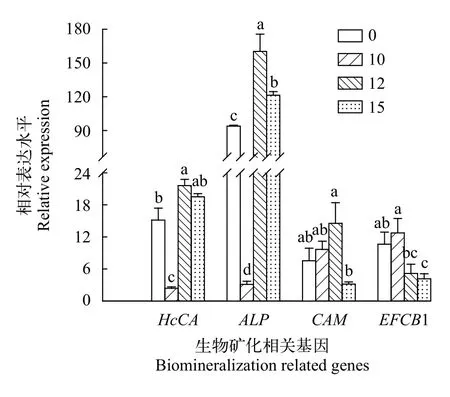
图8 不同处理组外套膜细胞生物矿化相关基因的表达分析Fig.8 Biomineralization-related gene expressions of mantle cells from different helium treatments
EFCB1基因的表达结果显示, 随着氦气气量的增高, 呈先升高后下降的趋势(图8), 与NC组相比,10 SLM组EFCB1表达量最高(P<0.05), 12 SLM组次之, 但二者与NC组比较显著性差异较小, 而在15 SLM组, 外套膜细胞EFCB1表达量显著下降(P<0.05)。
3 讨论
3.1 氦气诱变方法可行性的探讨
ARTP技术是一种基于射频大气压辉光放电等离子体的新型全细胞诱变工具[18], 通过破坏细胞膜结构, ARTP内产生的活性氧或活性氮粒子进入细胞或其与水分子及胞内脂质、蛋白质等生物分子进一步反应生成的有机氧化物引发DNA易错性修复机制[19]。资料显示, 活细胞内DNA损伤强度与诱变率具有一定的正相关性, 尤其在微生物方面, ARTP诱变对其有显著的致死效应, 且具有较强的杀菌作用[20]。三角帆蚌外套膜细胞属于开放式培养系统,容易受到各种杂菌的污染, 故ARTP技术应用于外套膜细胞培养可有效控制杂菌的生长与污染。
三角帆蚌离体外套膜细胞培养除易受杂菌污染外, 还存在增殖分裂缓慢的难题。研究表明,ARTP诱变不仅对细胞微环境有杀菌作用, 还可以促进上皮细胞增殖[19], 因此使用ARTP技术不仅可以刺激外套膜细胞增殖, 还会使其发生基因损伤,损伤后自我修复的外套膜细胞可能会产生稳定遗传的突变细胞, 该细胞可能具有无限增殖的能力及较高的生物矿化活性, 为三角帆蚌外套膜细胞建立细胞系提供资料。
此外ARTP诱变产生诸多的活性氧粒子会造成细胞DNA多样性损伤, 其中活性氧粒子增多会造成细胞的氧化损伤, SOD酶在清除胞内活性氧自由基起着重要作用。细胞DNA损伤水平可通过检测胞内DNA单、双链的断裂与染色体异常水平显示, 微核试验, 染色体畸变, 单细胞凝胶电泳等常见的DNA损伤检测方法均可用于本研究。流式细胞仪与ARTP技术联合使用在微生物上主要进行突变株的分选与培养[12,21], 本研究使用流式细胞仪分析了不同氦气条件下存活的外套膜细胞的增殖指数, 分选到目的细胞。由于ARTP诱变产生的活性粒子可以改变酶蛋白的结构, 从而促进目的细胞关键酶活升高并影响其相对应基因表达水平[22], 这与本研究中关键的生物矿化酶活力(CA和ALP)及其相关基因的表达结果相似。
3.2 氦气诱变对三角帆蚌外套膜细胞活力的影响
珍珠贝外套膜外表皮的上皮细胞对珍珠的形成起着决定性的“内因”作用[23]。本文参考靳雨丽等[4]和李倩等[8]的细胞培养方法, 利用氦气诱变三角帆蚌外套膜细胞, 结果显示随着氦气作用强度(>10 SLM,360—900s)增大, 外套膜细胞活力呈显著上升趋势,且在720s与900s 时细胞活力显著大于其他处理组,但二者未达到显著水平, 细胞形态观察发现, 氦气诱变后出现了细胞膜破裂, 细胞碎片等现象, 推测氦气诱变通过破坏细胞膜结构, 其产生的活性粒子进入胞内与DNA发生作用[24], 造成DNA单、双断裂[25], 故细胞表达显著上升, 细胞活力均明显高于诱导初期的细胞, 且在诱变时长360—900s, 出现了活力最大值, 整体也表现为细胞活力显著升高, 该现象与李倩等[8]使用紫外线诱变细胞的研究结果相一致。在诱变后, 继续将细胞稳定培养至24h, 发现仅720s处理组(10 SLM和12 SLM)细胞较快恢复至原有细胞活力水平, 说明损伤后修复的细胞有被诱变的可能性, 暗示了氦气诱变能够作用于三角帆蚌的外套膜细胞。
在氦气诱变时, 长时间辐照会挥发掉微环境部分水分以作用于外套膜细胞, 如何维持细胞培养环境的稳定性显得尤为重要。黄艳等[26]研发的渗透压稳定剂主要由渗透压维持剂即氯化钠, 保湿剂即海藻糖与甘油, pH维持剂即PBS缓冲液组成, 具有共同维持细胞培养环境的稳定性, 提升氦气诱变时细胞的敏感度的作用。在微生物中, 渗透压稳定剂对原生质体具有保湿和保护作用, 能够防止原生质体失活, 提高突变率[26]。本研究同样探讨了渗透压稳定剂在三角帆蚌外套膜细胞诱导实验中的应用,研究表明渗透压稳定剂组的细胞活力随着氦气剂量的增大(>10 SLM, 360—900s), 显著高于M199基础培养基组, 暗示了渗透压稳定剂具有稳定细胞培养环境, 刺激细胞活力增强的作用, 尤其在氦气长时间辐照细胞下, 其起到了良好的缓冲作用, 这与黄艳等[26]的研究结果相似。
DNA周期检测可用来反应细胞的增殖状况。细胞增殖的旺盛程度可由有丝分裂期相(M期)的多少来判断[27], 而增殖指数PI可反映整个细胞群体的增殖状态和该群体中增殖期的数量。流式细胞仪检测发现, 在氦气气量为12 SLM, 处理时长为720s时, 细胞S期与G2/M占比最大(P<0.05), 其PI值最高,这与江阔[28]的研究结果一致, 暗示了在一定范围内氦气诱变通过促进外套膜细胞DNA合成与有丝分裂, 进而提高其增殖能力和细胞活性。
3.3 氦气诱变对三角帆蚌外套膜细胞损伤程度的影响
大量研究表明, 以氦气为激发源的常压室温等离子体中存在的大量活性氧化物(ROS)和活性氮化物会引起DNA 断裂、蛋白质变性、真核细胞DDR响应, 原核细胞SOS响应[25,29]。如果细胞内ROS过量生成, 则会引发诸多生物分子参与ROS的防御,其中SOD酶在该防御反应中起着重要作用[30]。本研究对SOD酶分析结果显示, 随着氦气量的增大,SOD酶活力显著下降, 其中15 SLM组显著降至最低值, 说明ROS过量生成且超出细胞自身抗氧化水平, 严重造成了蛋白质的氧化损伤, 与梁栋[14]使用硫丹诱变K562细胞检测结果一致。
细胞经辐射或化学药物的作用产生核异常的微核现象, 往往由染色体或纺锤丝断裂产生[31]。微核试验是检测外来化合物对染色体损伤作用的重要方法, 不同氦气处理组的微核实验表明氦气诱变会引起较为轻度的染色体损伤, 说明氦气诱变产生大量的活性粒子可与细胞、DNA和蛋白质发生相互作用, 造成DNA损伤。以上损伤结果表明, 15 SLM组720s细胞SOD活力最低, 微核率达到最高, 推测氦气诱变对该组细胞DNA氧化损伤最为严重, 该结果与培养至24h的细胞活力结果一致, 由于在细胞培养24h时, 15 SLM组720s的细胞活力与10 SLM组、12 SLM组相比较低, 推测其仍需较长才能恢复至原有细胞活力水平, 故不适宜进行后续的细胞培养, 因此氦气诱变适宜气量条件为12 SLM。
3.4 氦气诱变对三角帆蚌外套膜细胞生物矿化相关因子的影响
贝壳和珍珠都是贝类进行钙代谢后最终以碳酸钙结晶形式沉积而成[32], 胞内钙离子的含量影响珍珠质的沉积速度。本研究检测发现, 随着氦气气量增高, 钙离子荧光值整体呈上升趋势且在气量为12 SLM达到最大值, 表明经氦气处理后, 外套膜细胞摄取钙离子的能力增强。
HcCA属于α-CA家族[33], 是一类含Zn2+的金属酶, 在贝类中广泛存在[34]。Medakovic[35]研究发现α-CA家族加速了CO2和之间的相互转化, 对软体动物碳酸钙(CaCO3)的形成起重要作用[36]。而ALP是一种分解单磷酸醋的水解酶, 主要参与贝类外套膜组织钙化[37], 贝壳角蛋白分泌[38]等生物矿化过程。本文研究发现, 在12 SLM处理组, 外套膜细胞CA、ALP活力及其基因表达水平显著高于其他处理组(P<0.05), 说明了氦气诱变产生的活性粒子是造成这些生物矿化关键酶的酶活及其基因表达升高的关键因素。研究表明,ALP基因表达水平与外套膜细胞钙化过程呈正相关[37], 说明了氦气处理可有效加快外套膜细胞的钙化过程。
具有EF-hand结构域的CAM和EFCB1通过调控钙代谢[39,40], 进而参与调节贝壳和珍珠质的形成,是影响珍珠质CaCO3晶体形成的有机成分之一[41]。本研究结果显示CAM在气量为12 SLM处理组表达水平最高, 这与胞内钙离子检测结果相一致, 而EFCB1的表达水平在10 SLM时达到最大值, 12 SLM处理组表达水平与NC相比无显著性差异(P>0.05),研究资料表明,CAM基因表达水平与Ca2+浓度呈显著正相关[16,42], 但三角帆蚌育珠过程中Ca2+代谢水平与EFCB1基因的表达水平均具有波动性[17], 这与本研究结果相似, 暗示了EFCB1基因的表达水平与胞内Ca2+浓度可能关系不强, 其具体调控机制仍需进一步研究。
综上所述, 氦气诱变对三角帆蚌外套膜细胞活力及生物矿化功能影响显著, 本研究筛选到氦气气量为12 SLM, 作用时长720s, 处理组为渗透压稳定剂的细胞具有较高的生物学活性, 为进一步研究海洋贝类离体细胞培养及生物矿化机制提供实验资料, 为建立细胞系提供新思路。
