α-辅肌动蛋白4 和钠氢交换子调节因子1 在微电场刺激人宫颈癌Hela 细胞迁移中的作用机制*
2021-04-01陈瑾歆王含彦
陈瑾歆,王含彦,唐 珍,张 燕
宫颈癌是常见的妇科恶性肿瘤,其预后与有无转移关系密切,如伴有转移,即使是早期预后也相对较差[1],因此研究宫颈癌的转移机制对该病的治疗及预后评估有重要意义。
内源性生物电场(direct current electric fields,DCEF)在机体许多生理及病理过程如细胞分化、形态发生、血管新生和组织再生等中都具有重要作用[2]。有研究[3]显示,细胞在生理强度的外加电场中会出现生物学行为改变如定向排列、定向迁移等,这在创伤愈合、肿瘤侵蚀等病理过程中可能发挥重要作用[4]。目前微电场对肿瘤细胞侵蚀转移的影响已成为人们对电场生物学效应的关注焦点[5],细胞对电信号反应的机制尚不清楚。笔者采用宫颈癌Hela 细胞,通过RNA 干扰钠氢交换子调节因子1(NHERF1)mRNA 的表达,研究微电场中NHERF1是否经过α-辅肌动蛋白(α-actinin 4)影响Hela 细胞的迁移能力,为进一步研究宫颈癌的转移机制打下基础。
1 材料与方法
1.1 主要试剂和试验分组人宫颈癌Hela 细胞从中国科学院上海细胞所购进;TRIZOL(Invitrigon);PrimeScriptTMRT reagent Kit with gDNA Eraser(Takara);SYBR Green PCR Kit (QIAGEN);RPMI1640 培养基(Gibco);胎牛血清(BI)。
试验分为阴性对照组(control)、加电组(EF)、NHERF1 基因沉默组 (siRNA)、基因沉默加电组(siRNA+EF)。
1.2 培养细胞的电场干预细胞加电培养小室的组装和细胞加电的步骤见文献报道[6]。加电组加电条件:150 mV/mm 微电场刺激8 h。
1.3 基因沉默
1.3.1 siRNA 序列合成 NHERF1 的siRNA 序列由上海权阳生物公司设计合成,相关序列如下:NHERF1 siRNA-1:sense GAAGGAGAACAGUCGU GAATT,antisense UUCACGACUGUUCUCCUUCTT;NHERF1 siRNA-2:sense CGAGGAGCUGAAUUCC CAATT,antisense UUGGGAAUUCAGCUCCUCGTT;NHERF1 siRNA-3 sense GGUGGAGGUGAACGGC GAATT,antisense UGCGCCGUUCACCUCCACCTT;阴性对照siRNA:sense UUCUCCGAACGUGUCACG UTT,antisense ACGUGACACGUUCGGAGAATT。
1.3.2 siRNA 转染 取对数期生长的细胞,种植在加电小室中,常规培养至60%~70%的融合状态进行转染,参照LipofectamineTM 2000 说明书的转染条件和方法用siRNA 1、2 和3 及阴性对照siRNA转染hela 细胞,5%的CO2、37 ℃恒温培养箱内培养4~6 h 后更换为完全培养基培养24 h。
1.3.3 RT-qPCR 检测细胞基因沉默效果 用TRIZOL 提取总RNA,NanoDrop 2000 微量分光光度计检测RNA 含量与纯度,1%甲醛变性琼脂糖凝胶电泳对RNA 完整性进行鉴定。用约1.5 μg 总RNA 为模板,采用试剂盒(Takara)提供的方法去除基因组DNA 污染,反转录合成cDNA。以cDNA 为模板在实时定量检测扩增仪上进行PCR 扩增,检测细胞NHERF1 基因沉默效果,选取最有效的一组siRNA 进行后续试验。用于qPCR 反应的特异引物序列:NHERF1-F CAGAAGGAGAACAGTCGTGAA GCC,NHERF1-R TGGTGTCACTGGAGGCGGATC;GAPDH-F ATTGACCTCAACTACATGGTTTACATG,GAPDH-R TTGGAGGGATCTCGCTCCTGGAAG。
1.4 RT-qPCR 检测各组细胞NHERF1 和α actinin 4mRNA 的表达细胞长至90%融合,种植细胞于加电小室中,常规培养至60%~70%的融合状态,按试验分组加入siRNA 转染,设置对照,4~6 h 后更换为完全培养基培养,80%~90%的融合时EF组、siRNA+EF组150 mV/mm 加电8 h,设置不加电的对照。将control、EF组、siRNA组、siRNA+EF组细胞按照步骤1.3.3 提取鉴定总RNA,反转录合成cDNA。以cDNA 为模板在实时定量检测扩增仪上进行PCR 扩增各组细胞NHERF1 和α-actinin 4。用 于qPCR 反应的特异引物序列:NHERF1、GAPDH 的引物见步 骤 1.3.3;α -actinin 4 -F ATCTGTAAGGTGCTGGCTGTCAAC,α-actinin 4-R GCTTCTGCTGCATCTCCTGGATAG。反应体系为20 μl:SYBY qPCR mix 10.0 μl,特异上下游引物(10 pmol/μl)各0.8 μl,cDNA 模板2.0 μl,去离子水补足20 μl。反应条件:95 ℃变性2 min;95 ℃30 s,60 ℃1 min 扩增40 个循环,在每个循环60 ℃延伸时检测荧光,循环完成后做融解曲线,NHERF1、αactinin 和GAPDH 的反应体系和条件相同。定量分析根据待测cDNA 中目的基因和GAPDH 的Ct 值,用2△△Ct法分析目的基因的相对表达量。
1.5 划痕试验细胞长至90%融合,种植细胞于加电小室中,常规培养至60%~70%的融合状态,按试验分组加入siRNA 转染,设置对照,4~6 h 后更换为完全培养基培养,90%的融合时用10 μl Eppendorf Tip 在加电小室底部划痕,划痕后用PBS 洗3 次,加入2%血清培养基培养,EF组、siRNA+EF组150 mV/mm 加电8 h,设置不加电的对照,在0 h、8 h 拍照,进行组间比较。使用Image J 软件测量各组细胞的划痕宽度,计算划痕细胞迁移率,划痕细胞迁移率%=(0 h 宽度-8 h 宽度)/0 h 宽度×100%。
1.6 统计学方法每组试验均重复3 次,所有数据均采用()表示,采用SPSS 13.0 统计学软件进行数据处理,组间比较采用t 检验和方差分析,方差不齐时采用秩和检验,以P<0.05 为差异具有统计学意义。
2 结果
2.1 RT-qPCR 检测细胞基因沉默效果与对照组比较,siRNA -1、siRNA -2、siRNA -3组细胞NHERF1 mRNA 表达均显著降低(P<0.01),提示基因沉默效果可靠,其中NHERF1 siRNA-1 效果最好,用作后续试验。见图1。
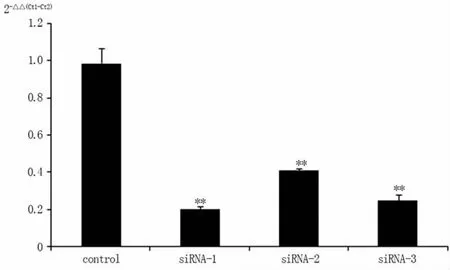
图1 RT-qPCR 检测Hela 细胞基因沉默效果
2.2 RT-qPCR 检测各组细胞NHERF1 和αactinin 4mRNA 的表达
2.2.1 NHERF1 mRNA 的表达 与对照组比较,EF组NHERF1 mRNA 的表达明显增加 (P<0.05);siRNA组和siRNA+EF组NHERF1 mRNA 的表达均明显降低 (P <0.01)。siRNA+EF组NHERF1 mRNA 的表达比siRNA组稍有增加。见图2。

图2 RT-qPCR 检测Hela 细胞NHERF1 mRNA 的表达
2.2.2 α-actinin 4mRNA 的表达 与对照组比较,EF组α-actinin 4 mRNA 的表达明显减少 (P<0.05);siRNA组α-actinin 4 mRNA 的表达明显增加(P<0.01);siRNA+EF组α-actinin 4 mRNA 的表达稍增加,但差异无统计学意义。见图3。
2.3 划痕试验与对照组比较,EF组划痕细胞迁移率明显增加(P<0.01);siRNA组划痕细胞迁移率明显降低 (P<0.01);siRNA+EF组划痕细胞迁移率有所增加,但差异无统计学意义。见图4、图5。
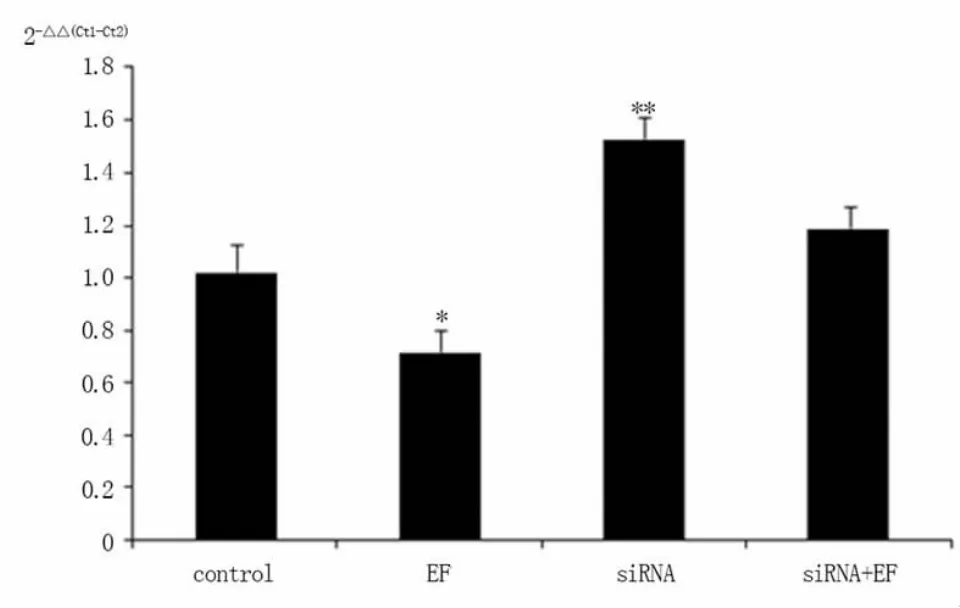
图3 RT-qPCR 检测Hela 细胞α-actinin 4 mRNA 的表达

图4 各组Hela 细胞划痕试验

图5 各组Hela 细胞划痕迁移率
3 讨论
宫颈癌的转移途径主要为直接浸润和淋巴转移,肿瘤的转移必然牵涉到细胞的迁移。α-辅肌动蛋白(α-actinin)有1、2、3、4 四种类型,主要形成细胞骨架中的肌动蛋白交联蛋白,还可与信号传导通路中的信号分子协同作用,在稳定细胞黏附、调节细胞形状及细胞运动中发挥着重要作用[7]。有研究发现[8,9],α-actinin-4 突变可影响肿瘤细胞的生长及转移;肿瘤细胞中α-actinin 表达下调;α-actinin-1 高表达可以降低细胞的迁移,抑制其表达则能增强肿瘤细胞的运动,提示α-actinin 与肿瘤的发生、发展和转移密切相关。
钠氢交换子调节因子1(NHERF1)是一种重要的细胞信号传导的调控蛋白,可与多种蛋白质如膜受体、细胞激酶等结合调控第二信使级联反应过程[10]。有研究[11,12]发现,NHERF1 可通过其ERM 结合区结构域间接结合细胞骨架调节细胞分化和运动,下调α-actinin-4 表达,影响肌动蛋白细胞骨架组织,导致肌动蛋白细胞骨架解体,在肿瘤细胞的增殖、侵袭等方面起作用。
笔者发现,在Hela 细胞中,EF 刺激可增加细胞NHERF1 的表达,抑制α-actinin-4 的表达,细胞迁移增加;用RNA 干扰NHERF1 mRNA 的表达,可明显上调细胞α-actinin-4 的表达,抑制细胞的迁移。由此推测,在微电场的作用下NHERF1 可能与α-actinin-4 相互作用,调节细胞的迁移运动。同时笔者发现,抑制了NHERF1 表达的Hela 细胞,在EF 作用下α-actinin-4 的表达及细胞迁移率均有所增加,这提示EF 对细胞迁移的影响存在其他次要调节元素,可能与其他信号通路的激活有关,具体作用机制有待进一步研究。
微电场刺激Hela 细胞NHERF1 表达增加,抑制α-actinin-4 表达,促进细胞迁移;NHERF1 基因沉默的Hela 细胞,α-actinin-4 的表达明显增加,细胞迁移受到抑制。
