纳米氧化锌对绿草履虫的毒性效应研究
2021-04-01高希蕾巩志伟谭炳钰
高希蕾,巩志伟,谭炳钰,倪 兵
(1.华东师范大学 生命科学学院,上海 200241;2.华东师范大学 物理与电子科学学院,上海 200241)
纳米氧化锌(ZnO NPs)对微生物有杀灭作用,因而被广泛应用于医药材料的制造[1-5],然而其不当排放会导致流入水体,因而会对水生环境生态系统产生影响,因此,ZnO NPs对细胞毒性的研究日益受到重视.目前对ZnO NPs毒理研究大多以哺乳动物、鱼类和溞等多细胞动物为受试对象[6-9],原生动物是食物链底层的单细胞生命体,其对环境变化的敏感性远大于多细胞动物,然而以原生动物为受试对象来探究纳米材料毒性的研究较少,用来研究ZnO NPs对绿草履虫毒性的则未见报道[10-12].本实验首次选取绿草履虫(Parameciumbursaria)作为受试对象来研究ZnO NPs进入水环境之后对水生生物的毒害作用,通过测定绿草履虫对ZnO NPs的敏感度,尝试提供一种尺度,以衡量排入地表水中的ZnO NPs所造成的生态破坏的程度和潜力.
1 材料和方法
1.1 材料
实验所选择的绿草履虫(P.bursaria)从种库取出直接接种至含有麦粒发酵液的培养皿中,在恒温培养箱中(25℃)进行培养.ZnO NPs((30±10)nm)从中国麦克林生化科技有限公司购买.将ZnO NPs粉末溶于培养水中配制成纳米溶液,超声波解聚20min后用于表征和毒理数据的测定.
1.2 ZnO NPs对绿草履虫24h内半致死浓度(24h-LC50)和半最大效应浓度(24h-EC50)的测定
挑选30只绿草履虫分别加至0.20,0.25,0.50,1.00,2.00,2.50mg/L浓度的ZnO NPs溶液中,24h后记录绿草履虫的死亡个数.每组设置6组平行组,对照组加入等量培养水.将实验结果输入至Origin 8中进行分析,以上述6组ZnO NPs溶液的浓度对数值(-0.70,-0.60,-0.30,0,0.30,0.40)为自变量x,致死率(%)为因变量y,得到ZnO NPs浓度对数对绿草履虫24h内致死率的回归方程及其拟合曲线.根据回归方程计算纳米氧化锌对绿草履虫的24h-LC50值.
挑选30只绿草履虫分别加至0.0125,0.0250,0.0500,0.1000,0.1500,0.2000,0.2500mg/L浓度的ZnO NPs溶液中,24h后记录绿草履虫的繁殖个数,对照组与实验组的繁殖个数之差为繁殖抑制个数.每组设置6组平行组,对照组加入等量培养水.将数据输入至Origin 8中进行分析,以上述7组ZnO NPs溶液的浓度对数值(-1.90,-1.60,-1.30,-1.00,-0.82,-0.70,-0.60)为自变量x,繁殖抑制率(%)为因变量y,得到ZnO NPs浓度对数对绿草履虫24h内繁殖抑制率的回归方程及其拟合曲线.根据回归方程计算纳米氧化锌对绿草履虫的24h-EC50值.
1.3 锌离子浓度与绿草履虫致死率的关系
配制25,50,100,200,300,400,500,600,700,800,900,1000μg/L的锌离子标准溶液和0.25,0.5,1.0,2.0,3.0,4.0,5.0,6.0mg/L ZnO NPs溶液,利用ICP-AES(IRIS II XSP)检测不同浓度中ZnO NPs中锌离子的量.结果用Origin 8软件分析.
锌离子对绿草履虫的毒性测定方法同1.2.
1.4 电镜样品的制备
绿草履虫经过24h-LC50浓度的ZnO NPs溶液处理4,8,16,24h后,用四氧化锇与升汞的混合物4℃避光固定10min,经常规脱水、临界点干燥、喷金后完成样品的制备,扫描电子显微镜(S4800)观察.透射电镜样品经前固定、后固定、常规脱水包埋、超薄切片、染色后用透射电子显微镜(HT7700)观察.未经ZnO NPs溶液处理过的绿草履虫作为对照组.
1.5 细胞内氧化应激水平的检测
收集虫液至离心管中,对照组加入300μL的培养水,实验组分别加入300μL 24h-EC50浓度的ZnO NPs溶液处理4,8,16,24h.超氧化物歧化酶(SOD)、过氧化氢酶(CAT)酶活力和丙二醛(MDA)含量变化的测定方法参考SOD、CAT检测试剂盒和MDA检测试剂盒说明书.
收集虫液至离心管中,对照组加入300μL的培养水,实验组分别加入300μL 24h-LC50和24h-EC50浓度的ZnO NPs溶液进行4h的处理.活性氧(ROS)量的测定参考超氧化物阴离子荧光探针(Dihydro-ethidium)试剂盒说明书.在荧光显微镜(ZEISS Imager Z.2)下观察荧光强度,结果用Image-Pro Plus 6.0进行平均荧光强度的分析.
1.6 数据计算与分析
纳米氧化锌、锌离子对绿草履虫的毒理实验数据以及酶活力测定结果用Origin 8进行统计、作图和显著性分析;平均荧光强度利用Image-Pro Plus 6.0进行分析和计算.
2 结 果
2.1 ZnO NPs的表征
透射电镜(TEM)下观察到ZnO NPs颗粒近似球形,直径为(30±10)nm,分散性较差(图1(a)),在培养水中易聚集.
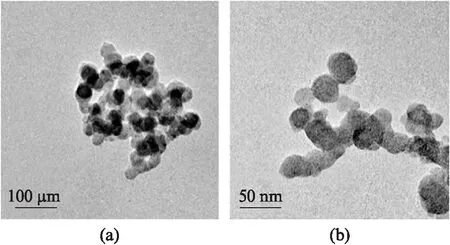
图1 ZnO NPs的TEM表征结果
2.2 ZnO NPs对绿草履虫半致死浓度(24h-LC50)和半最大效应浓度(24h-EC50)的测定
经Origin 8软件分析,绿草履虫的致死率和繁殖抑制率与ZnO NPs的浓度对数均呈线性关系,线性拟合曲线如图2所示.其回归方程分别为:y=0.55936x+0.73135(R2=0.97614)和y=0.42647x+1.09511(R2=0.98816).ZnO NPs对绿草履虫的24h-LC50和24h-EC50分别为0.39mg/L和0.04mg/L.
2.3 绿草履虫超微结构的变化
2.3.1 绿草履虫表面超微结构的变化
对照组绿草履虫在扫描电镜(SEM)下为棒状(图3(a,b)),经ZnO NPs处理后,细胞逐渐变为水滴状(图3(c,d,e,f)).对照组绿草履虫表面分布着大量纤毛,表膜突起形成规则的网格状结构(图4(a,b)).经ZnO NPs处理后,细胞膜破损和纤毛脱落的程度随处理时间的延长而加重,表膜突起形成的网格状结构扭曲、皱缩甚至消失(图4(e,f,g,h)).扫描电镜结果表明ZnO NPs处理后,绿草履虫表面结构损伤明显.

图3 ZnO NPs处理(a,b)0h,(c)4h,(d)8h,(e)16h,(f)24h后绿草履虫的整体变化

图4 ZnO NPs处理(a,b)0h,(c)4h,(d)8h,(e,f)16h,(g,h)24h后绿草履虫纤毛和表膜的损伤
2.3.2 绿草履虫内部超微结构的变化
对照组绿草履虫细胞内分布着大量小球藻和射出胞器,与绿草履虫共生的小球藻电子密度较高,被围藻泡包围(图5(a,b,c)).细胞内可观察到双层膜的线粒体(图5(d)).大核明显,核内分布着染色质和染色质粒(图5(e)).表膜由外至内分别为细胞膜、外表膜泡膜、内表膜泡膜,内外表膜泡膜组成表膜泡(图5(f)).

图5 绿草履虫对照组的透射电镜观察结果
绿草履虫经0.39mg/L的ZnO NPs溶液处理4h后,细胞内的线粒体异常聚集(图6(a,b)).绿草履虫细胞内的小球藻开始萎缩消解(图6(c)).
处理绿草履虫8h后,部分线粒体的膜结构消失,电镜下只可见部分散乱的线粒体嵴(图6(d)).16h后染色质粒开始变形(图6(e)).表膜结构异常,表膜泡中开始出现无序膜结构(图6(f)).
经ZnO NPs溶液处理24h之后的绿草履虫,细胞内可以观察到较多的溶酶体(图6(g)).刺丝泡开始消解,边缘呈弥散状(图6(h)).表膜泡中出现了大量圆形、散乱无序的膜状结构(图6(i)).推测这可能是导致表膜破损的主要原因(图6(j)).

图6 ZnO NPs处理4h,8h,16h,24h后绿草履虫细胞内部结构的变化
2.4 锌离子和ZnO NPs颗粒对绿草履虫的细胞毒性


表1 不同浓度ZnO NPs解离出Zn2+的含量
分析ZnO NPs溶液的解离度、锌离子浓度对数与致死率的拟合曲线、ZnO NPs浓度与致死率的拟合曲线(图7),可知ZnO NPs颗粒本身对绿草履虫的毒性大小并没有随着浓度的升高而增大.ZnO NPs浓度较低时,解离出锌离子的量较少,锌离子对绿草履虫毒性贡献不明显,但随着ZnO NPs浓度的升高,锌离子解离出的量随之增加,对绿草履虫毒性贡献也随之增大,ZnO NPs所表现出来整体毒性的增加归因于此.

图7 锌离子(a)和ZnO NPs颗粒(b)对绿草履虫致死率的拟合曲线
2.5 ZnO NPs诱导绿草履虫细胞内氧化应激反应
对照组绿草履虫细胞内只出现少量红色荧光点,而EC50浓度的ZnO NPs处理绿草履虫4h后,细胞内红色荧光增强,细胞核没有出现红色荧光.LC50浓度的ZnO NPs处理4h之后,绿草履虫的细胞核显出明显的红色荧光(图8).对照组、EC50处理组、LC50处理组的平均荧光强度分别为20.04、26.59、35.3,也说明绿草履虫细胞内ROS积累的量与ZnO NPs的处理浓度成正比.

图8 DHE探针检测ZnO NPs处理后绿草履虫细胞内ROS的积累:(a)对照组;(b)EC50实验组;(c)LC50实验组
ZnO NPs处理后的绿草履虫,细胞内可能产生了过多超氧阴离子自由基,这使SOD酶活性大幅上升以降低细胞内自由基的含量.CAT酶的活性在SOD酶被激活的同时也被激活,用以清除细胞内的H2O2.随着处理时间的延长,SOD酶活力受到抑制,CAT的活力也随之下降.整个处理过程中,MDA含量持续上升(图9).
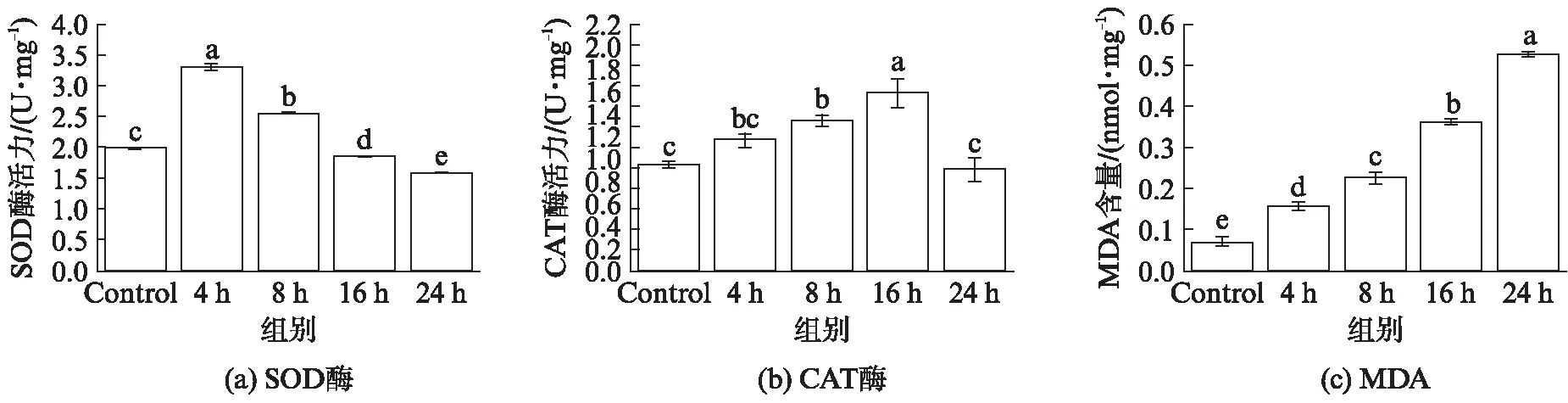
图9 绿草履虫细胞内SOD和CAT酶活性以及MDA量的测定
3 分析与讨论
3.1 绿草履虫在水环境中对ZnO NPs的敏感度较高
通过ZnO NPs对绿草履虫24h内半致死浓度(0.39mg/L)和半最大效应浓度(0.04mg/L)的测定,针对ZnO NPs的毒性,本研究所选用的纤毛虫——绿草履虫,对ZnO NPs的耐受程度与其他受试生物如大型溞(LC50=3.2mg/L)、秀丽隐杆线虫(LC50=2.3mg/L)、斑马鱼(LC50=2.07mg/L)、尾草履虫(EC50=0.44mg/L)等相比较弱[13-16].鉴于绿草履虫对ZnO NPs有足够的敏感性,且具有在水环境中数量多、形态结构方面的研究结果比较明确、容易获得并容易在实验室条件下培养等特点,推荐绿草履虫作为低浓度ZnO NPs在水环境中的指示生物.
3.2 ZnO NPs对绿草履虫致毒机制的探索
对实验组绿草履虫细胞表面进行观察后发现ZnO NPs破坏了绿草履虫的表膜结构.透射电镜观察发现表膜泡中出现了多层圆形膜性结构,推测与氧化应激引起的自噬有关.ZnO NPs所特有的光催化活性,使得它在光照条件下表面被激发出电子(e+),留下电子空穴(h+),-OH, O2和H2O可以与e+, h+反应产生ROS[17].而绿草履虫的趋光性使得ZnO NPs在水中产生的ROS更易对其产生毒害,因此绿草履虫柔软的表膜会直接受到水溶液中ROS的影响,这也许是绿草履虫表膜泡异常、表膜破损的原因.也有研究表明ZnO NPs可以在大肠杆菌细胞膜表面结合并积累,进而破坏细胞膜结构[18-19].
透射电镜下发现ZnO NPs对绿草履虫内部的许多细胞器结构造成了不同程度的损伤.线粒体结构的破坏与绿草履虫细胞内ROS的过量产生密切相关.而线粒体功能的紊乱可导致细胞内ROS的失衡[20].线粒体大分子是氧化损伤的关键靶点,它们结构的破坏会使呼吸链解偶联进而导致ROS的产生、氧化还原应激、细胞因子产生和氧化磷酸化受损等[21].
目前的研究结果表明ZnO NPs主要通过诱导活性氧的产生、Zn2+释放、炎症反应、DNA损伤等途径发挥毒性作用[22-23].DHE荧光探针直观地反应了ZnO NPs引起的绿草履虫细胞内ROS的积累.证明ZnO NPs确实可以诱导细胞内ROS失衡,使细胞遭受氧化胁迫.实验组绿草履虫细胞内与抗氧化有关的SOD酶与CAT酶活性先上升后下降可能是因为细胞内活性氧的积累超过了细胞所承受的限度,导致细胞生物膜和酶系统被破坏.MDA含量持续上升说明绿草履虫细胞内酶抗氧化系统的保护作用不足以与ZnO NPs诱导的氧化胁迫抗衡,绿草履虫在处理过程中经历了严重的氧化应激反应.结合电镜对绿草履虫表面及其内部超微结构的观察结果,推测ZnO NPs通过在水溶液中产生ROS破坏表膜结构,并结合经口摄入后在细胞内部诱导产生ROS破坏内部细胞器,对绿草履虫发挥毒性作用.
虽然ZnO NPs对绿草履虫细胞的毒性明显随着溶液浓度的升高而增大,但从图7可知,低浓度与高浓度的ZnO NPs溶液中颗粒本身所发挥的毒性相差无几,这可能是ZnO NPs颗粒在高浓度溶液中易聚集的原因.浓度升高所引起绿草履虫致死率的升高主要是ZnO NPs解离出的锌离子对绿草履虫的毒性作用.ZnO NPs对细胞毒性的发挥可能通过解离出锌离子诱导ROS产生而实现.此研究结果提示抑制ZnO NPs在水中的溶解度可以提高ZnO NPs的安全性.另外,在研究ZnO NPs毒性作用时,所处溶液的pH值、离子强度、电解质等影响ZnO NPs溶解的因素都应给予考虑[24].
