胆管癌中成纤维细胞生长因子受体基因变异特点、靶向治疗及其伴随诊断的研究进展
2021-04-01刘翠翠殷嘉妮蒋斯明邵阳
刘翠翠,殷嘉妮,蒋斯明,邵阳,2*
(1.南京世和基因生物技术股份有限公司,江苏 南京 210032; 2.南京医科大学公共卫生学院,江苏 南京 210029)
胆管癌(cholangiocarcinoma,CCA)是一种罕见且致死率高的恶性肿瘤,该病的全球发病率逐年上升。对于可手术患者,根治性术后,约35%患者在2年内会复发[1]。绝大多数患者在确诊时,疾病已经发展到了转移性且不可手术的地步[2-3]。晚期转移性CCA患者的标准治疗方案为吉西他滨联合顺铂,但是其5年生存率仍小于2%,且二线及末线治疗手段有限[4]。因此,对于CCA的治疗,急需新的治疗方案和方法。
基因图谱研究显示,近一半的CCA携带潜在治疗靶点,主要包括的激酶基因有成纤维细胞生长因子受体基因(fibroblast growth factor receptor,FGFR1/2/3),磷脂酰肌醇-3-激酶亚基基因(phosphatidylino-sitol-3-kinase,PIK3CA)、间 变性淋巴瘤激酶基因(anaplastic lymphoma kinase,ALK)、表皮生长因子受体基因(epidermal growth factor receptor,EGFR)、表皮生长因子受体2基因(ERBB2)、小鼠肉瘤病毒癌基因同源物B1(murine sarcoma viral oncogene homolog B1,BRAF)、Kirsten大鼠肉瘤病毒癌基因(Kirsten rat sarcoma viral oncogene,KRAS)、母体抗生物皮肤生长因子同源蛋白4基因(mothers against decapentaplegic homolog 4,SMAD4)、异柠檬酸脱氢酶1基因(isocitrate dehydrogenases 1,IDH1)、IDH2、 细胞周期素基因(cyclinD,CCND1)、CCND3、鼠双微体2基因(murine double minute 2,MDM2),以及抑癌基因肿瘤蛋白p53(tumor protein p53,TP53)、乳 腺 癌 易 感 基 因(breast cancer susceptibility genes,BRCA1/2)[5-6]。根 据 肿 瘤 在胆道中的位置,可以分为肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)和肝外胆管癌(extrahepatic cholangiocarcinoma,ECC ),其中,ICC的发生频率占CCA发病率的5% ~ 20%[7-8]。ICC和ECC两者的发病率、危险因素、临床表现均不相同[9],同样的,两者基因突变图谱也不相同:ICC中,常见突变基因为IDH1(30%)、AT丰富结合域1A(AT-rich interaction domain 1A,ARID1A,23%)、BRCA1相关蛋白1基因(BRCA1 associated protein-1,BAP1,20%)以及TP53(20%)和FGFR2融合基因(14%);ECC中常见突变基因为KRAS(40%)、SMAD4(30%)和丝氨酸/苏氨酸激酶11基因(serine/threonine kinase 11,STK11,11%)(见图1)。在CCA常见的突变基因中,TP53常与细胞周期依赖性激酶抑制基因(cyclin-dependent kinase inhibitor 2A,CDKN2A)、CDKN2B突变共发生,而SMAD4和KRAS也存在共突变现象。另外,超出解剖位置上的差异,不同突变基因存在互斥的现象,比如TP53和IDH1、IDH1和KRAS、TP53和BAP1、IDH1和FGFR2[10]。
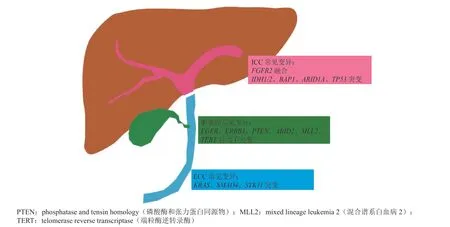
图1 胆管癌分子图谱 Figure 1 Molecular spectrum of cholangiocarcinoma
针对以上靶点的抑制剂有可能成为CCA的潜在治疗方法。2020 美国临床肿瘤学会胃肠道肿瘤研讨会(ASCO GI)的一项研究,对212例胆道肿瘤患者进行FoundationOne CDx检测,筛选到68例具有可用药靶点的患者接受靶向治疗,与未接受靶向治疗的患者相比,中位无进展生存期(median progression-free survival,mPFS)分别为6.2和2.8个月[11],具有显著的临床效果。
FGFR是CCA靶向治疗中重要靶点之一。据报道约20%的ICC病例中存在FGFR通路的异常激活[12-13]。FGFR蛋白主要包括 FGFR1、FGFR2、FGFR3和FGFR4 4个亚型,均具有与配体结合的胞外区、跨膜区和受体磷酸化的胞内区的结构特点,是酪氨酸激酶信号通路的一部分,参与细胞增殖和分化。FGFR分子改变包括胞外结构域和激酶结构域对应的点突变、扩增以及FGFR基因融合,都可导致FGFR信号通路异常激活(见图2),促进细胞增殖、新血管生成、侵袭、转移、抗凋亡等。
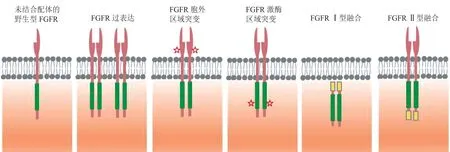
图2 不同FGFR变异类型所导致的FGFR激活模式Figure 2 Activation of FGFR signaling caused by various types of oncogenic FGFR alterations
1 胆管癌中FGFR基因变异图谱
在CCA中,FGFR变异的占比约为7%,变异类型包括融合(3.5%)、扩增(2.6%)、点突变或插入缺失(0.9%)。不同FGFR基因在CCA中的变异频率有明显差异(见表1)。其中,FGFR2是FGFR家族中最高频的CCA相关变异基因,占6.1%[5];其变异形式以融合为主。其他FGFR基因的变异在CCA中也有报道,但是发生率相对较低[10,14-15]。
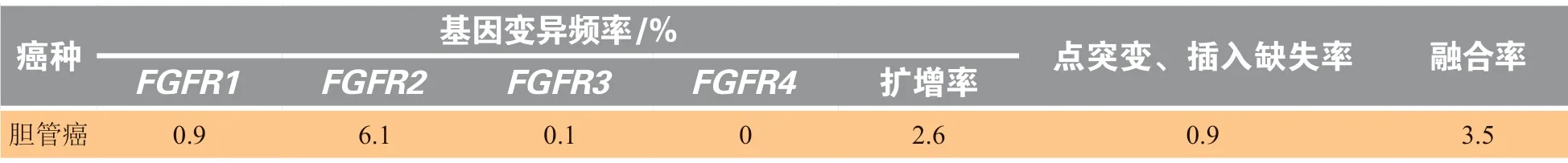
表1 胆管癌中FGFR基因变异频率Table 1 Frequencies of FGFR aberrations in cholangiocarcinoma
传统融合检测与高通量测序技术的发展揭示了FGFR2在CCA中的融合图谱。研究发现,FGFR2融合几乎仅发生在ICC中,发生频率为5% ~ 17%[6,10,14,16-19]。Graham等[17]应用荧光原位杂交技术(fluorescence in situ hybridization,FISH),发现在156例胆道肿瘤患者中有13例携带FGFR2融合,其中12例为ICC患者(12/96,13%)、1例为胆管内乳头状肿瘤。Arai等[16]应用实时荧光定量聚合酶链式反应技术(quantitative real time polymerase chain reaction,qRT-PCR)联合一代桑格(Sanger)测序验证FGFR2融合在CCA中的频率是8.8%(9/102),并且仅在ICC中发生的频率为13.6%(9/66)。另一方面,利用二代测序技术(next generation sequencing,NGS)发现,FGFR的融合断点多位于18号外显子,与伴侣基因的3'端结合,但是其融合伴侣繁富多样,同时,FGFR3的融合在CCA中也有案例报道[15]。一项国际多中心研究[15],对来自10个国家的489例CCA样本进行了多组学分析(全基因组、靶向/外显子组、转录组、DNA甲基化组),定义了4个CCA亚群,其中一个亚组富集FGFR基因变异,包括10例点突变、3例插入缺失、1例扩增以及多种FGFR2融合形式(FGFR2-BICC1,FGFR2-STK26,FGFR2-TBC1D1和FGFR2-WAC),并首次在CCA中检测到FGFR3融合(FGFR3-TACC3)。在该研究中,还观察到FGFR2基因3'非翻译区(3'untranslated region,3'UTR)的丢失现象,这可能是FGFR2激活的新的潜在机制。另外,Nakamura等[6]对260例CCA患者进行了全外显子测序和转录组测序,包括145例ICC、86例ECC和29例胆囊癌。在6例ICC(6/109,5.5%)中鉴定了4种FGFR2融合伴侣:FGFR2-BICC1(3/6)、FGFR2-AHCYL1(1/6)、FGFR2-KCTD1(1/6)和FGFR2-TXLNA(1/6)。除了全基因组全外显子检测,大量针对FGFR融合图谱的研究是基于NGS大panel基因检测。一项针对195例CCA样本(ICC,158例;ECC,27例)的研究[10],基于纪念斯隆凯特琳癌症研究中心癌症基因检测分析平台(MSK-IMPACT)的410个基因的大panel,在19例ICC(12%)患者中检测到16种FGFR2融合形式,常见融合伴侣为BICC1(6/16,37.5%)和KIAA1217(2/16,12.5%),其中BICC1包含多种融合形式。其他融合伴侣异质性较高,都分别以个例形式发生。另一项针对75例CCA患者(ICC,55例;ECC,20例)的图谱研究[14]检测了236个癌症相关基因,在4例ICC(7.3%)中检测到3种FGFR2融合,融合伴侣分别是KIAA1598、NOL4和PARK。还有一项小样本研究[18],针对28例ICC患者做了182个基因的靶向检测,发现4例FGFR2融合(14%),融合伴侣包括KIAA1598、BICC1和TACC3。FIGHT-202 Ⅱ期临床试验[20]入组了107例FGFR2融合胆管癌患者(105例ICC、1例ECC、1例亚型不明确),有56种FGFR2融合类型,其中75%融合类型为患者个体所特有,常见融合伴侣为BICC1,占比为29%。其他较高频融合伴侣包括KIAA1217(4%)、AHCYL1(3%)和SLMAP(2%),剩余融合伴侣频率大多为1% (见表2)。

表2 FGFR2融合伴侣Table 2 Landscape of FGFR2 fusion partners
另外,一项来自日本的研究结果显示,4.8%的肝门旁胆管癌也携带FGFR2融合,而ICC中FGFR2融合发生频率为7.7%[21],这可能与肝门和ICC没有清晰的解剖分类有关,但这也显示了FGFR2融合在胆管癌中变异的复杂性。后续期待更多的研究揭示FGFR2融合在胆管癌不同亚型中的发生频率。
2 靶向治疗在胆管癌中的应用
目前针对CCA的多种FGFR抑制剂处于临床开发的各个阶段,并在难治晚期FGFR融合或变异阳性患者中展现了一定的疗效(见表3)。其中,Ⅱ期 FIGHT-202 的试验结果显示,培米替尼(pemigatinib,Pemazyre®)用于治疗晚期经治FGFR2基因融合阳性的CCA患者,客观缓解率(objective response rate,ORR)高 达35.5%, mPFS和中位总生存期(median overall survival,mOS)分别长达6.9和21.1个月。基于这项研究的结果,美国FDA批准培米替尼作为首个用于治疗携带FGFR2基因融合晚期胆管癌成人患者的靶向药物,并批准FoundationOne CDx作为培米替尼的伴随诊断产品。同时,Ⅲ期随机对照研究FIGHT-302正在开展,探究培米替尼一线治疗携带FGFR2融合的CCA的疗效[20]。此外,多个FGFR抑制剂都在CCA中初现疗效 (见表3),这些研究均显示了FGFR抑制剂以及检测FGFR融合及变异在CCA治疗中的应用价值。

表3 胆管癌中有关FGFR抑制剂临床试验介绍Table 3 Clinical trials of FGFR inhibitors in cholangiocarcinoma
另外,IDH1在ICC和ECC中的突变频率分别约为13%和4%[22-23]。Ⅲ期、多中心、随机ClarIDHy试验结果显示:IDH抑制剂艾伏尼布(ivosidenib)治疗接受过一线以上治疗的IDH1突变的CCA患者的mPFS有所改善,对比安慰剂,分别是2.7和1.4个月,疾病控制率(disease control rate,DCR)分别是53%和28%[24]。另有2款IDH抑制剂达沙替尼(dasatinib)和AG-881(vorasidenib)目前正处于临床研发阶段。研究显示,神经营养素受体络氨酸激酶(neurotrophic receptor kinase,NTRK)在ICC中的突变频率约为3.5%[18],恩曲替尼和拉罗替尼在CCA中也显示出一定治疗疗效[25-26]。BRAF突变(最常见为V600E突变)在ICC中的发生频率为3% ~ 22%[27],在8例BRAFV600E突变接受威罗菲尼(vemurafenib)治疗的胆管癌患者中,1例表现为部分缓解(partial response,PR),4例为病情稳定(stable disease,SD)[28]。ROAR篮子试验的初步结果显示,达拉非尼联合曲美替尼在BRAFV600E CCA队列中显示出一定疗效[29]。BRCA1/2在ICC中的突变频率为1% ~ 4%[6]。一项多中心回顾性研究显示,4例携带种系或体系BRCA1/2突变的CCA患者接受聚腺苷二磷酸-核糖聚合酶(poly ADP-ribose polymerase,PARP)抑制剂治疗后,其中1例患者PFS长达42.6个月[30]。 其他CCA靶标如间质表皮转化因子(mesenchymal to epithelial transition factor,MET)[31]、CDKN2A[32]等目前未显示出治疗前景。
3 FGFR基因检测方法及伴随诊断
伴随诊断是体外诊断的一种,是能够为患者提供特定药物应用的安全性与有效性信息的体外诊断试剂,能帮助医疗工作者评估不同患者的受益程度以及潜在不良反应与风险,并确定最终治疗方案[36]。在肿瘤治疗中,伴随诊断与精准医疗密不可分,用于筛选靶向治疗获益人群、监测治疗反应[37]。针对FGFR基因融合及其他变异的检测不但可以用于筛选抑制剂获益人群,与患者的预后以及肿瘤的惰性状态也相关。比如,携带FGFR融合的患者中位总体生存期(median overall survival,mOS)显著高于FGFR野生型患者[38-39],FGFR融合患者肿瘤处于相对惰性状态[14]。因此有必要在CCA治疗,尤其是靶向治疗中引入FGFR基因检测,目前可用于FGFR基因检测的技术主要有免疫组织化学(immunohistochemistry,IHC)/FISH、qRT-PCR、NGS。
IHC/FISH技术是传统的融合检测方式。IHC是基于抗体对于组织细胞中抗原的特异性识别和结合,通过抗体上显色反应对于细胞中抗原进行定位、定性及定量的技术。IHC并非直接检测肿瘤细胞的遗传学变化,而是检测FGFR蛋白,通过表达量来判断阳性与否。然而,融合不一定会引起蛋白水平的上升,导致假阴性的可能[40]。FISH技术是在待测基因两端设计荧光探针,通过观察两端探针分离程度判定基因融合情况。FISH的结果判读依赖经过严格培训的病理医生,且活检标本肿瘤细胞常达不到要求。同时,IHC和FISH不能确定融合断点的位置、具体融合伴侣等信息,无法发现新的融合伴侣,并且通量低,通常一次检测1个基因的融合。但是基于传统检测技术操作简便、周期短,在特定融合基因的检测中广泛应用。由于FGFR融合伴侣的复杂性,传统检测技术IHC/FISH用于检测FGFR融合局限性较大。所以,传统检测方法中,往往只有FISH技术应用于验证高通量测序鉴定的FGFR融合结果[16]。
qRT-PCR技术利用荧光信号的变化实时检测PCR扩增反应中每一个循环扩增产物量的变化,从而对起始模板进行定性、定量分析。荧光标记方法有染料法和Taqman探针法,Taqman探针法适合目标区域变异检测。在泌尿上皮癌中,FDA批准therascreen®FGFR RGQ RT-PCR Kit(Qiagen)作为厄达替尼的伴随诊断试剂盒,该试剂盒基于qRTPCR技术定性检测患者肿瘤组织中的FGFR基因变异,包括4种FGFR3点突变和3种FGFR3融合 及2种FGFR2融 合(FGFR2-BICC1、FGFR2-CASP7)。qRT-PCR技术操作简单、周期短、相对敏感性较高,然而该方法应用于CCA中FGFR融合的检测存在明显不足:1)qRT-PCR探针根据已知突变位点设计,仅能检测已知突变,对未知突变检出不足;2)检测样本为核糖核酸(ribonucleic acid,RNA),易降解,对样本质量和检测环境要求较高;3)CCA中基因融合伴侣异质性高,多为未知融合,因此该技术在CCA的临床应用中有一定局限性。但是该技术多用于验证NGS鉴定的融合形式,比如Wu等[13]应用qRT-PCR技术验证了4个通过转录组测序(RNA-seq)鉴定的FGFR2融合形式。
NGS高通量测序技术,典型特点是读长短、通量高、准确性高,可以同时检测多个突变、多种变异形式,尤其是在鉴定基因融合伴侣方面具有显著优势,不仅可以揭示罕见新型融合,并能清晰给出融合伴侣和断点信息,辅助判断融合是否有效。有分析显示约10 000种基因融合中的90%通过NGS技术发现鉴定[41]。NGS技术主要分为基于DNA和基于RNA的2种融合检测方式。 基于DNA样本的NGS包括全基因组测序(whole genome sequencing,WGS)、全外显子测序(whole exome sequencing,WES)、目标区域测序,综合考虑检测成本、分析复杂性及检测周期等因素,临床应用中一般采用目标区域测序。另一方面, 基于RNA样本的NGS包括全部信使RNA(messenger RNA,mRNA)测序和目标mRNA测序,前者检测范围全面,后者检测更具针对性,RNA-seq克服了基因组panel检测内含子覆盖不足的问题,也解决了基因组突变,转录组不一定表达的问题,在外显子跳跃和可变剪切方面更具优势,可有效补充基因组基因融合检测。针对全部mRNA测序,在CCA中鉴定了多种FGFR2融合形式[6,13,15],应用靶向mRNA测序,研究者也检测到多种FGFR融合形式[21]。在血液系统肿瘤中,联合DNA-seq和RNA-seq可有效检测的基因突变、拷贝数变异、基因融合等多种变异形式[42],因此在实体瘤融合基因检测方面也可以尝试两者联合检测。另外,一项靶向检测实体瘤中93种激酶及转录因子基因融合的RNA-seq技术,在敏感性和特异性方面分别可达93.3%和100%[43]。 目前,Foundation One CDx是CCA目前唯一获批的伴随诊断,中国还没有针对FGFR基因检测的NGS产品获批。FoundationOne CDx获美国FDA批准作为培米替尼的伴随诊断显示出NGS技术在基因融合检测中的重要作用,该伴随诊断是针对DNA测序。
比较以上几种技术(见表4),NGS技术检测FGFR基因融合优势明显,不仅可以揭示罕见新型融合,并能清晰给出融合伴侣和断点信息,辅助判断融合是否有效。除了融合,前文还提到FGFR基因还存在其他激活性变异,包括激酶结构域的点突变和3'UTR的缺失。同时,尽管CCA中FGFR2靶向治疗显示出一定的应用前景,但是获得性耐药不可避免,Goyal等[38]研究结果显示,3例使用BGJ398有反应的FGFR2融合阳性患者,在疾病进展时均检测到V564F突变,体外实验证明为耐药突变。NGS技术具有高通量特点,同时检测多基因多位点,可以帮助全面揭示驱动和耐药机制,与此同时检测微卫星不稳定性(microsatellite instability,MSI)、肿瘤突变负荷(tumor mutation burden,TMB)、NTRK等泛癌种标志物,为罕见肿瘤患者提供更多用药机会。

表4 FGFR融合检测技术对比Table 4 Comparison of detection methods for FGFR rearrangements
另一方面,分子诊断技术在准确性和精确度上的提升推动了药物的伴随诊断试剂盒的开发。试剂盒根据开发的时间点,可以分为“原研伴随诊断试剂”,即与相关抗肿瘤药物共同开发,或“新研制伴随诊断试剂”,即在抗肿瘤药物上市后开发。因此存在针对同一抗肿瘤药物开发多个伴随诊断试剂的情况。在美国伴随诊断按照医疗器械管理,有3条申请通道,分别是上市前批准通道、上市前通告通道、实验室开发诊断测试通道[36]。我国体外诊断根据产品风险程度高低,依次分为三类、二类、一类产品。三类产品由国家药品监督管理局(National Medical Products Administration,NMPA)审查,二类产品由省、自治区、直辖市药品监督管理部门审查,一类产品实行备案管理,备案人向设区的市级药品监督管理部门提交备案资料。肿瘤相关体外诊断试剂按第三类体外诊断试剂管理,由NMPA审查,第三方医学检验所由临检中心监督管理。中国FGFR基因检测技术主要包括:FISH、qRT-PCR、NGS,其中FISH已有成熟产品,qRT-PCR和NGS方法均有专利申请(见表5)。另外,一些大型检测公司也在其检测panel中加入了多种FGFR家族基因。但是目前NMPA尚未批准任何FGFR相关的伴随诊断产品。

表5 中国FGFR基因检测代表性产品和专利Table 5 Representative detection assays of FGFR rearrangement in China
4 结语与展望
CCA遗传异质性高,常见突变基因有FGFR2、IDH1/2、KRAS、BRAF等,其 中FGFR2融 合 和IDH1/2突变最为重要,因为针对这2个靶点的药物临床研究和药物审批走在前列。培米替尼的获批以及多项临床试验的结果均证实了FGFR抑制剂对CCA的治疗疗效。FGFR2融合作为CCA中常见的FGFR家族变异,在多项临床实验中用于筛选潜在获益人群。CCA基因图谱也报道了其他FGFR基因变异形式,包括扩增、点突变、插入缺失,但发生频率相对较低,因此FGFR基因变异的精准检测对CCA,尤其是ICC的靶向精准治疗至关重要。
目前FGFR2融合检测的方法包括IHC、FISH、qRT-PCR和NGS,4种方法各有优劣势。由于FGFR2基因融合伴侣异质性强,70%以上的患者检测到的融合伴侣均为个体所特有而非共有,最常见的融合伴侣仅占FGFR2融合阳性患者的29%。NGS技术在新型融合伴侣鉴定、明确断点信息方面具有明显优势,但是成本较高。美国FDA批准FoundationOne CDx作为培米替尼的伴随诊断产品,用于检测FGFR2基因融合,该伴随诊断采用NGS技术。目前中国一些大型检测公司在其产品中加入FGFR家族基因检测,但NMPA尚未批准FGFR相关伴随诊断产品。
CCA中不同FGFR2融合亚型患者的预后、对FGFR抑制剂的响应情况是否不同、应用不同检测技术得到的基因融合形式对临床的实用性如何,目前尚不明确,针对中国CCA人群的FGFR基因伴随诊断试剂盒也有待进一步开发。
