大蒜中超氧化物歧化酶提取方法研究
2021-03-30冯伟冯雅琪徐晶雪
冯伟 冯雅琪 徐晶雪

摘 要:以大蒜为试验材料,分别采用磷酸缓冲液提取法、热变性法对其细胞溶质中的超氧化物歧化酶进行提取分离,然后再利用硫酸铵分级盐析法对经热变性和缓冲液抽提所获得的SOD粗提液进行纯化,配合透析除去残留的小分子物质,最后通过测得的SOD酶活力的大小判断提取大蒜SOD的最佳方法,并通过对2种方法中不同参数的优化,找出最佳提取条件。结果表明:热变性法粗提大蒜SOD,透析法配合硫酸铵分级盐析法纯化SOD为最理想的提纯方法。其中热变性法最适温度为60℃,磷酸缓冲液浸提法合适的缓冲液pH值为7.8。
关键词:大蒜;SOD;提取;纯化
中图分类号 S633.4;Q55文献标识码 A文章编号 1007-7731(2021)05-0019-03
Abstract: With garlic as experiment material, adopt the phosphate buffer extraction, thermal denaturation of the extraction and separation of the superoxide dismutase (SOD) in the cytosol, and recycled ammonium sulfate salting out method of the thermal denaturation and buffer extraction of crude extract SOD received by purification, cooperate with dialysis to remove residues of small molecules, at last, through the size of the measured SOD enzyme activity, it is concluded that the best way to extract of garlic SOD, and through the optimization of different parameters in two ways, find out the best extraction conditions. The results showed that thermal denaturation method to extract SOD from garlic and dialysis method combined with ammonium sulfate fractional salting out method to purify SOD were the most ideal purification methods, and the optimal temperature of thermal denaturation method was 60℃. The appropriate buffer pH value in the phosphoric acid buffer leaching method is 7.8.
Key words:Garlic; SOD; Extraction; Purification
超氧化物歧化酶(superoxide dismutase),简称SOD,为生物氧化酶类的重要成员,有“生物体抗氧化系統的第一道防线”之称。SOD由蛋白质和不同的金属辅基组成,广泛存在于微生物以及动物、植物体内,能催化超氧阴离子发生歧化反应,属于金属酶。根据SOD所含金属辅基的不同,目前世界上发现的大多数SOD大致可分为3类,分别为Mn-SOD、Cu/Zn-SOD和Fe-SOD[1]。其中,植物体内含量最为丰富的一类SOD是Cu/Zn-SOD,本研究中的大蒜SOD就属于这一类。
SOD可有效防止机体内氧自由基的损害,避免皮肤受到电离辐射的损伤,可消除体内由于生化代谢产生的超氧阴离子自由基,能有效防止皮肤衰老,同时还有祛斑、抗皱的功效[5]。在医学领域,SOD主要用于治疗如心肌缺血与缺血再灌注综合症、炎症、肿瘤以及一些自身免疫性疾病等因超氧阴离子伤害引起的疾病。SOD还可作为水果和蔬菜的保鲜剂。在农业领域,SOD可以清除逆境下产生的超氧阴离子自由基,这样植物的生长抑制就会被解除[2]。提高SOD在植物体内的表达程度,就有可能通过提高植物对逆境的抵抗能力,进一步培育出抗逆性强、经济效益高的新优良品种。近年来,有关高等植物的SOD研究越来越受到关注。从一些高等植物尤其是经常食用的瓜果、蔬菜以及野生植物中提取的SOD安全性较高,且植物来源广泛,提取成本低。本研究以大蒜为试验材料,对大蒜的SOD进行粗提、纯化,比较磷酸缓冲液提取法、热变性法等提取方法在不同条件下对SOD酶活力的影响,并鉴定得到的大蒜SOD所属的类型。
1 材料与方法
1.1 SOD的粗提
1.1.1 热变性法 将大蒜分瓣并切去蒂部,去皮后选择无霉斑、无黄褐斑点的蒜瓣,洗净晾干,称取250g,将其放入研钵内捣碎成蒜泥状。加入500mL蒸馏水,搅拌充分后4℃条件下静置一段时间。用4层纱布过滤除去杂质,并将得到的滤液平均分成5份。在恒温水浴锅中分别于45、50、55、60、65℃条件下热变性20min,10000r/min离心15min。弃沉淀,上清液即是不同热变性温度下提取到的粗提液[3]。
1.1.2 磷酸缓冲液提取法 配制不同pH的磷酸缓冲液各100mL,缓冲液浓度要求都是0.05moL/L。通过改变缓冲液中磷酸二氢钠与磷酸氢二钠的比例来改变其pH值。所配磷酸缓冲液的pH分别为7.0、7.2、7.4、7.6、7.8、8.0。称量 6份去皮洗净的大蒜瓣,每份为50g,分别放入6个研钵中。每个研钵中加入事先配制好的不同pH的磷酸缓冲液各100mL,将其充分研磨(冰盐浴条件下进行),静置一段时间后分别用4层纱布过滤去杂,收集的滤液用冷冻高速离心机10000r/min离心15min。弃沉淀,上清液即是不同pH的磷酸缓冲液浸提所得的SOD粗提液[3]。
1.2 SOD粗提液的纯化
1.2.1 硫酸铵分级盐析法 所需固体硫酸铵的量可根据待纯化溶液的体积(mL)和硫酸铵饱和度常用表计算得到。称取所需的量,将其研磨成粉末状待用。搅拌得到的粗酶液,同时加入硫酸铵至饱和度45%,4℃条件下静置1h,10000r/min冷冻离心15min,弃沉淀,取无色透明的上清液。继续将固体硫酸铵粉末加至上清液中,至最终饱和度为90%,于4℃条件下静置2h左右,10000r/min冷冻离心15min,收集底部白色沉淀,此沉淀即为纯化后的SOD。加入硫酸铵的过程应在冰盐浴条件下进行[4]。
1.2.2 透析法 将经过硫酸铵分级盐析法纯化得到的SOD沉淀用约1/20原始提取液体积的磷酸二氢钠溶液溶解,然后用剪刀截取适宜长度的透析袋,在清水中煮沸5min。将充分溶解的SOD倒入透析袋内,在4℃条件下透析过夜(或透析至无硫酸根离子检出),每4h换1次缓冲液。测SOD酶活力。硫酸根离子可用事先配制好的氯化钡检测,若有硫酸根离子存在,加入氯化钡后透析袋内会产生白色沉淀[4]。
1.3 SOD酶活力测定 选择邻苯三酚自氧化法测定SOD酶活力[5]。邻苯三酚在碱性条件下会发生自氧化反应,产生超氧阴离子自由基。自氧化反应会因为SOD的存在受到一定的抑制。所测邻苯三酚自氧化速率越小,说明自氧化反应中抑制作用越大,即得到的大蒜SOD酶液酶活力越大。SOD酶活力单位定义:在lmL反应液中,1min抑制邻苯三酚自氧化速率达到50%的酶量定为1个活力单位(U)。酶活力的计算公式如下:
酶活力(U/mL)=[0.07-A325/min0.07×100%50%×n×Vv]
式中:A325:325nm下的OD值;n:样液稀释倍数;V:反应液总体积(mL);v:样液体积(mL)
1.4 SOD酶类型鉴定 根据邻苯三酚自氧化测酶活法,采用抑制剂敏感性试验,将本研究最后得到的SOD酶液进行酶的类型鉴定。SOD的类型不同,对抑制剂氯仿-乙醇和H2O2的敏感性也不同。其中,Cu/Zn-SOD只对H2O2敏感,对氯仿-乙醇不敏感;Mn-SOD只对氯仿-乙醇敏感,对H2O2不敏感;而Fe-SOD对H2O2和氯仿-乙醇都敏感[5]。向酶液分别加入0.5mmoL/L、1mmoL/L的氯仿-乙醇和H2O2,15min后测定酶活,并与室温酶活进行比较,以此判断SOD酶的类型。若两者都有抑制作用,则为Fe型;若只有H2O2对其有抑制作用,则为Cu-Zn型;若只有氯仿-乙醇对其有抑制作用,则为Mn型。
2 结果与分析
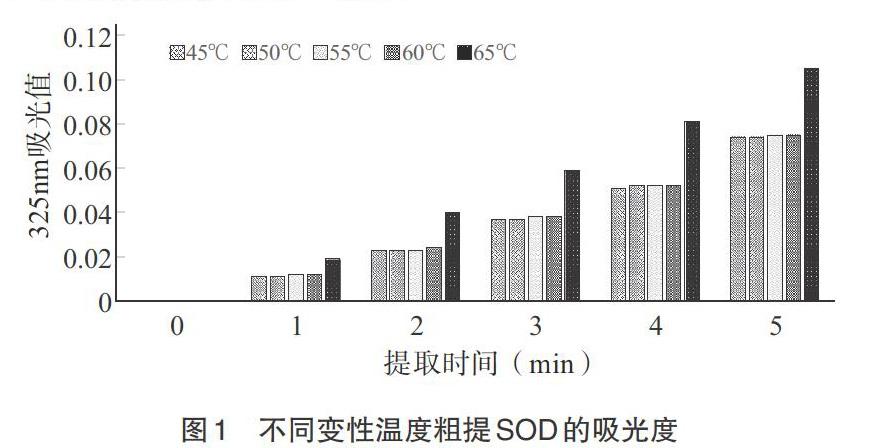
2.1 SOD粗提热变性法 热变性法中,测定变性温度分别为45、50、55、60、65℃,粗提时间为1~5min,测定粗提得到的SOD的光吸收值。由图1可知,变性温度为60℃时自氧化反应受到的抑制程度最大,60℃变性处理后OD325为0.015。由此可见,温度过高会影响SOD活性,温度过低时粗酶液中会残留较多杂蛋白,最适热变性温度为60℃。通过计算,60℃条件下经过热变性处理最终粗提得到的SOD酶活力为2865.22U/mL。
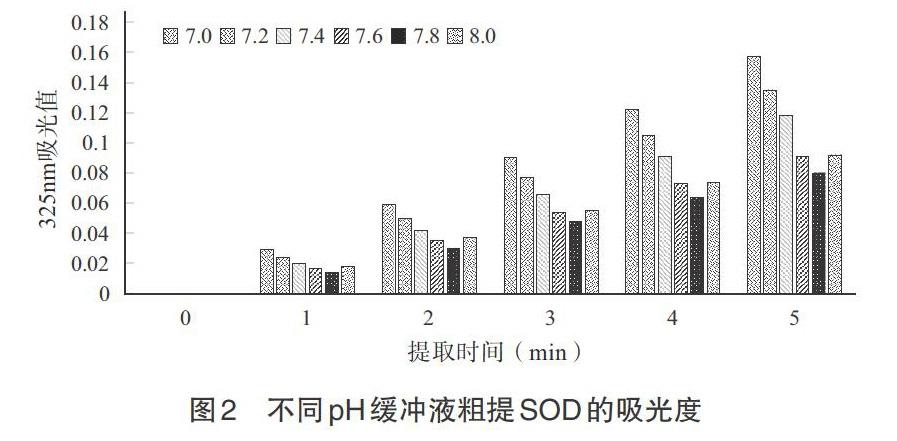
2.2 SOD粗提磷酸缓冲液提取法 磷酸缓冲液提取法中,测定磷酸缓冲液的pH分别为7.0、7.2、7.4、7.6、7.8、8.0,粗提時间为1~5min,测定粗提得到的SOD的光吸收值。由图2可知,当所用磷酸缓冲液pH为7.8时OD325值最小,为0.016,通过计算得到SOD酶活力为2274.81U/mL。对比热变性法粗提得到SOD酶活力数值可知,热变性法为最佳选择,最佳变性温度为60℃。
2.3 SOD粗提物的纯化 采用硫酸铵分级盐析法对经60℃条件下热变性获得的大蒜SOD粗提液进行纯化,纯化后得到的SOD酶液进一步透析脱盐。最终测定提纯得到的SOD酶液抑制速率为0.003/min(A325nm)。通过计算可知,经纯化后的大蒜SOD酶活力为3790.53U/mL。
2.4 酶的类型 由图3可知,该酶只对H2O2敏感,对氯仿-乙醇不敏感。因此可初步确定该酶是Cu/Zn-SOD,即大蒜SOD属于Cu/Zn-SOD。
3 结论与讨论
试验结果表明:热变性法提取大蒜SOD最合适的变性温度为60℃,磷酸缓冲液提取法提取大蒜SOD最合适的缓冲液pH值为7.8,且热变性法提取的大蒜SOD酶活力大于磷酸缓冲液提取法提取的大蒜SOD酶活力。因此,热变性法(60℃)是提取大蒜SOD最适合的方法。大蒜SOD粗提液经硫酸铵分级盐析法纯化,然后进一步透析脱盐,得到的SOD酶液的酶活力明显高于SOD粗提液的酶活力。因此硫酸铵分级盐析法配合透析脱盐为较理想的SOD纯化方法,SOD酶活力可达3790.53U/mL。通过对大蒜SOD的酶类型进行鉴定,发现该酶只对H2O2敏感,对氯仿-乙醇不敏感。因此,可判定大蒜SOD为Cu/Zn-SOD。
参考文献
[1]刘春菊,孟宪军,宣景宏.树莓超氧化物歧化酶的分离纯化和部分性质研究[J].西北农业学报,2006,15(3):142-144.
[2]郭善军,陈章宝.木瓜SOD的提取及其活性测定方法的优化[J].科技资讯,2020,18(18):66-68.
[3]张瑞益,李强,相微微,等.不同品种赤小豆子叶SOD提取技术优化及活性研究[J].山西农业科学,2019,47(04):681-685.
[4]朱小文.不同提取条件对植物组织SOD、POD和CAT酶活性的影响[J].食品科技,2018,43(05):265-269.
[5]王莹,刘凤霞,杨海朝,等.微量连苯三酚自氧化法测定SOD活性的条件优化[J].中国食品添加剂,2019,30(11):114-119.
(责编:徐世红)
