热碱预处理后得克隆对污泥厌氧发酵产酸及污泥特性的影响
2021-03-30赵建伟孙英杰卞荣星张大磊青岛理工大学环境与市政工程学院山东青岛266033青岛市固体废物污染控制与资源化工程研究中心山东青岛266033
张 静,赵建伟*,孙英杰,卞荣星,高 莹,张大磊(1.青岛理工大学环境与市政工程学院,山东 青岛266033;2.青岛市固体废物污染控制与资源化工程研究中心,山东 青岛 266033)
剩余活性污泥(WAS)是活性污泥法的主要副产物,据 2017年报道,我国全年的污泥产量高达2×107t(以含水率 80%计)[1],WAS中含有大量病原体、重金属和其他有毒有害的物质,其物理、化学性质不稳定.在堆存、运输和处理过程中,WAS组分性质会不断发生变化,若处理处置不当,就会造成严重的环境污染,甚至威胁生态和人类的安全.此外,WAS还含有大量的有机物(如蛋白质、多糖)以及氮、磷和多种微量元素,因此WAS也是一个理想的资源库.因污泥厌氧发酵技术能同步实现能源物质(短链脂肪酸,甲烷等)的获取、污泥减量化与无害化而被广泛探究.
WAS厌氧发酵的性能取决于污泥的特征及运行条件(如预处理、温度、pH值等).然而,目前对WAS厌氧发酵的探究多集中于后者.例如 Hao等[2]探究了温度对WAS产酸的影响,提出较高的发酵温度可以提高关键水解酶的活性,从而促进酸的积累.Zhao等[3]通过游离亚硝酸预处理,探究对污泥发酵产酸的影响,结果显示该预处理方式可缩短发酵时间,同时提高酸的产量.WAS中除可降解的有机质外,还含有多种新兴污染物,其中阻燃剂污染现状及其对生化代谢的影响得到了学者的关注.
得克隆(DPs,C18H12Cl12),又称双(六氯环戊二烯基)环辛烷,是一种添加型有机氯脂肪族阻燃剂[4].得克隆在国外已广泛应用于塑料、纤维等高分子材料的阻燃,作为阻燃剂Mirex的替代品,DPs具有低毒、高着火点等优良特性,是目前应用和研究最广泛的阻燃剂物质之一.DPs具有高度的疏水性和亲脂性,可在生物体内积累,并在食物链的各级营养生物中逐渐扩大.同时,DPs稳定性较好,很难被生物和自然光降解,可以在环境中长期稳定存在[5].DPs的存在对微生物新陈代谢有潜在的影响,DPs的暴露导致碳水化合物、脂质、核苷酸和能量代谢的基因表达发生显著变化,并进一步影响信号传导过程.李宇霖等[4]研究表明 WAS中 DPs的浓度高达 12.3mg/kg干重.广泛的生产和使用必然会导致 DPs在环境中富集,因此在WAS中富集的DPs浓度也将呈现上升趋势[5].污泥厌氧发酵是由微生物、功能酶等调节的生物过程,污泥中富集的 DPs对污泥发酵性能及污泥主要特征的影响至今报道较少,这也阻碍了研究者对这一行为的理解.因此,本论文以 WAS和 DPs为研究对象,构建序批式厌氧反应器,在中温环境探究了不同剂量 DPs对污泥厌氧发酵产酸的影响,并通过分析在DPs影响下污泥发酵系统中主要有机物含量、污泥理化特征的变化,解析DPs影响污泥发酵的作用机制.本工作取得的结果对理解 DPs影响WAS厌氧发酵性能及污泥理化性质具有一定帮助作用,且该实验结果为今后污泥循环利用提供了一定的参考.
1 材料与方法
1.1 实验材料
实验WAS取自青岛市某污水处理厂二沉池,收集的样品首先用不锈钢网(2.0mm)过滤以去掉大颗粒杂质,然后WAS在实验室重力沉淀24h后去掉上清液并储存于4℃的冰箱内备用.实验所用WAS的主要特征如表1所示.实验所用DPs购买于湖南某化工园区,纯度在 98%以上,密度约为 1.8kg/m³,分解温度约为285℃.

表1 实验所用WAS的主要特征Table 1 The main characteristics of WAS used in the experiment
1.2 实验设置
在本实验中,建立一批四个工作容积为 1.0L的厌氧发酵反应器.为了消除产甲烷古菌对厌氧消化产酸过程的干扰,在实验中,采用热处理和 BESA(2-溴乙烷磺酸)抑制产甲烷古菌的活性[6-7].首先将1.8L浓缩污泥进行碱性预处理(pH=10,4.0mol/L NaOH),在102℃加热30min,冷却至室温后将上述预处理污泥平均分配至三个相同的反应器内,将50mmol/L的BESA添加至每个反应器.由于DPs的消耗量日益增大导致其在污泥中富集量增加,因此本研究中 DPs的含量分别控制在 0mg/kg TSS,30.0mg/kg TSS,300.0mg/kg TSS.作为对照,在另一反应器中加入 20mL接种污泥,然后再加入20mL DPs悬浮液和 560mL去离子水,以评估 DPs厌氧降解对有机物释放的贡献,其中悬浮液的制备为将 0.01g DPs溶解于 120mL蒸馏水中,制备0.08g/L的悬浮液.最后,所有反应器均用高纯氮气处理 60s,以排尽氧气,保证厌氧环境,以 150r/min的搅拌速度将反应器置于 35℃的空气浴中,整个厌氧发酵实验持续16d,整个实验重复3次.
1.3 分析方法
采用标准方法对COD、SCOD、TSS和VSS进行了分析[8].采用热提取法进行胞外聚合物(EPS)提取[9],将预处理后的 WAS移至有磷酸盐缓冲液锥形瓶中,在80℃的条件下水浴加热20min,每10min取样一次,将取出的混合物在4℃、12000r/min条件下离心 15min,上清液为含 EPS的溶液.采用 Lowry-Folin法测定蛋白质,以牛血清白蛋白为标准品[10].采用苯酚硫酸法测定多糖,以葡萄糖为标准品[11].采用PHS-3C型pH计测量上清液的pH.采用钼酸铵分光光度法测定磷酸盐(GB11893-89),采用纳氏试剂分光光度法测定氨氮(HJ535-2009).厌氧发酵污泥上清液通过0.45μm滤膜后采用日本分光F97Pro荧光分光光度计测定 3D-EEM.厌氧发酵污泥冻干后送上海某检测机构测定扫描电子显微镜(SEM)、傅里叶红外光谱(FT-IR).
本实验使用气相色谱仪(GC112A,中国)进行短链脂肪酸(SCFA)的测定,色谱柱类型为 DB-FFAP(30m×0.25μm×0.25mm),检测器为氢火焰离子化检测器(FID).气相色谱条件如下:载气为 N2,流速为25mL/min,入口和检测器温度分别为250℃和300℃,初始炉温60℃持续1min,设定温度以20℃/min的速度升温并在100℃持续2min,然后以10℃/min的速度将温度升至180℃持续1min,进样量为1.0μL.且污泥产酸过程中的总挥发酸浓度以COD表示,计算公式如下:
总 SCFAs质量浓度(COD)=乙酸质量浓度×1.065+丙酸质量浓度×1.512+异丁酸质量浓度×1.816+正丁酸质量浓度×1.816+异戊酸质量浓度×2.037+正戊酸质量浓度×2.037[12].蛋白质、多糖与COD的转化系数分别为1.5和1.06[12].
2 结果与讨论
2.1 DPs对WAS厌氧发酵产酸的影响
DPs对WAS厌氧发酵产SCFA的影响见图1,由图 1(a)可知,除单独 DPs的发酵反应体系,其余各污泥发酵反应器内SCFA的含量随时间先升高后下降,但DPs的存在抑制了SCFA的产生.在不添加DPs的组别中,SCFA 的最大产量为(217.3±10.1)mg COD/g VSS,对应最佳发酵时间为5d,这一结果与之前的实验结果相吻合[13].当DPs的含量为30.0mg/kg TSS时,污泥发酵体系中 SCFA的最大产量下降至(170.7±8.3)mg COD/g VSS,仅为空白组的0.79倍,说明低剂量 DPs已显著抑制污泥厌氧发酵产酸.当DPs的含量进一步升高至300.0mg/kg TSS时,SCFA的最大产量进一步下降至(151.2±6.6)mg COD/g VSS,约为空白组的0.70倍.上述结果表明DPs对污泥厌氧发酵产酸具有抑制作用,且 DPs含量越大,污泥产酸抑制越显著.需要注意的是本研究所用的DPs含量对污泥发酵产酸的最佳时间无影响,全部污泥厌氧发酵产酸的最佳时间均为 5d.DPs单独降解产酸最大含量仅为(27.9±1.1)mg COD/g VSS,结果表明DPs厌氧降解对SCFA的贡献十分有限,这可能与 DPs类物质具有高亲脂性,难于生物降解和光降解有关[14].本研究中SCFA主要以C2~C5的小分子有机酸构成,各组分所占比例对SCFA的后续应用具有重要影响.由图 1(b)可知,全部反应器中乙酸盐含量最大,约占 71.2%~84.7%,这与之前的研究相一致[15].然而DPs的存在却降低了乙酸盐的百分含量,在空白组中,SCFA最大值时乙酸盐占比84.7%,而当DPs含量升高至30.0mg/kg TSS,乙酸盐占比降低至74.9%,这可能与 DPs显著抑制产乙酸菌相关.丙酸和异丁酸随着DPs投加量的增大而增加,当DPs的投加量从0增加到300.0mg/kg TSS,丙酸、异丁酸增加量分别为6.3%、3.6%.这可以得出结论,DPs抑制SCFA积累主要是由于乙酸的产量减少.

图1 DPs对WAS厌氧发酵产SCFA的影响Fig.1 Effect of DPs on the SCFA production from WAS anaerobic fermentation
2.2 DPs对WAS理化性质的影响
pH值是影响厌氧消化的关键因素,对厌氧消化系统菌群生理代谢及生长繁殖等均有明显影响.如图2所示,除预处理初始调节pH值为10,各反应器pH 值均在 7.17~7.51,处于微碱性状态,且变化趋势几近一致,表明各实验组均处于稳定运行状态.实验前 5d,pH值呈明显下降趋势,主要是污泥厌氧发酵酸化过程强于甲烷化过程,导致SCFA的积累并降低pH 值.在第 5d,空白组的 pH 最低为(7.17±0.1),添加300.0mg/kg TSS DPs的 pH 值为(7.21±0.1),这表明DPs对WAS厌氧发酵产酸有较明显的抑制作用,并且DPs含量越高,抑制作用越强.

图2 DPs对WAS厌氧发酵过程中pH值的影响Fig.2 Effect of DPs on pH during WAS anaerobic fermentation
如图 3(a)所示,在初始状态下,WAS呈直径700nm左右的颗粒状,污泥表面光滑.如图 3(b)所示,在发酵24h后,空白组的WAS颗粒出现裂解,当DPs存在于污泥发酵体系后,污泥表面形态发生显著变化.随着 DPs含量的增加,污泥的形态呈片状聚集越明显.如图 3(c)和(d)所示,SEM 图像显示投加30.0mg/kg TSS DPs在24h时,其组成是粒径为100~300nm的紧密堆积的颗粒,当DPs增长到300.0mg/kg TSS时,WAS的颗粒形成表面粗糙的大片颗粒聚集物.这证实了厌氧发酵污泥在 DPs的影响下会促进WAS物理裂解,且DPs的含量越高,污泥絮体或细胞裂解越明显,继而影响后续污泥厌氧消化的过程.

图3 不同DPs投加量下WAS的扫描电镜Fig.3 Scanning electron microscopy of WAS with different dosages of DPs
不同DPs投加量下WAS的FT-IR如图4所示.在3000~3600cm-1处吸收峰较强且峰宽度较宽,主要为羧酸和糖类中羟基伸缩振动吸收所致,并且在800~1200cm-1对应于多糖中—C-OH的抗对称拉伸,空白组中,反应器在24h时,特征吸收峰的透过率降低,这是因为在反应初期大分子碳水化合物在水解菌的作用下分解为小分子糖,当 DPs投加量从30.0mg/kg TSS增长到300.0mg/kg TSS时,特征吸收峰的透过率显著降低,并且发生了偏移,这表明吸收率增大,化学键强度发生较大变化,这可能是由于WAS中的大分子有机物在水解菌的作用下分解为小分子有机物导致化学键的改变,WAS中DPs含量的增加促进了多糖的分解.表 2展示了典型红外光谱吸收峰及其归属.在1630~1653cm-1的吸收峰特征带是由芳香环中代表蛋白质的二级结构的—C=O的高度共轭产生,在 24h时空白组特征吸收峰的透过率明显低于初始时刻空白组,这是因为在反应初期蛋白质开始分解,当DPs投加量从30.0mg/kg TSS增长到300.0mg/kg TSS 时,特征吸收峰的透过率显著降低,DPs含量的增加促进了蛋白质的分解导致氨基酸的产生.这进一步证实了在 DPs的影响下会促进WAS的裂解过程,这一结论与SEM结论相吻合.
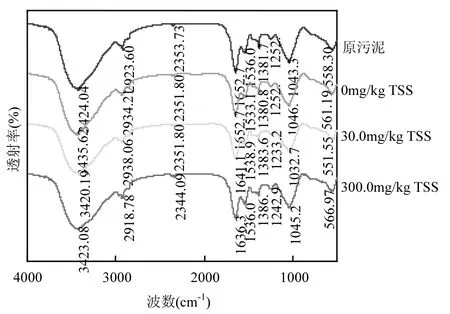
图4 不同DPs投加量下WAS的FT-IR光谱Fig.4 FT-IR spectra of WAS with different dosages of DPs

表2 典型红外光谱吸收峰及其归属Table 2 Typical infrared absorption peaks and their assignment
WAS的 3D-EEM 光谱如图 5所示.在初始时刻,WAS有275~300/340~360nm、340~360/425~ 460nm两个主要的荧光峰.在 24h时空白组中有三个主要的荧光峰,Ex/Em 在 270~275/305~310nm 处的荧光峰被认为是氨基酸,在 350/420nm 处的荧光峰被认为是类腐殖酸,390~415/460~470nm 处的荧光峰被认为是类富里酸.当在污泥发酵系统投加DPs时,荧光组分发生了较大的变化.当DPs剂量从30.0mg/kg TSS增加到300.0mg/kg TSS 时,除 270~275/305~310nm 处的荧光峰位置相近外,另外两个主要荧光峰分别为 360/435nm和415/465nm、360/440nm和410/470nm存在一定程度上的红移和蓝移.并且在反应过程中,随着时间的增加,所有荧光峰的荧光强度都显著增加,且随着DPs投加量的增加,所有峰的荧光强度逐渐减小,这表明在 DPs的投加抑制了类腐殖酸、类富里酸的产生,这在一定程度上抑制了厌氧的酸化过程,继而抑制了结合态EPS和胞内物质的溶解,减缓了氨基酸等小分子物质的产生.

图5 不同DPs投加量下WAS的3D-EEM光谱Fig.5 3D-EEM spectroscopy of WAS with different dosages of DPs
2.3 DPs对水解的影响
蛋白质和多糖是活性污泥中有机质的主要组成成分,通常情况下以大分子颗粒物的状态存在,而在厌氧发酵过程中,这些颗粒状态的蛋白质和多糖在细菌胞外水解酶的水解作用下转化为溶解性物质后,才能被微生物更好的利用.水解过程通常较为缓慢,因此污泥中有机物的水解被认定为污泥发酵的限速步骤[15],通过测定发酵初期的溶解性蛋白质和多糖的浓度及SCOD的变化情况可以反映活性污泥中的营养成分的溶解程度.DPs对WAS中SCOD释放的影响如图 6(a)所示,添加不同含量的 DPs,反应器中的SCOD均呈现先上升后下降的趋势.第3d时 SCOD 达到最大值,空白组为(4580±223)mg/L,当DPs浓度增加到300.0mg/kg TSS时反应组内SCOD最大浓度仅为空白组的0.74倍.根据以上变化情况,可以出看出DPs的存在对WAS中的SCOD有抑制作用,且随着DPs的浓度升高,抑制作用越明显.并且,溶解性蛋白质和多糖与 SCOD的变化趋势一致,如图 6(b)和(c)所示.所有反应器中可溶性蛋白质和多糖的浓度随发酵时间的增加先增加后降低.在空白组中,WAS中蛋白质和多糖的最大值在 3d出现,分别为(1311.7±40.1),(108.0±2.1)mg COD/L,而随着DPs从30.0mg/kg TSS增长到300.0mg/kg TSS,蛋白质和多糖的含量分别由(1233.8±50.1)mg COD/L降低到(1181.8±46.7)mg COD/L、(100.3±7.8)mg COD/L降低到(99.4±8.4)mg COD/L.在实验过程中WAS上清液中溶解性蛋白质与多糖含量均随 DPs含量呈下降趋势,说明 DPs抑制了溶解性有机质的释放,当DPs的含量为300.0mg/kg TSS时,溶解性蛋白质和多糖的最大浓度分别为(1181.8±46.7)mg COD/L和(99.4±8.4)mg COD/L,为空白组中溶解性蛋白质和多糖浓度最大值的90.1%和92.0%.这可能与 DPs对厌氧水解关键酶活性的抑制相关,且本研究结果表明DPs含量越高,DPs对WAS厌氧发酵有机质释放抑制越明显.
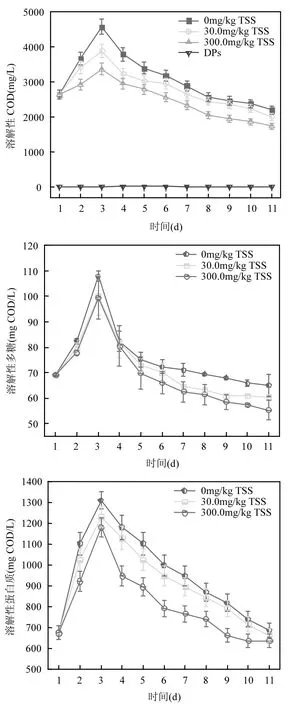
图6 DPs对WAS中溶解性COD(a)、溶解性蛋白质(b)和溶解性多糖(c)的影响分析Fig.6 Effect of DPs on the SCOD(a)、soluble protein(b)and soluble polysaccharide(c)from WAS anaerobic fermentation
生物絮凝过程对 WAS的物理性质有重要的影响,大多数细菌产生的胞外聚合物(extracellular polymeric substances,EPS)在生物絮凝中起着主导作用[16],是微生物为保护自身免受有毒物质侵害而分泌的物质密集网络,是微生物应对有毒潜在威胁的第一道屏障物质[17],EPS填充了细菌间的空隙形成絮体结构,占 WAS总有机物质的 50%~90%,具有重要的生理功能[18].如图7(a)所示,EPS总量随DPs含量的增加而减少,这可能是由于 DPs对污泥中SB-EPS水解微生物的抑制作用较为显著导致,空白时,SB-EPS含量为(1738.9±86.5)mg COD/L.当DPs用量增加到300.0mg/kg TSS 时,SB-EPS含量下降到(1461.8±54.8)mg COD/L,占空白的 84.06%,这可能由于DPs吸附到WAS絮体表面,进而抑制水解关键酶的活性,因此降低了 SB-EPS的含量,也表明DPs降低了WAS中溶解性有机物质的含量,这一结果也与图6(b)和(c)结果一致.LB-EPS和TB-EPS在成分、基团组成上存在差异,这也会影响WAS的絮凝性能.然而,高浓度DPs的存在对LB-EPS的含量有显著促进作用.在空白组中,LB-EPS的含量为(174.7±8.8)mg COD/L,当 DPs的含量增加至300.0mg/kg TSS时,LB-EPS的含量为(232.5±9.2)mg COD/L,是空白组的 1.33倍.倪丙杰等[19]证实,LB-EPS对活性污泥絮凝起决定性作用,WAS中LB-EPS含量增多时,絮体 Zeta电位增大,导致絮体间静电斥力增大,阻碍了污泥絮凝,与 LB-EPS相比,TB-EPS对污泥絮凝的影响较小,而 DPs的存在对TB-EPS无明显的影响.EPS中的亲水基团和疏水基团对WAS的脱水性能有重要影响.EPS中的疏水基团导致其与水无法产生相互作用且不能产生氢键,因此 EPS从污水中分离的同时带走污水中部分疏水性污染物.但刘轶等[20]认为,对 WAS脱水性能起决定作用的不是 EPS总量而是其各组分间的比例,如图 7(b)所示,空白组中溶解性蛋白质/溶解性多糖的比值为15.17,当DPs的投加量增长至300.0mg/kg TSS时,溶解性蛋白质/溶解性多糖的比值为15.09,这表明污泥的Zeta电位减小,絮体间静电斥力减弱.
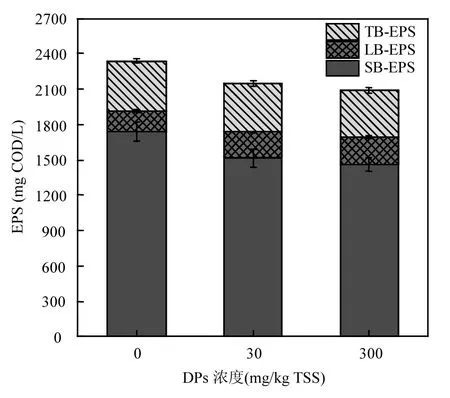

图7 DPs对WAS中EPS含量及相关比例的影响Fig.7 Effect of DPs on EPS content and the relative proportion in WAS
2.4 DPs对WAS厌氧发酵过程NH4+-N和PO43--P释放的影响
氮、磷是导致水体富营养化的主要原因,而蛋白质的水解是释放 NH4+-N的主要原因之一[21].本研究中投加 300.0mg/kg TSS高剂量的 DPs相对30.0mg/kg TSS低剂量 DPs会导致 WAS中更多NH4+-N和PO43--P的释放,而微生物结构蛋白中氮和磷的含量差别是发酵液中磷浓度比氮浓度低的原因之一.在整个发酵过程中,厌氧发酵液中NH4+-N浓度在发酵初始阶段急速提高,如图8(a)所示,空白组在第 2d时达到(236.9±7.6)mg/L,而在第3d时,空白组的NH4+-N浓度降至(205.6±7.8)mg/L,这可能是由于发酵初期 NH4+与 OH-在碱性环境下大量形成 NH3·H2O,导致 NH4+-N 的含量迅速增多,待达到体系内的动态平衡后,NH3·H2O 负反馈抑制蛋白质水解,导致 NH4+-N 含量下降.在之后的发酵过程中 NH4+-N的浓度随发酵时间的增加而增加,在发酵结束时三个反应器分别达到(361.6±15.3)mg/L、(375.3±15.2)mg/L 和(378.1±16.3)mg/L.而发酵过程中PO43--P的变化如图8(b)所示,空白组中溶解性PO43--P在第2d达到(17.6±2.1)mg/L之后浓度骤然下降,后在1.3mg/L~6.2mg/L的范围内逐渐保持平稳,加入不同剂量 DPs的两个反应器大致呈相同趋势,这可能是因为PO43--P在碱性条件下与污泥中的 Mg2+、Ca2+形成了难溶的 PO43--P沉淀[22],使反应后期PO43--P含量较低.

图8 DPs对WAS中NH4+-N(a)和PO43--P(b)释放的影响Fig.8 Effect of DPs on the ammonia nitrogen(a)and phosphate(b)from WAS anaerobic fermentation
3 结论
3.1 DPs会影响WAS厌氧发酵产酸,且DPs含量越高,SCFA的产生量越少,其中当DPs含量为300mg/kg TSS时,WAS碱性预处理(pH=10)后SCFA的最大产量为(151.2±6.6)mg COD/g VSS,仅为空白组的0.7倍.SCFA组分分析表明DPs对SCFA组分影响不明显,且DPs主要降低乙酸的含量.
3.2 DPs能影响污泥理化性质,SEM,FT-IR及EEM分析表明 DPs促进了污泥裂解过程,然而 DPs对WAS中溶解性有机物的含量却存在抑制作用,且DPs浓度越高,溶解性有机物的含量越低.当 DPs含量为300.0mg/kg TSS,SCOD的最大浓度仅为当空白组的 0.74倍,随着 DPs从 30.0mg/kg TSS增长到300.0mg/kg TSS,蛋白质和多糖的含量分别由(1233.8±50.1)mg COD/L 降低到(1181.8±46.7)mg COD/L、(100.3±7.8)mg COD/L降低到(99.4±8.4)mg COD/L.
3.3 DPs降低了WAS中EPS的含量,且DPs含量越高,EPS含量降低越明显,且主要降低 SB-EPS的含量,当 DPs的含量增加到 300.0mg/kg TSS 时,SB-EPS 含量下降到(1461.8±54.8)mg COD/L,占空白的 84.06%.此外,DPs还影响 NH4+-N和 PO43--P的释放,高含量的 DPs促进了发酵液内NH4+-N和PO43--P的释放.
