弥散加权成像鉴别诊断儿童良恶性肝肿瘤
2021-03-30丁雅玲曹代荣马小敏黄新发陈春华
丁雅玲,曹代荣,马小敏,张 杰,黄新发,陈春华
(1.厦门大学附属妇女儿童医院 厦门市妇幼保健院放射科,福建 厦门 361003;2.福建医科大学附属第一医院影像科,福建 福州 350005)
肝肿瘤是儿童期较少见的腹部占位性病变,其病理类型多样。不同病理类型儿童肝肿瘤的治疗方式及预后不同,鉴别诊断儿童肝肿瘤良恶性具有重要临床意义[1-2]。MRI具有良好的软组织对比度,无辐射,在诊断儿童肝肿瘤方面具有良好的临床应用前景[3];但良恶性肝肿瘤之间部分影像学征象类似,且钆对比剂脑内沉积等问题常导致术前MRI鉴别诊断儿童良恶性肝肿瘤困难。弥散加权成像(diffusion weighted imaging, DWI)可量化评价组织内水分子弥散,已广泛用于鉴别诊断成人肝脏良恶性肿瘤和评估疗效[4]。本研究观察DWI鉴别诊断儿童肝脏良恶性肿瘤的价值。
1 资料与方法
1.1 一般资料 回顾性分析2012年1月—2018年10月32例临床疑诊肝脏占位性病变患儿男18例,女14例,年龄4天~18岁,中位年龄4.5岁;29例为单发肝内病灶,3例为多发肝内病变。纳入标准:①术前接受MR检查;②图像质量良好,无明显运动伪影或磁敏感伪影;③检查前未经任何治疗。
根据病理及影像学随访结果,最终诊断良性肿瘤16例(良性组),包括局灶结节性增生7例、血管瘤7例(根据典型平扫及增强MRI表现诊断)、血管性错构瘤1例、囊肿1例;恶性肿瘤16例(恶性组),包括肝母细胞瘤9例、转移癌5例(神经母细胞瘤来源1例、肾母细胞瘤2例、尤因肉瘤1例、未知来源1例)及肝细胞癌2例。
1.2 仪器与方法 采用Siemens Verio 3.0T、GE Signa 1.5T MR扫描仪,8通道体部相控阵线圈。检查前患儿禁食>4 h,对于不能配合检查的患儿于检查前给予口服10%水合氯醛0.5 ml/kg体质量镇静。采用仰卧位检查,头先进,腹部加压固定。常规扫描序列:①T2W,TR/TE=2 000 ms/79 ms,FOV 180~320 mm,层厚3 mm;②T1W,TR/TE=3.92 ms/1.39 ms,FOV 180~320 mm,层厚3 mm。DWI采用自旋回波-平面回波成像序列,TR/TE=6 000 ms/73 ms,FOV 180~320 mm,层厚3 mm,b值为0、800 s/mm2(Siemens,Verio)和0、600 s/mm2(GE,Signa),3个弥散方向。DWI扫描采用自由呼吸模式,扫描后自动重建ADC图。
1.3 图像分析 将ADC图像传至图像存储与传输系统(picture archiving and communication systems, PACS),对单发病灶选取病灶实性最大层面、多发病灶选取最大病灶实性最大层面进行分析。由2名放射科医师(医师1为工作12年的主治医师;医师2为工作30年的主任医师)在不知晓病理结果的前提下判读肝脏病灶实性部分DWI信号特点,意见不一时经讨论达成共识。病灶DWI信号特征分类:①弥散受限,与肌肉相比,病灶高b值DWI呈高信号,ADC图呈低信号;②T2穿透效应,病灶DWI呈高信号,ADC图呈高信号;③弥散增加,病灶DWI呈等或低信号,ADC图呈高信号;④中等弥散,病灶DWI等或高信号,ADC图呈等信号。
于ADC图上于病灶直径最大层面实性区域放置6个ROI(60 mm2),避开出血、坏死、血管、钙化和囊变区域,获取病灶最大ADC值(ADCmax)、最小ADC值(ADCmin)和平均ADC值(ADCave)。
1.4 统计学分析 采用SPSS 19.0统计分析软件。符合正态分布的计量资料以±s表示,非正态分布者以中位数(上下四分位数)表示。以Fisher精确概率法比较组间DWI信号特点差异,独立样本t检验比较ADC参数差异。绘制受试者工作特征(receiver operating characteristic, ROC)曲线,计算曲线下面积(area under the curve, AUC),评价各ADC参数鉴别诊断良恶性肝肿瘤的效能。P<0.05为差异有统计学意义。
2 结果
良性组16例中,8例病灶DWI呈T2穿透效应(血管瘤4例、局灶结节性增生3例、错构瘤1例),见图1;2例DWI呈弥散增加(局灶性结节增生1例、囊肿1例);6例DWI呈中等弥散(局灶性结节增生3例、血管瘤3例),见图2。恶性组16例中,13例病灶DWI呈弥散受限(肝母细胞瘤8例、肝细胞癌2例、转移癌3例),见图3;2例呈T2穿透效应(转移癌2例),1例呈中等弥散(肝母细胞瘤1例)。DWI呈弥散受限占比恶性组为81.25%(13/16),良性组为0(P<0.001);良恶性组间T2穿透效应、弥散增加及中等弥散分布差异均无统计学意义(P均>0.05)。
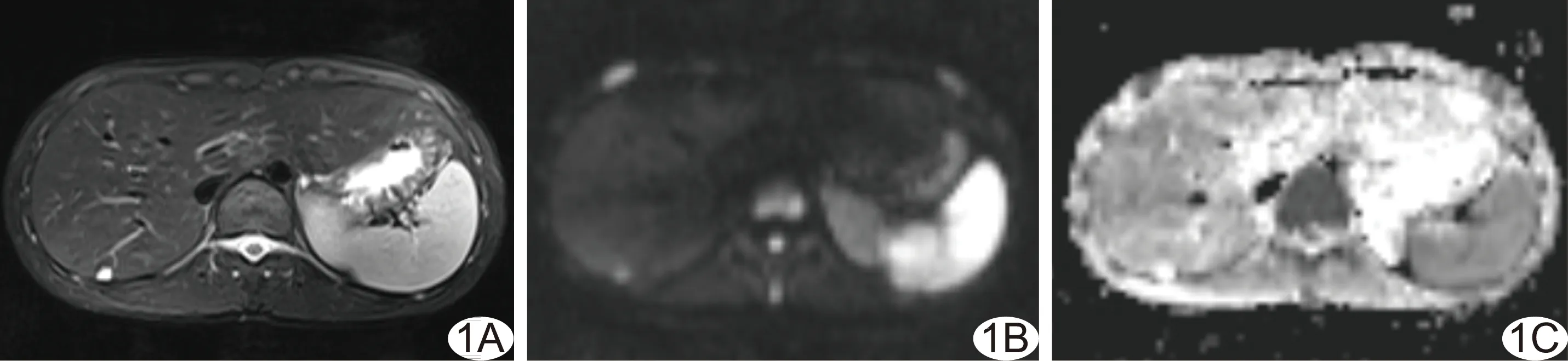
图1 患儿男,15岁,肝脏血管瘤 A.轴位T2WI示肝右叶肿块,边界清楚,呈不均匀高信号; B、C.DWI图示肿块呈高信号(B),ADC图示肿块呈高信号(C),即T2穿透效应
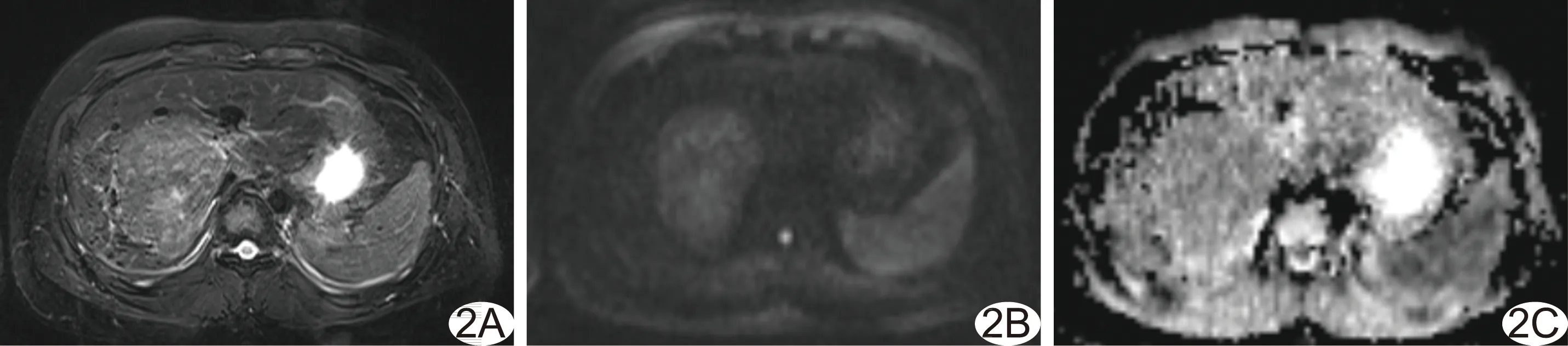
图2 患儿男,18岁,肝脏局灶性结节增生 A.轴位T2WI示肝右叶肿块,边界清楚,呈不均匀高信号; B、C.DWI图示肿块呈高信号(B),ADC图呈等信号(C),即中等弥散
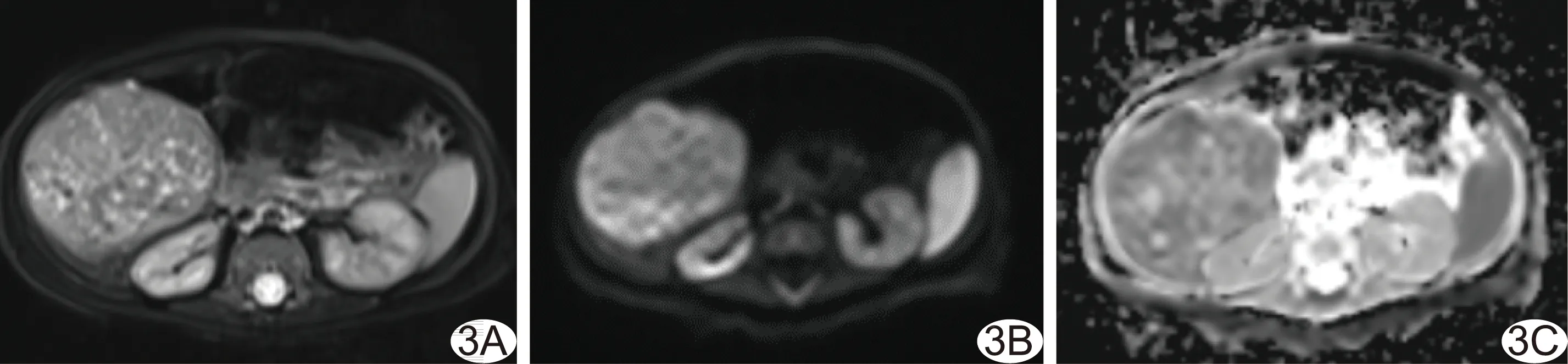
图3 女性患儿,3个月,肝母细胞瘤 A.轴位T2WI示肝右叶肿块,边界清楚,呈不均匀高信号; B、C.DWI图示肿块呈高信号(B),ADC图呈不均匀低信号(C),即弥散受限
表1 儿童良恶性肝肿瘤ADC值比较(×10-3 mm2/s,±s)

表1 儿童良恶性肝肿瘤ADC值比较(×10-3 mm2/s,±s)
组别ADCmaxADCminADCave良性组(n=16)1.88±0.421.74±0.411.81±0.42 局灶性结节增生(n=7)1.61±0.311.50±0.291.55±0.30 血管瘤(n=7)1.94±0.021.76±0.121.85±0.08 血管性错构瘤(n=1)2.272.132.20 囊肿(n=1)3.052.882.98恶性组(n=16)1.39±0.571.10±0.251.25±0.43 肝母细胞瘤(n=9)1.09±0.200.98±0.171.03±0.18 转移癌(n=5)1.95±0.711.27+0.301.64±0.56 肝细胞癌(n=2)1.39±0.351.20±0.281.29±0.31
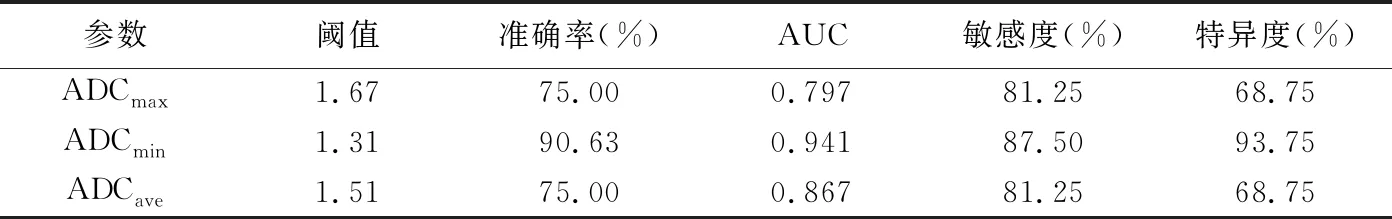
表2 ADCmax、ADCmin及ADCave鉴别诊断儿童肝脏良恶性肿瘤的效能
恶性组ADCmax、ADCmin和ADCave均小于良性组(t=2.75、5.33、3.71,P=0.01、<0.01、<0.01),见表1。ROC曲线显示,ADCmax、ADCmin、ADCave均可用于鉴别儿童良恶性肝肿瘤(P均<0.05),ADCmin阈值为1.31×10-3mm2/s时,其鉴别儿童良恶性肝肿瘤的AUC最大(0.941),见表2和图4。b值为0和800 s/mm2时,肝肿瘤ADCmin值为(1.62±0.55)×10-3mm2/s;b值为0和600 s/mm2时为(1.33±0.40)×10-3mm2/s,差异无统计学意义(t=-1.517,P=0.15)。
3 讨论
对于儿童肝肿瘤,治疗前明确其良恶性能够避免耽误病情和不必要的手术[1,5-8]。MRI是评估儿童肝肿瘤的主要手段,主要基于常规T2WI和增强T1WI所示病灶信号强度和强化特征鉴别良恶性肿瘤[3,9]。然而部分良恶性肿瘤存在相似MRI表现,且钆对比剂可沉积于脑内齿状核与基底节等区域,在儿童患者MR检查中使用钆对比剂存在风险[10]。
DWI通过评估正常组织和病变组织内微观水分子弥散情况而实现精确诊断肝肿瘤,已广泛用于鉴别诊断成人肝肿瘤[11-12],近年来,DWI亦被用于诊断和鉴别诊断儿童常见腹部肿瘤[13]。GAWANDE 等[13]研究显示DWI能够有效鉴别儿童良恶性腹部肿瘤,当ADC阈值为1.29×10-3mm2/s时,其鉴别诊断敏感度和特异度分别为80%和77%。此外,DWI序列能够采用自由呼吸扫描,无需镇静,尤其适用于低龄儿童[14]。
本研究结果显示儿童良恶性肝肿瘤DWI表现出不同信号特点。良性组中血管瘤、错构瘤和囊肿多呈T2穿透效应,局灶性增生结节以中等弥散为主,均未显示弥散受限;而恶性组中81.25% 表现为弥散受限。此外,肿瘤实性区域ADC值结果显示恶性组ADCmax、ADCmin和ADCave均小于良性组,且良性组中囊肿和错构瘤的ADC值均较高,与CARO-DOMíNGUEZ等[15]的研究结果相符。恶性肿瘤ADC值较低是由于组织内肿瘤细胞核大、核浆比增加且细胞排列紧密,导致细胞内、外间隙变窄,水分子弥散受限;而良性肿瘤细胞排列疏松且核浆比较低,对水分子弥散影响较小,故ADC值较高。本研究ROC曲线分析结果显示,以ADCmin=1.31×10-3mm2/s为阈值时,其诊断儿童肝脏恶性肿瘤的AUC最大(0.941),准确率为90.63%,与既往DWI鉴别成人肝脏良恶性肿瘤研究结果[4]相近,表明DWI可用于鉴别儿童肝脏良恶性肿瘤。
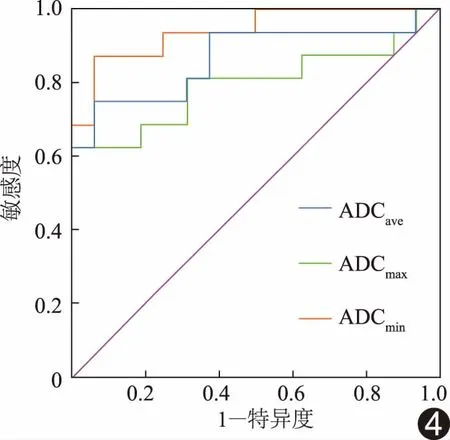
图4 ADCmax、ADCmin及ADCave鉴别诊断儿童肝脏良恶性肿瘤的ROC曲线
本研究的局限性:①为单中心回顾性研究,病例数少,可能存在抽样误差;②儿童较少罹患肝肿瘤,本组病例来源于2家医院,采用2种不同型号机器和b值获取ADC值,可能存在测量偏差,但本组b值为0和800 s/mm2时肝肿瘤ADCmin与b值为0和600 s/mm2时差异均无统计学意义,提示数据稳定性较好;③良恶性组均包含多种病理类型肿瘤,可能对结果产生影响。
