基于增强CT影像组学特征预测难治性恶性黑色素瘤肺转移患者的免疫治疗疗效
2021-03-30侯芳婧朱海涛崔传亮李晓婷孙应实高顺禹
常 燃,侯芳婧,朱海涛,崔传亮,李晓婷,孙应实,高顺禹*
(1.北京大学肿瘤医院暨北京市肿瘤防治研究所医学影像科,恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142;2.满洲里市人民医院放射科,内蒙古 呼伦贝尔 021400;3.北京大学肿瘤医院暨北京市肿瘤防治研究所肾癌黑色素瘤内科,北京 100142)
转移性恶性黑色素瘤(malignant melanoma, MM)侵袭性较高。近年来,程序性死亡受体1(programmed death receptor, PD-1)/程序性死亡配体1(programmed death ligand, PD-L1)抑制剂治疗晚期恶性黑色素瘤效果日渐凸现[1-2]。CT是黑色素瘤术后复查及评价辅助治疗疗效的重要手段。本研究探讨CT相关影像组学特征可否用于预测免疫治疗黑色素瘤效果。
1 资料与方法
1.1 一般资料 回顾性分析2017年1月—2019年12月49例恶性黑色素瘤肺转移患者,男24例,女25例,年龄24~75岁,平均(51.6±11.6)岁;均接受二线PD-1单抗单药(JS001,特瑞普利单抗)免疫治疗,静脉注射240 mg/次,每2周1次,根据治疗反应决定具体疗程。纳入标准:①恶性黑色素瘤术后出现肺转移、经化疗无效或进展;②接受既定方案PD-1单抗免疫治疗;③治疗前2周内接受胸部增强CT;④临床、影像学及病理资料完整。排除标准:①未能接受完整免疫治疗;②因碘过敏或其他原因不能接受增强CT或CT图像质量差、数据不完整;③合并其他恶性肿瘤;④肺转移瘤病理诊断结果不明确。按照实体瘤疗效评价标准(respond evaluation criteria in solid tumors, RECIST)RECIST 1.1[3]评价疗效(即RECIST 1.1真值),入组病例经免疫治疗后平均无进展生存时间(9.84±10.43)个月,根据疗效分为疾病进展组(n=17)和非进展组(n=32),后者包含部分缓解组(n=16)和疾病稳定组(n=16)。
1.2 仪器与方法 采用GE Discovery CT750 HD宝石能谱CT机,扫描范围自肺尖至肺底,管电压120 kV,采用自动mAs技术,螺距1.375∶1。采用Ulrich高压注射器以流率3.5 ml/s经肘正中静脉注入非离子型对比剂(碘海醇300 mgI/ml) 1.0 ml/kg体质量,再以相同流率注射生理盐水30 ml,30 s后行动脉期增强扫描。图像重建层厚及层间距均为5.0 mm,同时行标准算法纵隔窗图像重建(窗宽350 HU,窗位40 HU)和骨算法肺窗图像重建(窗宽1 500 HU,窗位-500 HU)。
1.3 图像采集与分割 从图像存储与传输系统(picture archiving and communications systems, PACS)导出图像,以3D-Slicer软件在增强CT肺窗图像上手动逐层勾画ROI,直至包含整个肺内转移灶。由1名专业方向为胸部诊断的影像学主治医师完成病灶分割,以不同颜色在图中突出显示不同靶病灶勾画区域,见图1;再经另1名专业方向为肿瘤影像学诊断的主任医师确认病灶分割结果,必要时加以修正。
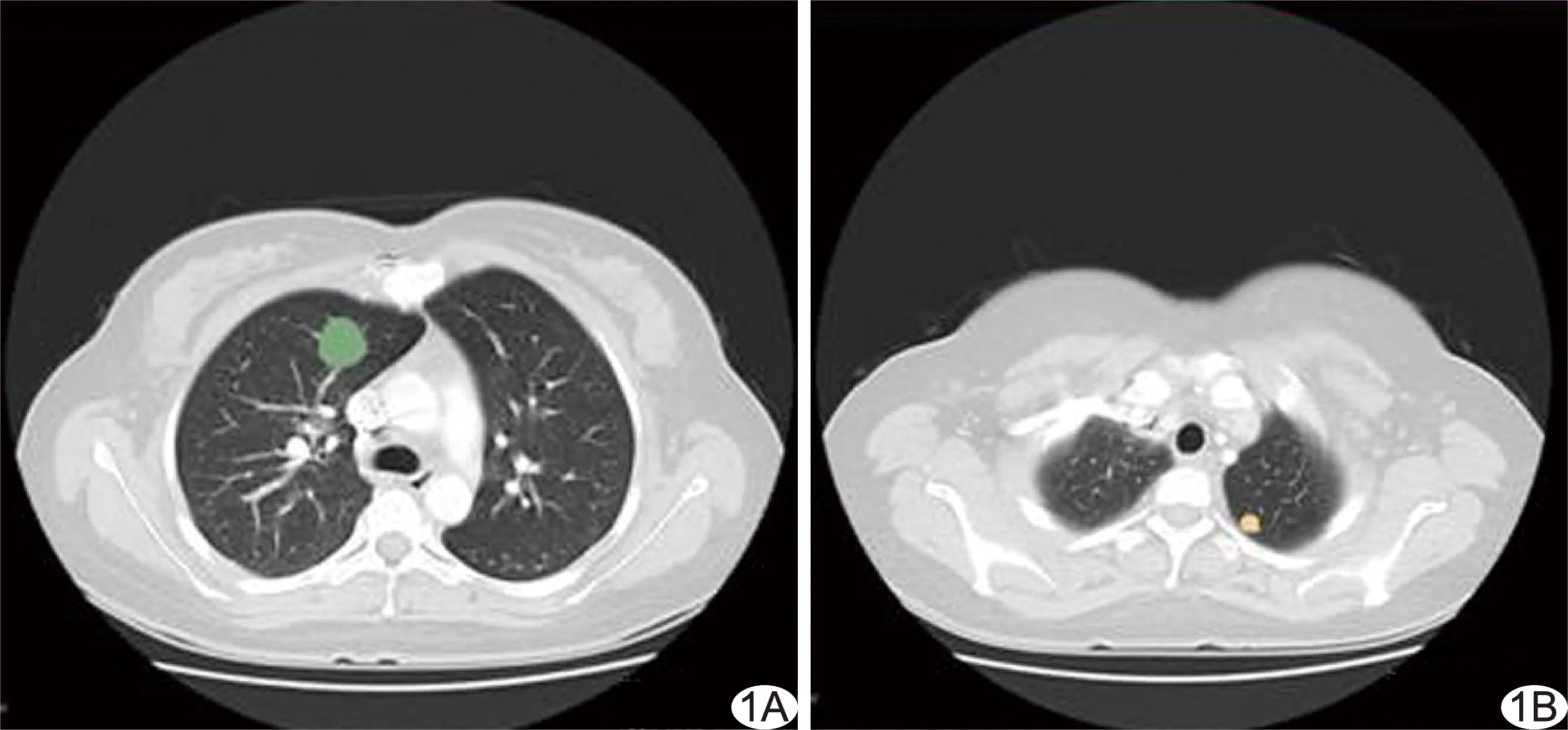
图1 患者女,26岁,恶性黑色素瘤肺转移,于肺窗图像上选取靶病灶 A. 靶病灶1(绿圈)位于右肺上叶; B. 靶病灶2(黄圈)位于左肺尖
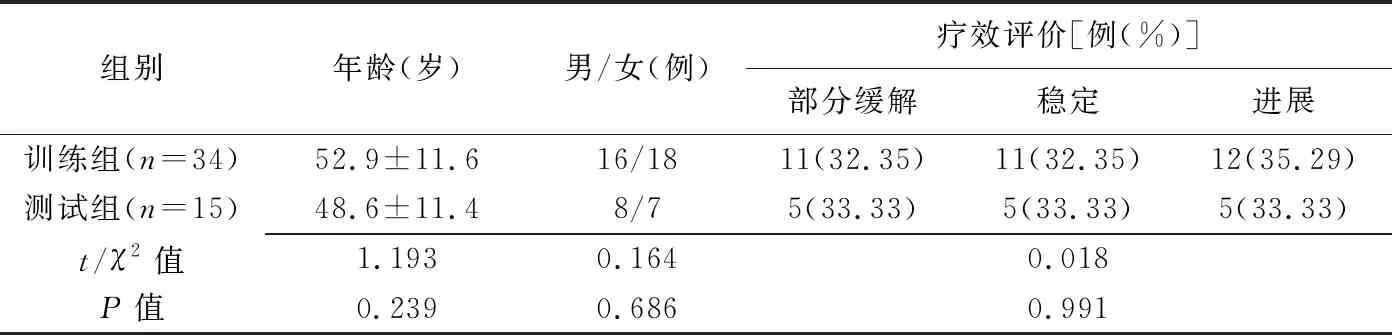
表1 训练组、测试组一般资料比较
1.4 特征筛选与模型建立 采用scikit-learn软件包的Pyradiomics程序[4-6]提取、分析靶病灶特征。按照7∶3比例随机将患者分为训练组(n=34)和测试组(n=15),比较2组患者年龄、性别及疗效;以训练组数据构建模型,以测试组数据进行检验。首先按照如下公式对特征参数进行z-score标准化:
1.5 统计学分析 采用SPSS 20.0统计分析软件。以独立样本t检验比较年龄,以χ2检验比较性别和疗效,P<0.05为差异有统计学意义。对比模型预测进展概率与RECIST 1.1真值间,绘制受试者工作特征(receiver operating characteristic, ROC)曲线,计算曲线下面积(area under the curve, AUC);以约登指数最大值所对应的点(即敏感度与特异度之和最大的点)作为界值区分进展与非进展,计算阳性预测值与阴性预测值。采用R语言(4.0.2)软件的决策曲线分析(decision curve analysis, DCA)评价模型获益,曲线横轴为风险阈值,预测概率在该阈值之上则为阳性;纵轴为净获益,定义为真阳性样本数-假阳性样本数×风险阈值/(1-风险阈值)。
2 结果
2.1 一般特征 训练组和测试组患者年龄、性别及疗效差异均无统计学意义(P均>0.05),见表1。
2.2 影像组学特征 对每个病灶提取841个特征,包括13个形状特征、92个灰度特征及其8种小波变换后特征(3个方向上的高通和低通滤波)。92个灰度特征包括23个灰度共生矩阵特征(gray level co-occurrence matrix, GLCM)、18个一阶灰度特征(first order features)、16个灰度区域大小矩阵特征(gray level size zone matrix, GLSZM)、16个灰度游程矩阵特征(gray level run length matrix, GLRLM)、14个灰度相关矩阵特征(gray level dependence matrix, GLDM)和5个相邻灰度差分矩阵特征(neighboring gray tone difference matrix, NGTDM)。最终提取3个特征,即wavelet-HHH_glszm_Low Gray Level Zone Emphasis、wavelet-HHL_first order_Skewness和wavelet-LLL_gldm_Small Dependence High Gray Level Emphasis,其在SVM模型中的系数分别为1.47、-1.38和3.38。
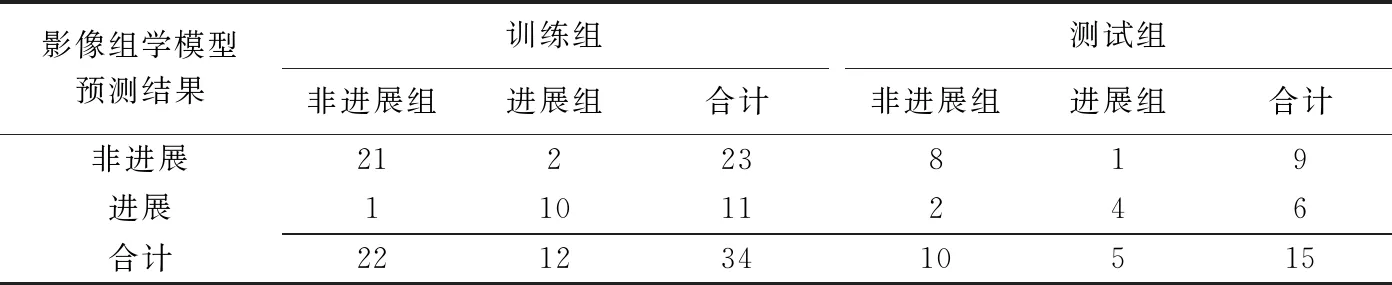
表2 影像组学模型对训练组和测试组的预测结果(例)
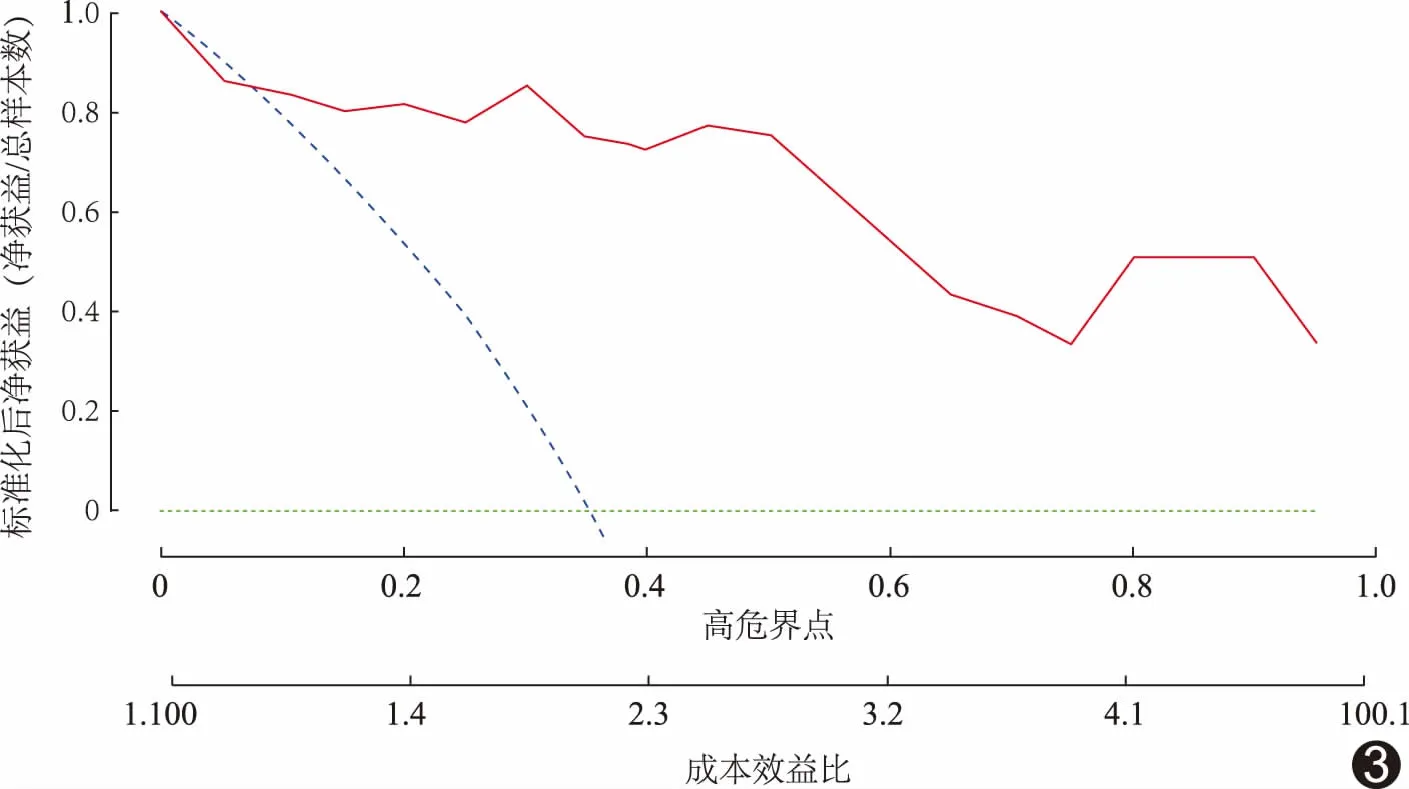
图3 DCA曲线 Radiomics model(实线)表示影像组学模型结果,None(短虚线)表示将所有样本按照阴性(非进展)处理结果,All(长虚线)表示将所有样本按照阳性(进展)处理结果
ROC曲线(图2)显示训练组AUC为0.913 (95%CI:0.777,1.000),测试组AUC为0.860(95%CI: 0.643,1.000)。以敏感度与特异度平衡点,即二者之和最大值所对应的概率作为阈值判定病变是否进展,该平衡点下的混淆矩阵分别描述模型在训练组和测试组的真阳性、假阳性、真阴性和假阴性例数(表2),计算得到预测训练组病变进展的敏感度、特异度、准确率、阳性预测值和阴性预测值分别为83.3%、95.5%、91.2%、90.9%和91.3%;预测测试组病变进展的敏感度、特异度、准确率、阳性预测值和阴性预测值分别为80.0%、80.0%、80.0%、66.7%和88.9%。DCA曲线显示影像组学模型在风险阈值0.1~1.0间较大范围内的净收益优于None模型和All模型(图3)。
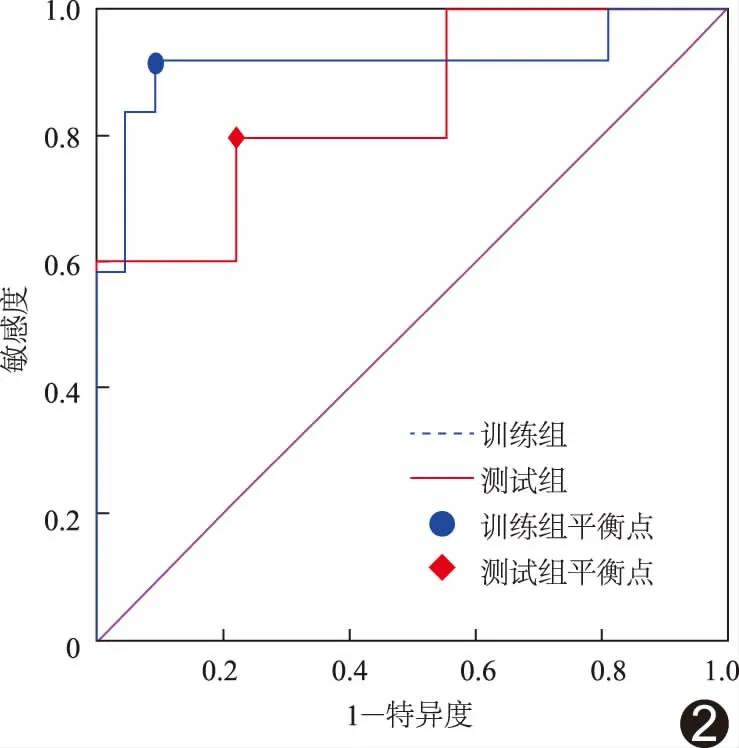
图2 训练组和测试组影像组学模型ROC曲线
3 讨论
免疫治疗通过激发体内免疫系统杀伤肿瘤细胞,增强肿瘤免疫微环境[7-8]。肿瘤免疫重建过程中,免疫检查点通路激活可引起肿瘤免疫逃逸,故治疗前应严格筛选适用的患者群体,但目前尚缺少有效的预测性指标。通过对图像信息进行定量化处理,影像组学可提取大量与肿瘤形态学、组织学相关的影像特征参数,以反映肿瘤异质性和生物学行为,用于诊断病变、评估预后及预测疗效具有很好的临床应用前景[9]。
本研究提取的恶性黑色素瘤肺内转移靶病灶增强CT影像组学3个特征参数分别为wavelet-HHH_glszm_LowGrayLevelZoneEmphasis、wavelet-HHL_firstorder_Skewness和wavelet-LLL_gldm_SmallDependenceHighGrayLevelEmphasis。第1个特征为3个方向高通小波变换后的灰度区域大小矩阵特征,反映低灰度区域在图像中所占比例;林春苗等[10]认为该参数主要通过量化病灶中像素值相同区域来描述病灶的复杂性、纹理的粗细程度等信息,该值越大提示病灶越复杂、异质性越强,进展可能越大,该特征与肿瘤进展呈正相关。第2个特征为层内高通滤波层间低通滤波后灰度分布的偏度特征,反映灰度分布相对于均值的对称性,病灶内灰度分布越偏向低信号,则肿瘤异质性越高、进展可能越大,该特征与肿瘤进展呈负相关。第3个特征为3个方向低通滤波后的相邻灰度差分矩阵特征,张静等[11]认为该特征反映高灰度像素周围小范围内高灰度像素数量,代表病灶对周围组织的小范围微浸润,数量越多代表微浸润越显著,反映肿瘤生物学行为对周围微环境异质性的改变,该特征与肿瘤进展呈正相关。
本研究训练组与测试组AUC均在0.85以上,敏感度、特异度和准确率均在0.8以上,而阴性预测值则均在0.89以上,提示基于黑色素瘤术后肺转移胸部CT增强纹理分析模型预测PD-1免疫治疗效果的效能良好。为避免过拟合,通常纳入模型的特征数不超过训练组中单类样本数的1/3。本研究样本量较少,训练组中发生进展的样本数为12,而最终模型中纳入的特征数为3个,可基本满足避免过拟合要求。
本研究的不足之处:①因转移性恶性黑色素瘤免疫治疗多处于临床试验阶段,入组样本量少;②为回顾性分析,仅纳入增强动脉期CT图像,而未观察平扫及静脉期增强CT图像。
综上所述,胸部增强CT影像组学有助于预测难治性恶性黑色素瘤肺转移患者对免疫治疗的反应,结合临床因素和影像学特征可预测PD-1单抗免疫治疗效果。
