聚焦超声联合程序性死亡蛋白1单克隆抗体治疗大鼠脑胶质瘤
2021-03-30李进丹罗玥媛郭效宾廖承德
李进丹,王 瑞,杨 军,罗玥媛,郭效宾,廖承德
(云南省肿瘤医院 昆明医科大学第三附属医院放射科,云南 昆明 650118)
胶质瘤是中枢神经系统(central nervous system, CNS)最常见恶性肿瘤,恶性程度及致死率均高。大脑血脑屏障(blood brain barrier, BBB)是临床治疗胶质瘤困难的主要原因。聚焦超声(focused ultrasound, FUS)与超声造影剂微泡(microbubbles, MB)相结合,可局部、无创地暂时开放BBB。近年来,以程序性死亡蛋白1(programmed cell death protein 1, PD-1)单克隆抗体(简称单抗)为代表的免疫治疗用于多种肿瘤展现出极大潜能。本研究通过动物实验观察FUS与PD-1单抗协同治疗胶质瘤的价值。
1 材料与方法
1.1 实验材料 50只6~8周龄雄性SD大鼠购于昆明医科大学实验动物中心[SCXK(滇)K2015-0002],体质量80~100 g。C6细胞株购自昆明动物所,培养后经胰酶消化制成细胞悬液(细胞浓度约2~5×105个/ml)。本研究经昆明医科大学伦理委员会审核通过(批准号:kmmu2021006)。
1.2 测试FUS安全性及BBB开放 随机选取10只大鼠测试FUS安全性及BBB开放情况,见图1A。经尾静脉注射MB(六氟化硫微泡,声诺维©,上海博莱科信谊药业)0.2 ml/100 g体质量,以低功率聚焦超声实验装置(重庆融海超声医学工程研究中心有限公司,重庆)行FUS辐照,条件分别为4 W/200 s、4 W/150 s、4 W/250 s;之后经尾静脉注射伊文蓝(Evan blue, EB)0.2 ml/100 g体质量。
1.3 制作胶质瘤模型 将其余40只大鼠麻醉后俯卧保定于颅脑定位仪,暴露术区颅骨,于冠状缝前1 mm、矢状缝右3 mm,沿颅骨钻孔注射5 μl C6细胞悬液制成胶质瘤模型。
1.4 MR检查 采用Philips Ingenia 3.0T MR扫描仪,专用动物线圈(GC-MUC44-H300-AP,辰光医疗,上海),于造模后第9天及第17天行头部扫描,采集T2WI、对比动态增强MRI(dynamic contrast enhanced MRI, DCE-MRI)及增强T1WI。由2名具有5年头部影像学诊断经验的主治医师观察病灶MRI表现,测量病灶体积,意见不一致时经讨论决定。采用数据处理软件(Omni-Kinetics Version, V2.0.10,上海通用药业公司)分析造模后第17天MRI,于增强T1WI肿瘤最大层面及对侧放置3对约0.3 cm2ROI,测量其血流动力学参数,包括容积转运常数(Ktrans)、速率常数(Kep)、血管外细胞外间隙容积分数(Ve)及血浆内容积分数(Vp),取结果的平均值进行分析,计算相对Ktrans(rKtrans)、相对Kep(rKep)、相对Ve(rVe)及相对Vp(rVp),相对参数值=损伤侧参数值/对侧参数值。
1.5 分组及干预 造模第9天MR检查结束后随机取8只模型鼠行病理检查,以随机数字法将其余32只大鼠均分为FUS组、PD-1单抗组、FUS+PD-1单抗联合治疗组(简称“联合治疗组”)及对照组,每组8只;于造模后第9天MR检查后对前3组施加干预,隔天1次,共4次,对照组不予干预。FUS组:经尾静脉注入MB 0.2 ml/100 g体质量后行FUS辐照,输出频率650 kHz±10%,输出功率4 W,持续时间200 s。PD-1单抗组:将PD-1单抗(PD-1-IN-1, MedChemExpress公司)与生理盐水混合稀释成浓度1 mg/ml的PD-1溶液,缓慢注入腹腔1 mg/100 g体质量。联合治疗组:超声辐照条件同前,辐照结束后经腹腔缓慢注入PD-1单抗溶液1 mg/100 g体质量。
1.6 病理检查 注射EB后3~4 h予过量麻醉,以心脏灌注处死动物,取脑组织标本。对造模第9天MR检查结束后随机选取的8只动物脑组织标本行常规苏木素-伊红(HE)染色;对造模第17天4组大鼠脑组织行半胱氨酸蛋白酶(Caspase-3)及CD4、CD8免疫组织化学染色。由1名具有5年以上病理诊断经验的主治医师以盲法观察切片,随机选取8个不重叠高倍视野进行分析,以Image Pro软件计算Caspase-3活化细胞百分比、CD4+和CD8+T细胞数量。
1.7 统计学分析 采用SPSS 22.0及Graphpad prim 8统计分析软件。计量资料以±s表示,组间比较采用单因素方差分析,两两比较采用LSD法。P<0.05为差异有统计学意义。
2 结果
2.1 FUS安全性及BBB开放情况 仅FUS辐照后脑组织见少量出血;功率4 W,辐照时间分别为150、200、250 s条件下,脑组织可见EB蓝染而未见出血,见图1。
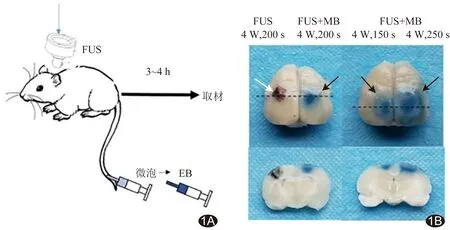
图1 测试FUS安全性及BBB开放情况 A.经尾静脉注射MB后行FUS辐照; B.EB蓝染结果(黑色虚线为切片位置,下排为上排切面图):仅以4 W/200 s条件对左侧大脑半球行FUS辐照后可见脑组织少量出血(白箭),4 W/200 s FUS辐照和MB条件下右侧大脑半球BBB开放,脑组织见EB蓝染(黑箭); 4 W/150 s(左侧大脑半球)和4 W/250 s(右侧大脑半球)FUS辐照和MB条件下BBB开放,脑组织见EB蓝染(黑箭)
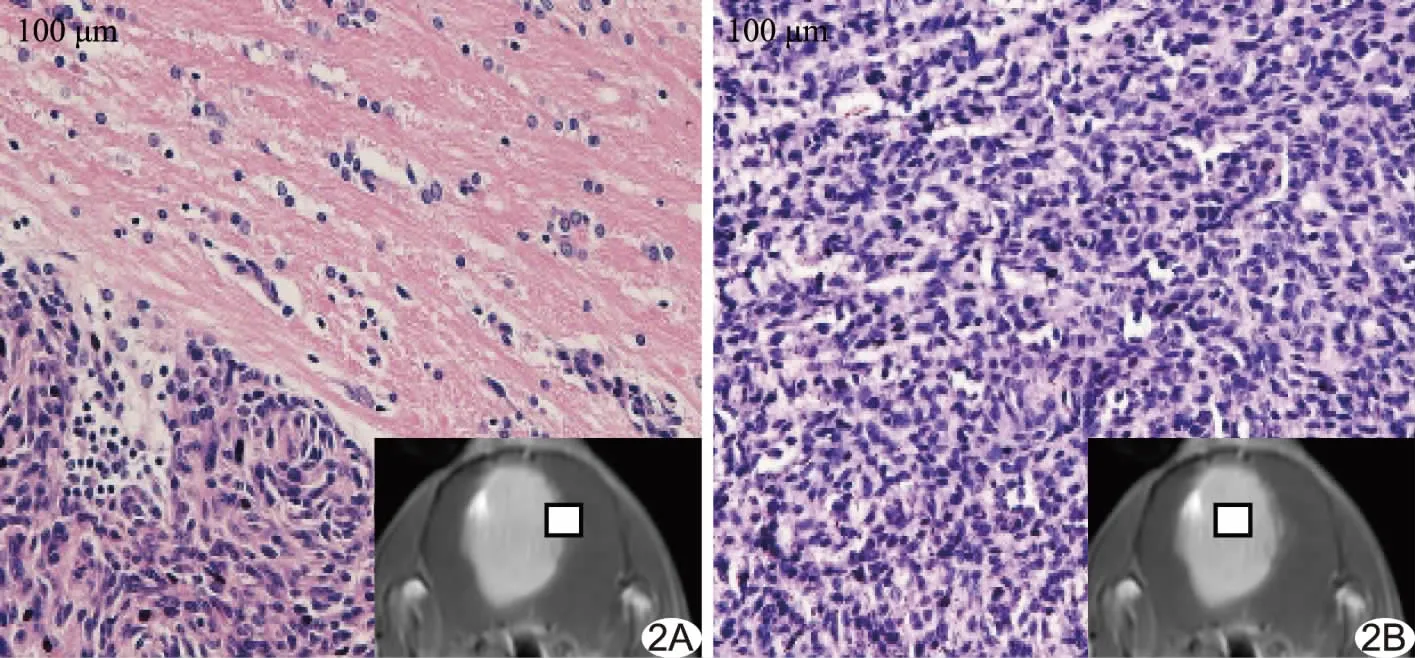
图2 造模第9天大鼠胶质瘤模型HE染色病理图(右下图示病理取材部位) A.正常脑组织(右上粉色区域)与肿瘤组织(左下蓝色深染区域)交界处; B.肿瘤组织
表1 造模后第17天组间MRI血流动力学参数比较(±s)
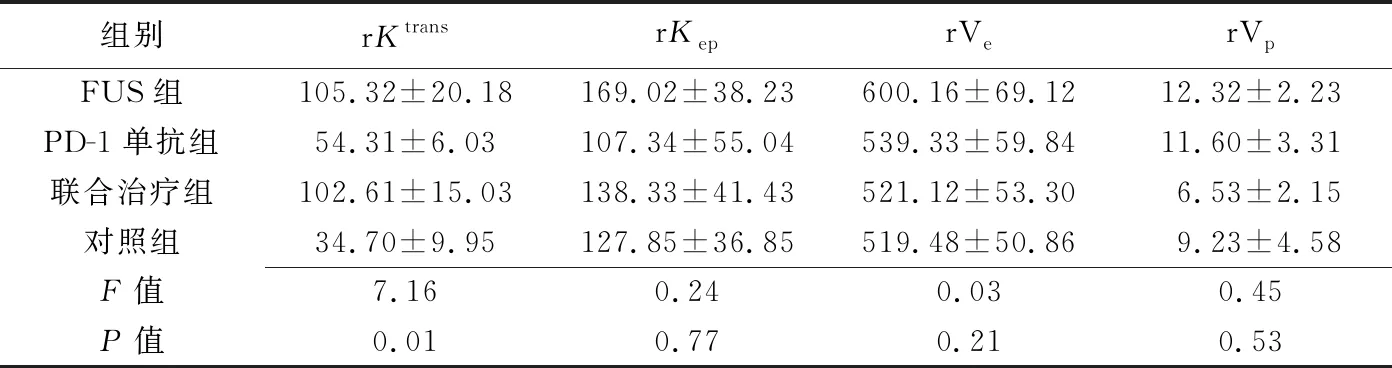
表1 造模后第17天组间MRI血流动力学参数比较(±s)
组别rKtransrKeprVerVpFUS组105.32±20.18169.02±38.23600.16±69.1212.32±2.23PD-1单抗组54.31±6.03107.34±55.04539.33±59.8411.60±3.31联合治疗组102.61±15.03138.33±41.43521.12±53.306.53±2.15对照组34.70±9.95127.85±36.85519.48±50.869.23±4.58F值7.160.240.030.45P值0.010.770.210.53
2.2 各组胶质瘤生长情况 造模第9天肿瘤呈T1WI低信号、T2WI稍高信号,增强后明显强化。HE染色片示大鼠肿瘤细胞分布密集,肿瘤细胞排列紊乱,可见较多异形细胞(图2)。造模第17天,4组肿瘤体积较第9天不同程度增大,呈T1WI低信号、T2WI混杂信号,其内可见坏死区域,瘤周见片状水肿信号,增强后病灶明显强化(图3);肿瘤体积:对照组(62.12±3.32) mm2,PD-1单抗组(54.66±3.97) mm2,FUS组(46.27±7.95) mm2,联合治疗组(20.28±3.92) mm2,差异有统计学意义(F=13.27,P<0.01);两两比较,联合治疗组肿瘤体积小于其余各组(P均<0.01),对照组与PD-1单抗组(P=0.01)及对照组与FUS组(P<0.01)间肿瘤体积差异有统计学意义,而FUS组与PD-1单抗组肿瘤体积差异无统计学意义(P>0.50)。
2.3 组间MRI血流动力学参数比较 造模后第17天,4组间rKtrans值总体差异有统计学意义(F=7.16,P=0.01),rVe、rKep、rVp差异均无统计学意义(P均>0.05),见表1。两两比较,FUS组与联合治疗组间rKtrans值差异无统计学意义(P=0.79),其余各组间差异均有统计学意义(P均<0.05)。
2.4 病理 造模第17天4组间CD8+T细胞总体差异有统计学意义(F=389.90,P<0.01);两两比较,联合治疗组CD8+T细胞较其余各组均增加(P均<0.05),余各组差异均无统计学意义(P均>0.05)。4组间CD4+T细胞总体差异有统计学意义(F=254.10,P<0.01);两两比较,联合治疗组CD4+T细胞较其余各组减少(P均<0.05),余各组间差异均无统计学意义(P均>0.05)。4组间Caspase-3活化细胞百分比总体差异有统计学意义(F=21.73,P均<0.01),两两比较,联合治疗组Caspase-3活化细胞百分比高于其余3组(P均<0.05),其余各组间差异均无统计学意义(P均>0.05),见图4、5。
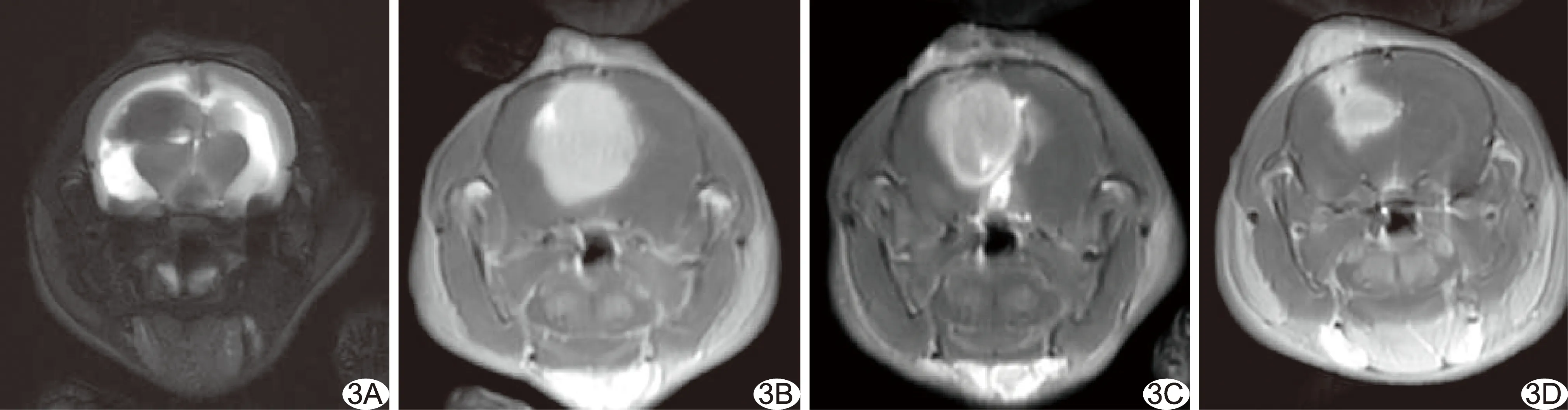
图3 造模第17天各组MRI显示大鼠胶质瘤 A.对照组T2WI; B.FUS组增强T1WI; C.PD-1单抗组增强T1WI; D.联合治疗组增强T1WI
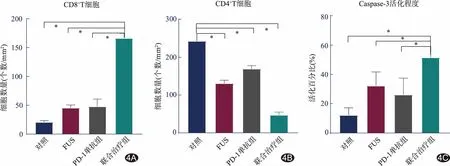
图4 造模后第17天大鼠脑组织免疫组织化学染色结果柱状图 A.CD8+ T细胞数量; B.CD4+ T细胞数量; C.Caspase-3活化细胞百分比 *为组间比较P<0.05
图5 造模后第17天大鼠脑胶质瘤病理图(Caspase-3染色,×40) A.对照组; B.FUS组; C.PD-1单抗组; D.联合治疗组
3 讨论
FUS开放BBB后,可将大分子药物如抗体、纳米颗粒和阿霉素脂质体甚至细胞因子和靶向免疫细胞制剂等向脑内递送[1-3]。FUS联合MB开放BBB可促进免疫调节剂向脑内输送,改善脑肿瘤治疗中的抗癌免疫反应[4-5]。分析其可能机制,首先,FUS产生的脉冲波与静脉注射的MB发生稳定空化作用,使大脑血管内皮机械压力增大,导致内皮间紧密连接打开,BBB开放,血管通透性增加,相对分子质量较大物质可进入大脑微环境[6]。DCE-MRI能监测BBB破坏后动力学改变[7-8],Ktrans与BBB通透性高度相关,本研究中BBB开放后脑组织EB蓝染,FUS辐照后脑肿瘤rKtrans明显增高,与既往研究[9-10]结果相符。其次,肿瘤微环境中存在转化生长因子β1、白细胞介素13、血管内皮生长因子等免疫抑制细胞因子,FUS诱导BBB开放可增强上述细胞因子的作用,通过非特异性免疫增强作用而减少特异性封闭分子/抗体向全身递送,从而克服由肿瘤引起的免疫抑制作用[11]。CHEN等[11]以C6胶质瘤大鼠模型评估FUS诱导BBB开放的效能,发现FUS-BBB开放致白细胞介素12显著增加,T细胞增殖活跃,促进干扰素γ产生,增强抗肿瘤细胞毒性免疫作用及相关抗癌免疫反应[12]。另外,人类主要组织相容性复合体(major histocompatibility complex, MHC)在肿瘤细胞往往表达较弱,呈递抗原效率较差,免疫过程中不易监视和调控。FUS诱导BBB开放可增强肿瘤组织MHC表达,提高树突状细胞抗原呈递效率。最后,PD-1为免疫抑制性受体,在活化T细胞、B细胞中广泛表达,FUS可激活配体抗原呈递细胞的渗透能力,增强免疫反应。FUS有助于改变肿瘤原有微环境,引发肿瘤细胞坏死或凋亡;而BBB开放有利于向大脑输送免疫调节剂,促进抗癌免疫反应。本研究结果显示,相比FUS组或PD-1单抗组,联合治疗组肿瘤生长明显受抑制,体积缩小,提示应用FUS和MB开放BBB后以PD-1药物治疗胶质瘤效果更佳。
SATO等[13]发现上皮内CD8+T细胞高及CD8+/CD4+比值较高的上皮性卵巢癌患者预后较好,生存率较高,提示上皮内CD8+T细胞与上皮性卵巢癌预后相关,CD4+T细胞会影响CD8+T细胞的有益作用。张勇等[14]报道,CD4+/CD8+比值异常的鼻咽癌患者5年总生存率(67.95%)显著低于CD4+/CD8+比值正常者(89.80%),提示CD4+/CD8+比值低者预后较差。本研究以Caspase-3活化程度反映细胞凋亡程度,以CD4、CD8阳性表达细胞数量反映肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte, TIL)浸润程度,发现联合治疗组CD8+T细胞数量及Caspase-3活化细胞百分比均高于其余3组、CD4+T细胞数量低于其余3组,提示其抑制肿瘤生长效果较佳。FUS诱导BBB开放对机体全身T淋巴细胞种群无明显影响,但触发了TIL群体变化[11]。在微环境中,CD4+调节性T细胞和CD8+T细胞是胶质瘤TIL的重要组成部分。CD4+和CD8+T细胞均需激活才能破坏肿瘤细胞的有效免疫反应,CD4+T细胞参与调节CD8+T细胞免疫反应过程,且可能受免疫原性质、抗原提呈细胞激活状态及效应和记忆CD8+T细胞所处微环境等影响[15]。CD8+T细胞浸润有益于预后,CD4+T细胞有助于维持CD8+T细胞功能,但影响CD8+T细胞的有益作用,从而影响预后。肿瘤微环境复杂,CD4+和CD8+T细胞对胶质瘤的发展及预后存在一定影响,深入了解微环境免疫细胞作用机制对评价疾病预后极其重要。
综上,FUS与抗PD-1单抗协同治疗有利于延缓大鼠脑胶质瘤进展。
