磁共振波谱分析海马诊断首发抑郁症
2021-03-30刘海燕黄清玲李宗鸿肖朝勇
王 晓,胡 晓,刘海燕,黄清玲,柴 学,李宗鸿,胡 君,肖朝勇*
(1.南京医科大学附属脑科医院医学影像科,2.精神科,江苏 南京 210029)

图1 DD患者,女,37岁,海马区MRS图 A.轴位定位图; B.MRS结果
抑郁症(depressive disorder, DD)为慢性反复发作性情感性精神障碍,主要表现为显著而持久的心境低落,常伴焦虑、睡眠障碍等症状。目前主要依靠临床症状对DD进行诊断、复诊和观察疗效,缺乏客观依据[1]。近年来神经影像学新技术的发展及临床应用为探讨DD患者脑细微结构及生化改变提供了技术条件。磁共振波谱(magnetic resonance spectroscopy, MRS)主要利用MR现象和化学位移作用来测定一系列特定原子核及其化合物的MR信号频率,从而直接检测脑细胞代谢和生物能量变化,是无创检测活体器官组织代谢产物浓度、反映其生理及病理变化特点的定量分析方法[2]。本研究采用1H-MRS检测双侧海马代谢物,应用受试者工作特征(receiver operating characteristic, ROC)曲线评价双侧海马代谢物对DD的诊断价值,以期为临床诊断提供帮助。
1 资料与方法
1.1 一般资料 收集2011年1月—2014年12月南京医科大学附属脑科医院抑郁专病门诊首次发病未经治疗的44例DD患者(DD组),均符合中国精神障碍分类及诊断标准-3(Chinese classification and diagnostic criteria of mental disorders-3, CCMD-3)抑郁发作和精神障碍诊断与统计手册-Ⅳ(diagnostic and statistical manual of mental disorders-Ⅳ, DSM-Ⅳ)抑郁诊断标准,右利手。排除有神经系统和其他精神障碍性疾病、严重躯体疾病、药物和/或酒精依赖及MR检查禁忌者。选取年龄、性别、教育程度与DD组相匹配的20名健康人(对照组),右利手,排除有精神疾病史或一级亲属中有严重精神疾病史者。检查前全部受试者或其监护人均签署知情同意书。
DD组44例,男23例,女21例,年龄19~45岁,平均(31.6±9.1)岁,平均受教育年限(15.95±4.30)年,汉密尔顿抑郁量表(Hamilton depression scale, HAMD)平均评分(24.77±5.83)分。对照组20名,男11名,女9名,年龄21~50岁,平均(37.0±9.2)岁,平均受教育年限(15.00±2.83)年,HAMD平均评分(2.50±0.71)分。2组受试者年龄、性别、教育程度均匹配(P均>0.05)。
1.2 仪器与方法 检查前嘱受试者静坐30 min,并向其说明检查过程,以使之在检查过程中情绪平稳、高度配合。采用Siemens Verio 3.0 T超导型MR仪,采集三维梯度回波序列图像,用于定位解剖结构及排除严重器质性病变,TR 2 530 ms,TE 3.34 ms,FOV 256 mm×256 mm,矩阵256×192,层厚1.33 mm,共128层,扫描时间8 min 7s。1H-MRS:采用多体素3D-化学位移成像(chemical shift imaging, CSI)序列,以矢状位3D T1WI重建轴位(平行于海马长轴)、冠状位图像作为定位图像,以海马区为ROI,FOV 160 mm×160 mm,感兴趣容积(volume of interest, VOI)100 mm×60 mm,体素10 mm×10 mm×15 mm,TR 1 700 ms,TE 135 ms,层厚15 mm,FA 90°,带宽1 200 Hz,体素内匀场、水抑制均由扫描程序自动完成。结束扫描后使用随机LEONARDO程序进行基线和相位校正。测量N-乙酰天门冬氨酸(N-acetyl aspartate, NAA)、胆碱(choline, Cho)、肌酸(creatine, Cr)及肌醇(myoinositol, MI)波峰下面积,并计算NAA/Cr、Cho/Cr及MI/Cr(图1)。
1.3 统计学分析 采用SPSS 20.0统计分析软件。以±s表示符合正态分布的计量资料,行独立样本t检验;针对P<0.1的指标行ROC曲线分析,以最大化约登指数作为诊断阈值,计算ROC曲线下面积(area under the curve, AUC)、敏感度和特异度。对差异有统计学意义的指标行多元Logistic回归分析,建立预测模型,并对预测模型进行ROC曲线分析。采用Bootstrap采样法进行交叉验证。P<0.05为差异有统计学意义。

图2 右侧海马代谢指标及预测模型ROC曲线 A.代谢指标; B.预测模型
2 结果
DD组右侧海马Cho(Cho-R)、Cho/Cr(Cho/Cr-R)、NAA/Cr(NAA/Cr-R)值均较对照组下降(P均<0.05),其余指标组间差异均无统计学意义(P均>0.05)。见表1。P<0.1的指标包括NAA-R、Cho、Cho/Cr、NAA/Cr,以之模型构建,并以AIC(Akaike information criterion)作为参考标准。最终剔除了Cho-R,保留NAA-R、NAA/Cr-R、Cho/Cr-R特征,经Logistic回归分析得到预测模型的回归方程:Logit(P)=-9.84+0.56×(NAA-R)-4.18×(NAA/Cr-R)+6.65×(Cho/Cr-R),其中P为预测模型对DD的预测概率;ROC曲线分析结果显示AUC为0.83,最佳诊断阈值为-0.66,敏感度及阴性预测值均较NAA-R、Cho-R、Cho/Cr-R及NAA/Cr-R有所提高。见表2、图2。
对海马NAA-R、Cho-R、Cho/Cr-R及NAA/Cr-R行交叉验证分析,结果显示各指标鉴别DD效能良好。
3 讨论
DD是情感性精神障碍的主要类型,目前普遍认为DD患者脑组织器质性改变主要位于边缘系统-皮层-纹状体-苍白球-丘脑(limbic-cortical-striatal-pallidal-thalamic, LCSPT)神经环路[3-4]。边缘系统中,海马发出的神经纤维可投射到额叶皮质、杏仁核等与情感有关脑区,是人类学习、记忆及情感等高级功能关键脑区,既往DD研究[5-7]涉及较多,本研究也主要针对海马代谢变化进行探讨。
NAA主要存在于神经元内,是神经元密度及活力的标志物,NAA降低反映神经元及髓鞘减少和脱失及功能异常。既往研究[8-9]显示,DD患者存在海马区NAA降低,意味着该处神经元缺失和功能受损。动物模型研究[10]发现DD海马神经元再生减少、凋亡增多,用射线等特定照射或转基因方法消除大鼠海马神经元再生能力,可干扰抗抑郁药物治疗效果,提示海马区神经元减少或增多可能是DD发生和恢复的关键因素。本研究发现DD组右侧海马区NAA较对照组降低,但差异无统计学意义,而右侧海马区NAA/Cr显著低于对照组。本组DD患者均为右利手,NAA变化主要集中在右侧,而非优势半球包括海马更多参与非语言功能的高级智能活动,可与XI等[10]的结果相互印证。DD患者单侧海马NAA降低[11-13]、双侧降低[14]或无变化[15]可能与病程及疾病严重程度相关。Cho反映总胆碱含量,胆碱是乙酰胆碱和磷脂酰胆碱的前体,前者为重要的神经递质,影响记忆、认知和精神状态,后者参与细胞膜构成,与细胞膜磷脂代谢和髄鞘形成有关,且在神经修复过程中参与胶质细胞增生以及维持神经元的完整性。本组海马区Cho-R及Cho/Cr-R显著降低。既往研究认为DD可伴随海马区Cho改变,表现为Cho升高[16-17]、无变化[18-19]及降低[20]。动物实验[21]研究结果显示发现抑郁4周后方见Cho升高,而早期可出现Cho下降。MILNE等[22]认为首发DD患者Cho水平可无变化,而反复发作DD患者Cho水平升高,提示Cho改变可能与病程相关。本研究Cho及Cho/Cr下降可能提示DD处于早期阶段。DD早期神经细胞出现凋亡,而胶质细胞未开始增生,故Cho未见升高、甚至可能下降,与DD早期神经细胞膜功能紊乱及细胞内信号传导系统受损相关[13]。

表1 2组1H-MRS各代谢指标比较
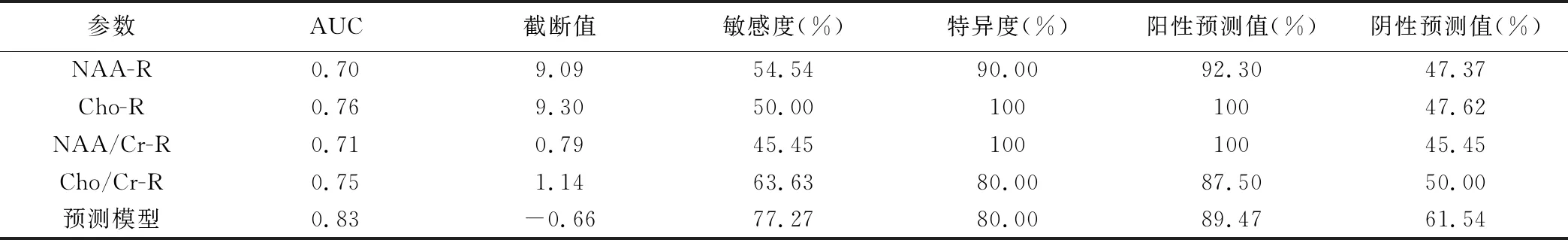
表2 右侧海马1H-MRS相关代谢指标诊断分析
本研究Cho-R、NAA/Cr-R、Cho/Cr-R及预测模型的AUC均大于0.7,提示其用于诊断DD具有一定准确性;而Cho-R及NAA/Cr-R的诊断特异度达100%,具有良好的阳性预测价值,而预测模型的敏感度较单指标诊断有所提高,且总体准确率明显提高。对NAA-R、Cho-R、NAA/Cr-R、Cho/Cr-R进一步交叉验证试验,测试组敏感度、特异度及准确率均较高,提示联合诊断有助于诊断及鉴别首发DD。本研究确定了最佳诊断截断值,为诊断DD提供量化参考,也为将MRS用于临床诊断DD提供了依据。但本研究样本数少,可能导致结果偏倚,有待累积病例数进一步深入观察。
综上所述,MRS能显示首发DD患者海马区代谢改变,可辅助诊断首发DD;海马区Cho及Cho/Cr下降可能是早期DD的标志。Cho-R、NAA/Cr-R、Cho/Cr-R对诊断及鉴别DD具有重要价值,可作为诊断首发DD的指标。
