以回交重组自交系定位水稻萌芽期耐镉胁迫相关QTLs
2021-03-30黄诗颖谭景艾王鹏蒋宁飞贺浩华边建民
黄诗颖, 谭景艾, 王鹏, 蒋宁飞, 贺浩华,, 边建民,*
1.江西农业大学, 作物生理生态与遗传育种教育部重点实验室; 江西省水稻高水平工程研究中心, 南昌 330045;2.浙江省建德市种子管理站, 浙江 建德 311600
目前,土壤重金属含量超标已成为威胁作物生长发育及影响作物产量和质量的重要因素之一。镉(Cd)是一种致使土质下降且生物毒性极强的重金属[1],水稻作为最主要的粮食作物之一,对Cd胁迫的耐受性较低。有关水稻在Cd胁迫下生长发育所受影响的研究,大多集中在Cd积累对于植株地上部分的影响,如影响光合效应[2]、抑制蒸腾作用[3]、干扰植物的代谢进程[3]、加速植株的衰老等[4],即大多研究集中在生殖生长阶段Cd胁迫对水稻植株的影响,但关于萌芽时期水稻对Cd胁迫耐受性的研究报道不多[5]。稻种萌芽后,根系与土壤接触,是植物从土壤中吸收养分的重要介质[6],而幼芽生长成为植株的地上部分,Cd的存在可抑制幼苗酶类活性,生理作用受到抑制,导致幼叶与根系细胞组分的严重缺失,影响生长[7]。稻种萌芽期对环境胁迫极其敏感,是水稻营养生长阶段的基础,因此,研究水稻萌芽期的耐Cd能力,对于挖掘水稻耐Cd作用机理与遗传特点具有重要意义[8]。
Cd胁迫下水稻植株表现的性状多为数量性状[9],定位耐Cd胁迫相关数量性状基因座(quantitative trait loci,QTLs) 对于进行水稻Cd胁迫分子标记辅助育种具有重要意义。目前,水稻Cd积累QTLs定位研究多集中在苗期和成熟期,如利用回交重组自交系群体(recombinant inbred lines,RIL)及关联分析等方法定位了水稻种子萌发和幼苗生长的Cd积累相关QTLs[10-14];林辉锋等[15]以Lemont和Dular杂交建立重组自交系群体,利用水培液共检测到9个苗期耐Cd QTLs,其中位于1号染色体上的qRAP-1a与根长相关,可以解释9%的表型变异。此外,研究人员以不同遗传群体及检测方法定位到一系列Cd积累相关的QTLs,并进行克隆,如利用镉高积累品种Anjana Dhan和日本晴构建定位群体,克隆得到水稻低镉积累基因OsHMA3[16];利用台中1号和春江06 2种差异明显的品种构建杂交群体,克隆到1个调控水稻叶片Cd积累基因CAL1[17]。根据前人研究可知,水稻苗期Cd积累会影响植株叶绿素含量、叶长、根长、株高及干重等性状[18],但定位的镉胁迫下控制水稻萌芽期根长、芽长的QTLs不多,水稻萌芽期种子的萌发状况决定了植株后期的生长情况,最终影响产量,因此,研究水稻萌芽期种子Cd遗传情况,定位萌芽期耐Cd胁迫的QTLs,对指导水稻耐Cd育种有重要作用[19]。
昌恢891是江西省主要的籼稻种质资源[20],02428是广亲和的粳稻品种[21],二者Cd胁迫耐受能力存在差异,基于此,本研究利用水稻02428和昌恢891衍生的124个回交重组自交系(backcross recombinant inbred lines,BIL)群体[22],研究镉胁迫水稻萌芽期根长、芽长的生长情况,并对稻种萌芽期耐Cd胁迫的QTLs进行定位,目的是初步解析水稻萌芽期Cd胁迫后根长、芽长遗传机理,定位其中影响水稻萌芽期耐Cd胁迫的QTLs,以期为进行耐Cd水稻新品种的选育提供理论参考和基因资源。
1 材料与方法
1.1 实验材料
1.1.1植物材料 植物材料由江西农业大学作物生理生态与遗传育种重点实验室提供。以粳稻品种02428为背景的BILs群体是利用02428与昌恢891杂交,通过与02428回交、自交,建立回交重组自交系群体。该群体包含124个家系[22]。
1.1.2实验试剂及仪器 恒温培养箱(日本PHCbi公司);移液枪(德国Eppendorf公司);NaClO溶液(天津大茂化学试剂厂)。
1.2 遗传图谱的构建
利用全基因组重测序技术对124个BILs家系进行基因分型。操作步骤为:提取亲本与BILs群体的基因组DNA;利用物理法断裂DNA并构建300 bp的文库;通过华大基因MGISEQ-2000设备对文库测序。基于测序结果进行单核苷酸多态性(single nucleotide polymorphism,SNP)标记的筛选并进行分类,然后将连续多个SNP标记且具有相同的基因型概括为一个Bin标记[22],利用这些Bin标记结合JoinMap 4.2软件构建BILs群体的高密度图谱。
1.3 形态指标考察
参考水稻生理实验手册[23],随机挑选健康饱满的种子100粒,以1.5% NaClO溶液消毒30 min,而后以去离子水冲洗3次,再用蒸馏水浸泡24 h后,选择露白的种子50粒于培养皿中进行胁迫处理。加17 mg·L-1的CdCl2溶液进行镉胁迫处理(Cd),以不加CdCl2溶液的处理作为对照组(CK)。培养7 d,其中,光照时间为14 h·d-1,黑暗时间为10 h·d-1,光照期间温度为28 ℃,黑暗期间温度为25 ℃,光照强度为360 μmol·m-2·s-1。测量芽长、根长2项形态指标[24]。试验重复3次,取平均值用于QTL定位。
1.4 QTL定位
利用 QTL IciMapping V4.2软件,采用复合区间作图法,对 BIL 群体在全基因组范围内检测控制芽长、根长QTLs。将LOD值2.5定为阈值,若标记区间的LOD>2. 5,则认为该区间LOD值最高处所对应的位点为该性状的1个QTL[25-26]。
1.5 数据分析
所有原始数据利用Microsoft Excel 2010进行分析;根长、芽长的数据利用t检验进行显著性分析。
2 结果与分析
2.1 遗传图谱的构建
利用全基因组重测序技术对124个BILs家系进行基因分型。与日本晴参考基因组相比,亲本02428和昌恢891的SNP数分别为22 358和85 605。最终,在2个亲本中共检测到70 480个高质量SNP,进而对来自124个BIL群体的群基因组重新测序并利用产生的3 057个重组位点制作了连锁图谱。该图谱的总遗传距离为1 266.5 cM,12个水稻连锁群的标记数和标记密度各不相同(图1)。其中,8号染色体标记密度最高(0.24 cM·标记-1)。10号染色体标记密度最低(0.54 cM·标记-1)[22]。
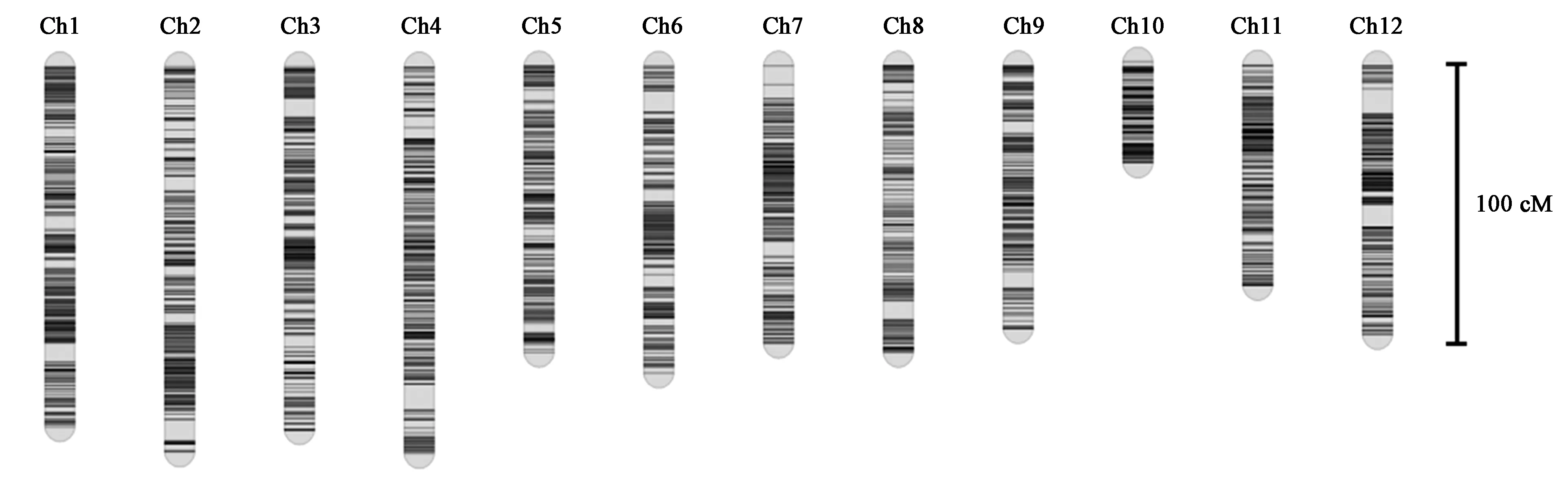
图1 BIL群体标记密度分布图Fig.1 The high density map of the BIL population
2.2 水稻BIL群体耐镉胁迫分析
为分析BIL群体Cd耐受力,将水稻萌发种子于溶液培养7 d,表1和图2为BIL群体芽长、根长在Cd胁迫与水溶液处理下表型数据及分布。将对照组与Cd溶液处理组比较可知,02428相对芽长减少了30.65%,相对根长减少了81.48%;昌恢891相对芽长减少了20.46%,相对根长减少了82.49%。水溶液条件下,BIL群体芽长、根长变幅分别为0.28 cm和3.31 cm,标准差分别为0.53和1.82;Cd溶液条件下,BIL群体芽长、根长变幅分别为0.15 cm和0.40 cm,标准差分别为0.38和0.63。根长和芽长在Cd胁迫与水溶液处理下均表现为正态分布,可以用于QTL定位分析。
2.3 差异分析
为分析根长、芽长受Cd胁迫的影响,图3为第7天所测根长、芽长的数据结果。Cd胁迫与对照组下的根长、芽长差异显著(P<0.01),这说明在Cd胁迫下稻种的萌发生育受到显著抑制;同时,比较根长、芽长的Cd胁迫与对照组的差值可知,根长的差值较大,这说明在稻种萌芽期,Cd胁迫对于根长的抑制较芽长更明显。

表1 镉胁迫及水溶液处理下根长、芽长表现Table 1 Root and bud length performance under cadmium stress and aqueous solution
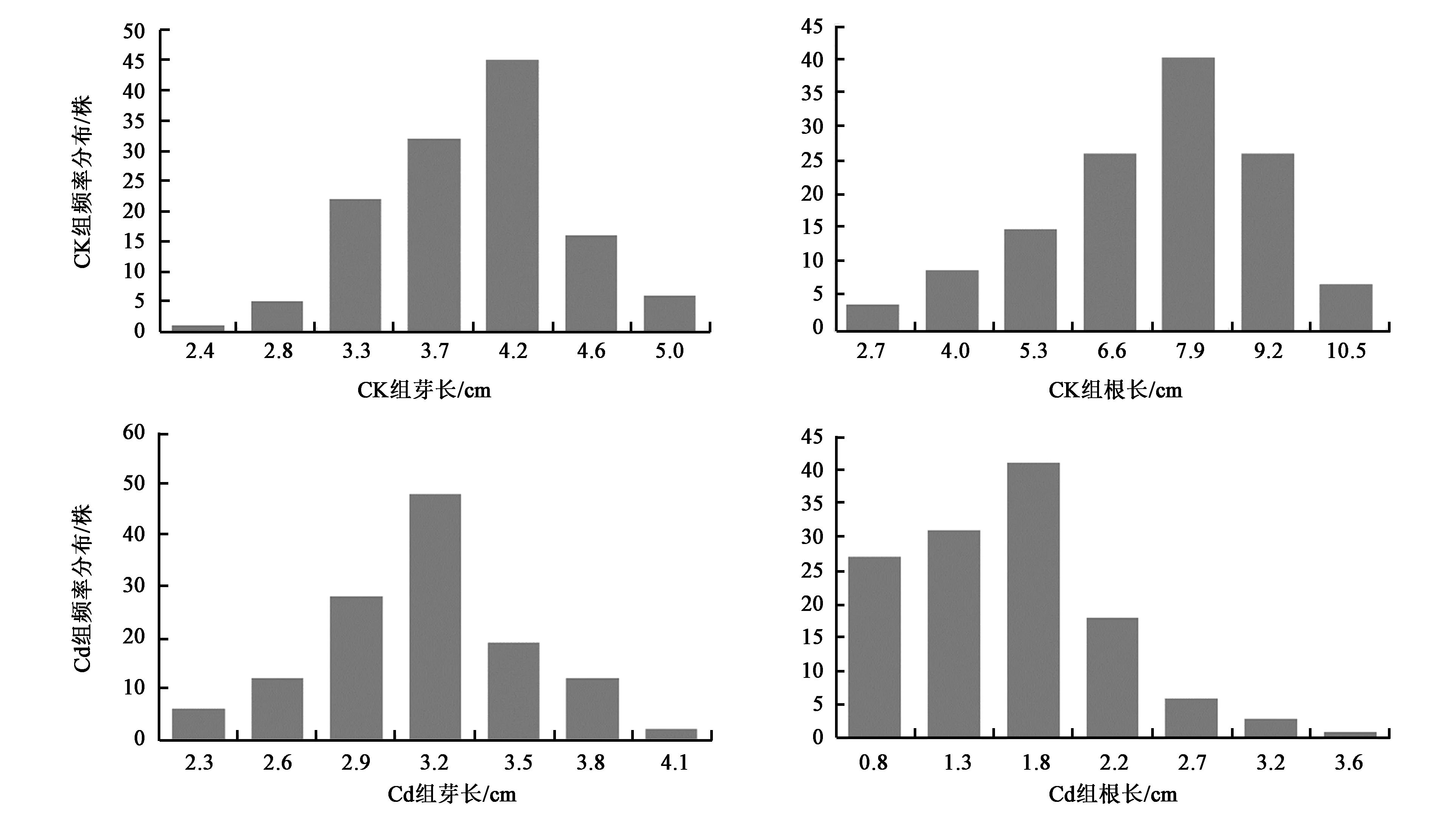
图2 BIL群体根长芽长频率分布图Fig.2 BIL population root growth and shoot length frequency distribution diagram

注:**表示根长、芽长的Cd胁迫与对照组的差异极显著(P<0.01)。图3 处理第7天根长、芽长差异分析Fig.3 Correlation analysis of root length and shoot length on the seventh day of treatment
2.4 QTL定位
利用IciMapping V4.2软件,结合已经构建的连锁图谱,对在镉胁迫与水溶液处理下控制根长、芽长的QTLs进行分析,共检测到7个QTLs(表2),分别分布于第3、4、7、8、9染色体上,LOD值为2.70~5.21,贡献率为6.45%~19.46%。
2.4.1根长QTL定位 镉胁迫条件下,共检测到1个控制根长的QTL,位于第7条染色体上,命名为qCdRL7,LOD值为5.21,贡献率为19.46%,来自02428的等位基因,能增加水稻根长;水溶液条件下,检测到1个控制根长的QTL,位于第4条染色体上,命名为qCKRL4,LOD值是2.85,加性效应为0.83,贡献率是10.89%,来自昌恢891的等位基因,能增加水稻根长(表2)。
2.4.2芽长QTL定位 镉胁迫条件下,共检测到4个控制芽长的QTLs,分别位于第3、8、8和9染色体上,命名为qCdBL3、qCdBL8.1、qCdBL8.2和qCdBL9,LOD值分别为4.48、2.96、2.85和3.77,贡献率分别为10.87%、6.90%、6.45%和8.76%。其中,qCdBL3、qCdBL8.1和qCdBL8.2增效等位基因来自02428,qCdBL9增效等位基因来自昌恢891。水溶液对照处理下,共检测到1个控制芽长的QTL,命名为qCKBL8,位于第8条染色体,LOD值是2.70,贡献率是10.53%,增效等位基因来自02428。

表2 镉胁迫及水溶液处理下控制根长、芽长响应QTLTable 2 Response QTLs of root length and shoot length under cadmium stress and aqueous solution treatment
3 讨论
前人研究表明,不同水稻品种耐Cd能力因基因型不同而存在差异[27]。研究显示,在Cd胁迫下,粳稻02428芽长与根长均表现出更明显的变幅,即萌发期Cd胁迫对粳稻02428抑制作用要明显大于对籼稻昌恢891的抑制,表明萌发期籼稻、粳稻Cd耐受能力存在差异,证实水稻种子萌发期对Cd胁迫较为敏感[28]。本研究表明,Cd胁迫对籼稻昌恢891和粳稻02428萌发期芽长和根长均有显著的抑制作用(P<0.01),其中Cd对根长的抑制强于芽长,说明萌芽时期水稻不同部位受Cd抑制程度不同。
李炜星等[29]以籼稻品种昌恢121为轮回亲本、粳稻品种越光为供体亲本构建的CSSL群体,以根长、苗长等6个性状指数为耐Cd指标,检测到7个相关QTLs,其利用根长作为抗性指标所定位到的位于第7号染色体RM1306处的qTRFW7与本研究定位到的qCdRL7位置接近,说明第7条染色体上存在控制水稻萌芽期根长发育的QTL位点;Xue等[30]以籼稻ZYQ8和粳稻JX17为亲本构建的DH群体,共定位到22个与幼苗期Cd耐性和积累相关的QTLs,其中以幼苗长度作为抗性指标定位的qSH8与本研究所定位到的镉胁迫芽长相关QTLqCdBL8.2接近,表明第8号染色体153~154区段可能在着控制水稻全生育植株高度基因(QTL)。本研究检测到位于第3号和9号染色体上控制芽长的qCdBL3和qCdBL9,在之前的研究中未被检测到,可能是与幼苗期镉胁迫相关的新QTLs。
本研究以Cd胁迫下根长、芽长指数作为指标,共检测到5个Cd胁迫相关QTLs,根长、芽长未检测到相同QTLs,说明镉胁迫下控制水稻根长、芽长的遗传机制可能存在差异,表明水稻耐镉胁迫遗传机制的复杂性,且于不同环境及不同群体所检测到的基因位点存在较大差异。镉胁迫和非镉胁迫条件下定位的QTLs不同,表明Cd胁迫与正常环境下控制根长或芽长基因不同,这与李炜星等[29]和黄凤林[31]的研究结果类似。此外,所检测Cd胁迫相关QTLs的贡献率为6.45%~19.46%,其中qCdRL7贡献率最大,表明耐Cd胁迫虽然是数量性状基因控制,但存在主效QTL。因此,在今后Cd胁迫分子育种中,选择耐Cd主效QTL的同时应聚合更多耐Cd胁迫的QTLs,提高育种效率。本研究检测的5个萌芽期耐Cd胁迫QTLs中,qCdBL3、qCdBL8.1和qCdBL8.2增效等位基因均来自于广亲和粳稻02428,因此在今后的育种中可以利用02428为中间材料,可通过连锁分子标记,将这些水稻萌芽期耐Cd的QTLs导入其他水稻品种中,来提高水稻耐镉能力;同理,增效等位基因均来自于籼稻昌恢891的qCdBL9,可通过连锁分子标记,将其导入其他籼稻品种中,以此来提高籼稻的耐镉能力。
