基于生物信息学方法对抑郁症小鼠脑组织差异基因表达的分析
2021-03-30陈盛王高华
陈盛,王高华
抑郁症是一种情感性精神障碍综合征,随着社会经济的发展、生活节奏的加快,抑郁症患者数量逐年增加,研究表明,全球范围内抑郁症发病率约17%,抑郁症已经成为人类心理疾病的头号杀手[1]。目前,临床上对于抑郁症患者主要以药物治疗为主[2],选择性5-羟色胺再摄取抑制剂(selective serotonin reuptake inhibitor,SSRI)最常用,SSRI 通过抑制突触前神经元对5-羟色胺的再摄取,提高突触间隙5-羟色胺浓度,从而提高神经元兴奋性,发挥抗抑郁作用,然而长期使用患者可出现耐药性,药效降低[3]。随着基因组学、分子生物学、影像学、病理学等多学科的发展,基于疾病发病机理开发的各种靶向药物广泛应用于临床,特别是恶性肿瘤人群,而当前对于药物治疗无效的抑郁症患者,尚缺乏有效的个性化和靶向治疗手段。
生物信息学是将信息技术应用于分子生物学的一门新兴的交叉学科,随着当前各种高通量测序技术的发展,越来越多的学者将测序手段应用于科研中,通过对疾病模型或者生物学过程进行广泛筛选,并利用生物信息学技术挑选出目的基因,然后通过各种细胞实验、分子实验及动物实验验证其功能,由此筛选出调控某些疾病发生或生物学过程的关键基因和信号通路,为疾病的早期诊断和药物开发提供研究基础[4,5]。本研究基于公共数据库,利用生物信息学这一新兴研究手段,筛选与抑郁症的发生相关的生物学过程和核心基因,以期为探索抑郁症的发病机理和靶向药物开发提供依据。
1 材料与方法
1.1 材料
在美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)网站中的基因表达综合库中,以“Major Depressive Disorder”为关键词,设置小鼠组织和基因表达矩阵为过滤条件,获得GSE151807数据集。该数据集基于高通量测序检测慢性温和应激模型诱导的抑郁症小鼠和对照组小鼠海马和杏仁核组织中基因表达水平。
1.2 方法
1.2.1 差异基因的筛选 本研究基于抑郁症组和对照组小鼠海马和杏仁核组织中基因表达值倍数变化(Fold change,FC)和P值,使用R软件并借助Bioconductor中的Limma 功能包对差异基因(differentially expressed genes,DEGs)进行筛选,设置筛选条件为:|log2FC| >0.5且P-Val <0.05。
1.2.2 GSEA 分析 使用GSEA3.0 软件对数据集GSE151807 的基因表达矩阵进行基因集富集分析(Gene Set Enrichment Analysis,GSEA),根据NominalP-Value 和标准化富集得分(Normalized Enrichment Score,NES)对富集的信号通路进行过滤,设置过滤条件为:NominalP-Value <0.05且|NES|>1。
1.2.3 基因本体论富集分析 利用David(The Database for Annotation, Visualization and Integrated Discovery)在线分析工具对抑郁症小鼠海马和杏仁核组织中的差异基因进行基因本体论(Gene Ontology,GO)富集分析,使用R软件及ggplot2功能包进行数据可视化。该分析从生物学过程(Biological Process,BP)、细胞组成(Cellular Component,CC)和 分 子 功 能(Molecular Function,MF)三个方面分析差异基因可能涉及的功能,设置筛选条件为:P-Val <0.05。
1.2.4 KEGG 信号通路富集分析 利用David在线分析工具对抑郁症小鼠海马和杏仁核组织中的差异基因进行KEGG(Kyoto Encyclopedia of Genes and Genomes)信号通路富集分析,数据可视化借助R 软件进行,当P值小于0.05时认为此信号通路显著富集。
1.2.5 差异基因表达蛋白相互作用网络分析及关键基因筛选 使用String 在线网站(网址:http://stringdb.org/)构建抑郁症小鼠海马和杏仁核组织中的差异基因表达蛋白间相互作用网络(Protein-Protein Interaction,PPI),将蛋白间相互作用数据导入Cytoscape3.7.2 软件,利用MCODE 插件工具进行模块聚类分析及数据可视化,利用Cytohubba 插件工具,基于不同的算法挑选前10 位关键基因(Hub gene),不同算法之间进行Venn分析,筛选出核心基因。
2 结果
2.1 差异基因的筛选
选取GEO数据库中数据集GSE151807,共含有12个小鼠海马和杏仁核组织样本,其中对照组小鼠6个,抑郁症组小鼠6个。结果表明,与对照组小鼠相比,抑郁症小鼠海马和杏仁核组织中共有351个基因表达水平发生改变,其中182个基因上调,169个基因下调,见图1。
2.2 数据集GSE151807基因富集分析
对数据集GSE151807基因表达矩阵进行GSEA分析发现,抑郁症小鼠海马和杏仁核组织中神经活性配体-受体相互作用、泛素介导的蛋白水解、亨廷顿氏病、谷胱甘肽代谢、过氧化物酶、长期抑郁等有关的基因显著富集,见图2。
2.3 差异基因GO富集分析
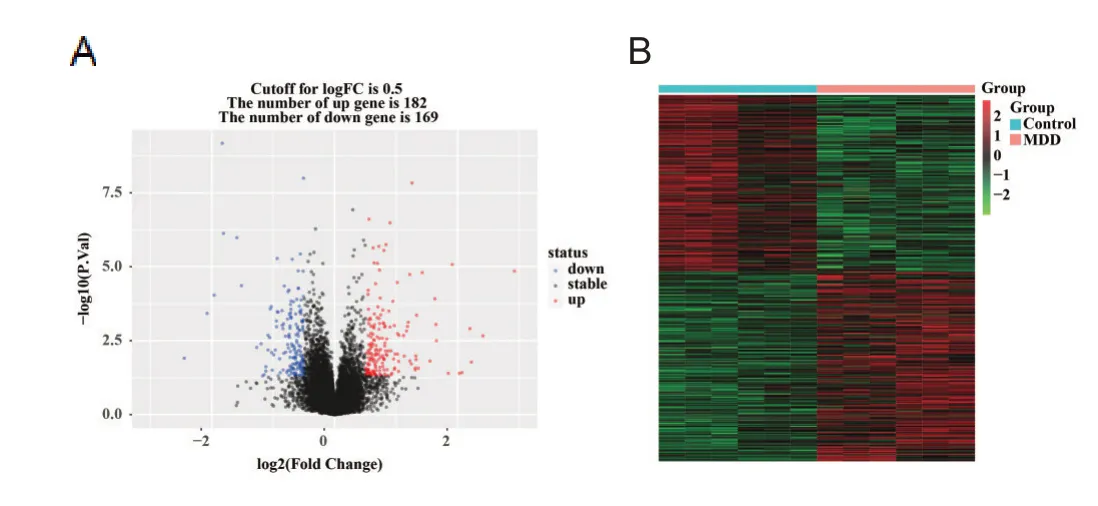
图1 数据集GSE151807差异基因的筛选

图2 数据集GSE151807基因富集分析
利用David在线分析工具进行GO富集分析发现,差异基因富集在RNA 聚合酶Ⅱ启动子转录的调控(GO:0006357)、单-多细胞生物过程(GO:0044707)、系统发育(GO:0048731)等生物学过程,见图3A;主要分布在细胞内膜结合细胞器(GO:0043231)、细胞内细胞器(GO:0043229)等细胞组分,见图3B;具有转录因子活性调控(GO:0000982)、转录调控区DNA 结合调控(GO:0044212)等分子功能,见图3C、表1。
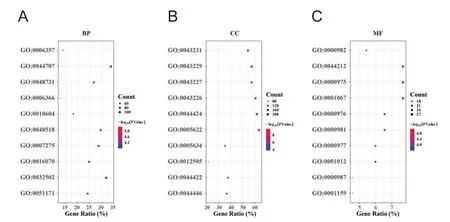
图3 差异基因GO富集分析
2.4 差异基因KEGG信号通路富集分析
KEGG 信号通路富集分析发现,差异基因富集在烟酸酯和烟酰胺代谢(mmu:00760)、孕激素介导的卵母细胞成熟(mmu:04914)、ECM-受体相互作用(mmu:04512)等信号通路中,见图4。
2.5 差异基因表达蛋白互作网络分析及核心基因筛选
通过String在线分析工具,构建了317个差异基因表达蛋白相互作用的蛋白-蛋白网络,见图5A;使用Cytoscape软件中MCODE 插件工具进行聚类,共含有9 个模块,前3 个模块系数较高,见图5B~D,与适应性免疫过程有关。使用Cytoscape软件中Cytohubba功能包进行核心基因的筛选,基于6种不同的算法,得到前10位核心基因,见表2;其中,Fos和Itpkb基因在此6种算法中均居于前10位,见图5E;Fos基因在抑郁症小鼠海马和杏仁核组织中为下调基因,Itpkb基因在抑郁症小鼠海马和杏仁核组织中为上调基因,见图5F。
3 讨论
既往研究表明,海马和杏仁核与抑郁症的发生密切相关[6]。海马体积缩小是抑郁症神经影像学研究中最为常见的发现[7],对抑郁症患者死亡后脑分析发现基底外侧杏仁核功能障碍与抑郁症的病理生理有关,同时有研究表明,杏仁核体积及活动减少与抑郁症严重程度密切相关[8,9]。Shen 等[10]研究发现,杏仁核中存在胆囊收缩素阳性和阴性两种神经元,管理小鼠“厌恶”和“愉悦”两种情绪体验,进一步研究发现,胆囊收缩素阳性的神经元表达大量的大麻素受体,敲低大麻素受体的小鼠在社会应激压力下更容易出现抑郁样表现,这些研究均表明,海马及杏仁核功能异常与抑郁症的发生密切相关。因此,本研究利用生物信息学手段,对抑郁症小鼠海马和杏仁核组织中基因表达情况进行深入分析,结果发现,抑郁症小鼠海马和杏仁核组织中有大量基因表达水平发生改变,这些差异基因主要分布在细胞内细胞器中,参与调控RNA聚合酶II启动子转录的调控等生物学过程,与烟酸酯和烟酰胺代谢过程密切相关,而既往的研究已经表明,抑郁症大鼠体内存在烟酸酯和烟酰胺代谢异常[11]。此外,基因集富集分析发现,与长期抑郁有关的基因显著富集,表明此种分析方法具有一定的可靠性和科学性。随后,本研究构建差异基因表达蛋白相互作用网络,并进行核心基因的筛选,发现Fos 和Itpkb 基因可能是与抑郁症有关的核心基因。
Fos 基因属于Fos 基因家族的一员,该家族包括:Fos、Fosl1、Fosl2 和Fosb 共4 个基因,其编码的蛋白质c-Fos 作为一种核蛋白转录因子,广泛参与调控细胞增殖、分化、凋亡等生物学过程,与恶性肿瘤、阿尔兹海默病、帕金森病等中枢神经系统退行性疾病密切相关[12,13],而Fos 基因在抑郁症发生、发展中的作用目前尚未完全阐明。既往研究表明,在慢性应激诱导的抑郁症大鼠海马中,c-Fos蛋白水平显著降低,同样,在右旋苯丙胺戒断诱发的大鼠抑郁症模型中,海马及杏仁核组织中Fos基因mRNA水平显著降低[14]。而Ionov等[15]研究发现,抗抑郁药能上调大鼠侧内嗅皮质和海马背侧下室c-Fos的表达,这些研究均提示,Fos可能作为一个保护性基因抑制抑郁症的发生。Itpkb 基因编码一种肌醇三磷酸激酶,即肌醇1,4,5-三磷酸3-激酶B,属于肌醇多磷酸激酶家族,该家族包括Itpka、Itpkb和Itpkc三种同工酶,其中Itpkb 在脑组织中广泛表达,参与调节免疫反应和细胞内Ca2+平衡。目前关于Itpkb的报道,主要集中在自身免疫性疾病和肿瘤等领域。研究表明,Itpkb与T细胞的活化,肿瘤细胞的生长、转移及耐药等生物学行为有关[16,17]。此外,也有研究报道,Itpkb在阿尔茨海默病患者的大脑皮质中的水平显著增加,Itpkb 过表达可以加剧小鼠阿尔茨海默病[18],而关于Itpkb 在抑郁症疾病中的作用还未见报道。既往有学者认为,磷酸肌醇-钙离子功能相对亢进及腺苷酸环化酶-环磷酸腺苷系统功能减退是抑郁发生的根本原因[19],而Itpkb 本身就具有催化肌醇1, 4, 5-三磷酸(IP3)至肌醇1,3,4,5-四磷酸(IP4)及维持Ca2+平衡的功能,因此,Itpkb 过表达可能是通过引起磷酸肌醇-钙离子功能相对亢进及腺苷酸环化酶-环磷酸腺苷系统功能减退从而促进抑郁症的发生。不过,本研究尚未构建抑郁症动物模型进一步验证海马和杏仁核组织中Fos和Itpkb基因的变化,也未能从动物水平验证Fos和Itpkb 基因敲低及过表达对慢性温和应激诱导的小鼠抑郁症的影响,这有待后续进一步探究。
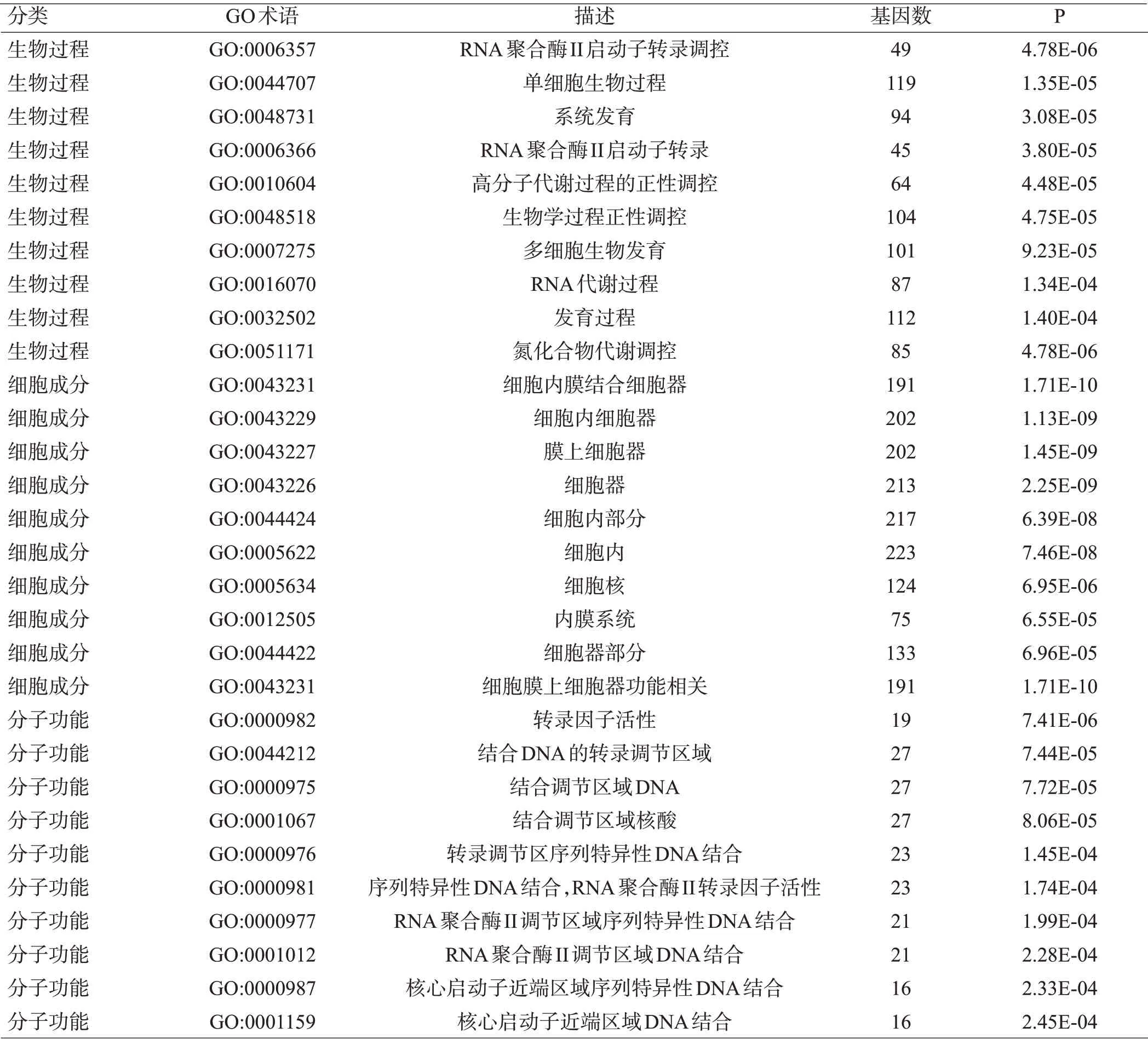
表1 差异基因GO富集分析,包括生物过程、细胞组分、分子功能
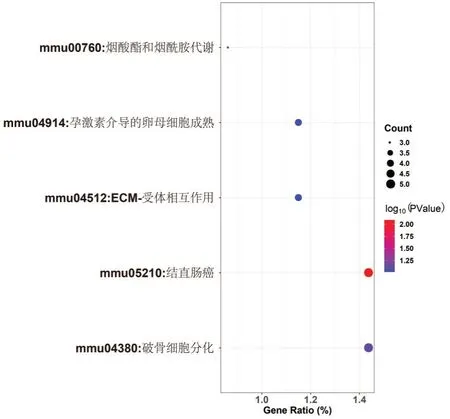
图4 差异基因KEGG信号通路富集分析

图5 差异基因表达蛋白互作网络分析及核心基因筛选
总之,本研究基于公共数据库,利用生物信息学这一快速且经济的方法,发现Fos 和Itpkb 可能是与抑郁症发生相关的关键基因,为后期实验验证提供基础,Fos和Itpkb可能作为潜在的抗抑郁药物治疗靶点。
