精准肝切除理念在腹腔镜下Ⅰ型肝血管瘤剥除术中的应用*
2021-03-29郭志唐滕毅山雷学芬李世思陈章彬
郭志唐,龙 奎,王 琳,滕毅山,孙 敏,雷学芬,李世思,陈章彬
(昆明医科大学第二附属医院肝胆外科 650101)
肝血管瘤为肝胆胰外科常见肝脏良性肿瘤,其大多数不需要外科手术治疗,原则上以随访观察为主,仅血管瘤较大破裂出血风险较高、明显进行性增大、诊断不明确或合并明显临床表现时才需手术治疗[1]。其治疗方式多样、包括外科手术(半肝切除、肝叶切除、血管瘤剥除)、射频消融、介入栓塞等多种手术方式,肝血管瘤射频消融虽然一定程度上降低了手术的创伤,但存在消融不全、血管瘤残留、消融不彻底的问题[2],介入栓塞存在较高的复发率[3]。外科手术切除是肝血管瘤最确切的治疗手段,但是半肝切除或者肝叶切除常需连同部分肝组织切除,导致部分肝组织无辜性切除的同时也增加了手术相关并发症发生率。肝血管瘤剥除术则具有保证血管瘤完整、彻底切除的同时不连同无辜性肝脏切除的优势[4],也正是董家鸿院士所提出的21世纪肝脏外科新理念:精准肝切除理念在肝血管手术治疗上的临床应用。本研究回顾分析本院因肝血管瘤采用腹腔镜下肝血管瘤剥除术治疗的54例Ⅰ型肝血管瘤病例,现总结报道如下。
1 资料与方法
1.1 一般资料
采用描述性病例研究方法,回顾分析2017年1月至2020年3月因肝血管瘤收住本院采用腹腔镜下肝血管瘤剥除术治疗的54例Ⅰ型肝血管瘤患者的病例资料,其中男15例、女39例,年龄24~70岁,平均(48.09±11.96)岁。所有患者均无上腹部手术史、均不合并肝硬化。临床表现为上腹部腹胀不适者26例,其余患者为体检发现,无腹部疼痛等特殊不适。血管瘤位于Ⅱ段5例、Ⅲ段者8例、Ⅳ段者7例,Ⅴ段者11例、Ⅵ段者13例、Ⅶ段者7例、Ⅷ段者3例,血管瘤直径5.1~10.4 cm,平均(7.01±1.42)cm。术后均经病理学检查确诊:肝海绵状血管瘤。
1.2 方法
麻醉成功后,患者取平卧“人”字位,常规碘伏消毒手术区皮肤,铺无菌巾、单。于脐上建立气腹,气腹压力控制在12~14 mm Hg后置入腹腔镜探查腹腔,根据肝血管瘤大小、位置及肝脏与重要脉管结构关系决定戳卡的位置、数量并依次建立各操作孔。
探查腹腔明确肝血管瘤位置及与周围毗邻关系,根据肝血管瘤的位置决定游离肝脏的范围,除位于肝脏膈面与脏面交界处易于暴露的血管瘤外,其他部位血管瘤均常规使用超声刀离断肝圆韧带和镰状韧带、进而离断双侧冠状韧带及三角韧带,将肝脏适度下移以利于肝血管瘤暴露。适度解剖第一肝门,第一肝门处过一根棉线作为预阻断带。充分暴露血管瘤后,用电钩在肝血管瘤边缘标记处预切线,第一肝门阻断后找到肝血管瘤与正常肝组织之间的纤维鞘间隙,采用超声刀沿此间隙逐步解剖切除血管瘤,并配合良好的负压吸引以清楚显露肝血管瘤毗连脉管结构,所遇直径大于2 mm的胆管及血管均予5-0 Prolene线缝闭或一次性康基结扎夹闭后离断,注意准确计时,肝门阻断时间每次小于15 min,间歇时间每次大于5 min,总阻断时间小于120 min。切除完毕后取下第一肝门阻断棉线,检查肝脏颜色及质地有无变化。冲洗术野,彻底止血,检查术野无明显活动性出血后取出切下的肝血管瘤组织。在肝断面下放置乳胶引流管一根、负压引流管一根分别于腹壁戳卡孔引出缝线固定妥当。清点器械、纱布无误后逐层关闭手术切口。
1.3 观察指标
观察患者手术时间、术中出血量、住院时间、总住院费用、术后并发症发生情况及随访患者术后恢复情况。
1.4 统计学处理
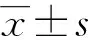
2 结 果
全组54例患者均顺利完成手术,4例合并胆囊结石、1例合并胆囊息肉同时行腹腔镜下胆囊切除术。手术时间(137.50±17.26)min,术中出血量(157.04±40.22)mL。术后出现胆漏3例,2例经腹腔引流管引流及加强营养支持后痊愈,1例因腹腔引流管引流欠佳,复查B超发现肝周包裹性积液后行超声引导下经皮腹腔穿刺置管引流术引流痊愈。术后出现胸腔积液继发肺部感染4例,行超声引导下胸腔积液穿刺引流及加强抗感染治疗后治愈出院。无术后出血、肝衰竭、腹腔感染、切口感染等并发症发生。术后住院时间(11.24±2.11)d,总住院费用(2.31±0.34)万元。所有患者均采用门诊或电话随访,其中6例失访,其余48例患者随访无异常,随访时间3~38个月,中位随访时间16个月。
3 讨 论
肝血管瘤是肝胆外科常见病,其通常被认为是胚胎发育过程中血管过度发育或分化异常导致的血管畸形。其发病率为1.5%[5]。随着人们生活水平及自我体检意识地提高,大多数肝血管瘤被体检发现,因肝血管瘤为肝脏外科常见良性疾病,多以随访为主[6-7]。对于存在较大破裂出血风险或伴发临床症状者才需要手术治疗。2019版肝血管瘤诊断和治疗专家共识[5]中提出肝血管瘤治疗指征为:(1)伴发症状或出现严重并发症者;(2)进行性增大者(增长速度大于2厘米/年);(3)诊断不明确尤其是伴有肝炎、肝硬化、肝癌或其他恶性肿瘤者;(4)伴有严重焦虑等精神症状者;(5)需预防性治疗者。
在肝血管瘤住院患者中仅44.23%具有临床症状,且在有临床症状的患者中约71.87%表现为轻症[5]。其治疗方法多样,包括射频消融、介入治疗、外科手术(开腹/腹腔镜下肝叶切除、开腹/腹腔镜下肝血管瘤剥除术)[8],射频消融治疗因消融电极一次毁损肝肿瘤体积有限及热传导致周围组织热损伤不足存在消融不彻底,肿瘤残留后并发周围组织损伤等不足。肝血管瘤为肝动脉及门静脉双重供血,介入治疗仅可栓塞肝动脉、因此介入治疗很难完全阻断肝血管瘤血供、介入治疗后仅少数患者可保持肿瘤长期缩小状态,大部分患者表现出肿瘤继续增大或短期内缩小后再次继续增大的状态,治疗效果有限。半肝或肝叶切除常需连同肿瘤周边部分无辜性肝组织一同切除,增加了手术的创伤及手术风险。而肝血管瘤剥除术既能彻底切除血管瘤又可避免无辜性肝脏切除、降低手术并发症发生率,具有良好治疗效果,也正是董家鸿院士精准肝切除理念及加速康复外科理念的体现与临床应用[9]。
笔者结合临床实践及手术体会总结以下几点,(1)精确的术前评估及手术规划。术前完善肝脏血管CT检查是必不可少的,通过术前CT检查明确肿瘤的位置及其周围管系结构。术前完善肝储备功能检验,检查患者心、肺、肝功能及凝血、血细胞分析等相关检验,术前精确评估患者肝血管瘤大小及位置、周围毗邻关系、滋养血管来源与走形、手术的耐受性及安全性、必要时结合3D虚拟重建技术,行可视化精确术前评估[10]。在术前精确评估的基础之上进一步进行手术入路、术中处理要点、可能出现的情况及应对措施等的精致规划,条件允许的情况下充分利用术前3D虚拟重建技术及模拟肝切除软件反复推敲与琢磨,做到胸有成竹、心中有数。(2)良好的肝脏游离、暴露及预置阻断。根据肝血管瘤的位置及手术规划,游离肝圆韧带、肝镰状韧带、左右三角韧带、冠状韧带及肝肾韧带,对位于肝右后叶及肝Ⅷ段血管瘤在充分游离右半肝后于右侧肝肾间隙置入水囊使肝脏上移充分暴露肝脏的同时人为创造更大的肝肾间隙以提高手术的安全性。充分游离暴露肝脏第一肝门预置阻断带后行血管瘤剥除,第一肝门预置阻断带可阻断肝脏入肝血流使肝血管瘤质地变软,同时在保证循环稳定的前提下使用各种方法维持低中心静脉压(中心静脉压控制在0~5 cm H2O)降低肝血管瘤张力便于手术操作,此操作还可减少术中出血、降低术后并发症发生率、缩短住院时间并且对肝肾功能无明显影响[11]。但应注意准确计时,肝门阻断时间每次需小于15 min,间歇时间每次大于5 min,总阻断时间小于120 min。良好的肝脏游离、暴露及预置阻断是成功实施手术的关键,即使局部粘连,需花费一定的时间也在所不惜。(3)精细的手术操作。精细的手术操作是手术的核心,肝血管瘤与正常肝组织之间实际存在完整的纤维鞘[12],手术中应正确找到此间隙,沿肿瘤边缘采用超声刀小口钳夹,精细分离,避免分离层次过深或者过浅导致手术创面渗血不止而增加手术的被动性,另外肝血管瘤一般都存在滋养血管,术中正确有效处理其滋养血管后瘤体就会变软、萎缩从而降低手术的难度[13]。直径小于2 mm的脉管结构超声刀基本可以凝闭,但对于大于2 mm的脉管结构术中必须采用Hem-o-lok夹可靠夹闭或Prolene线缝闭后凝断,此种处理可使肝血管瘤切除后的肝脏创面基本不需再次缝合处理。(4)精良的术后管理。肝脏切除术后出血基本在48 h内发生,术后48 h内应严密观察患者引流量、颜色变化及生命体征、尿量、血色素等变化。对于患者出现胆漏在保证引流充分、无明显腹腔内积液潴留的情况下常不需要特殊处理,若存在肝周胆汁淤积引流不畅的情况应果断行超声引导下穿刺引流术[14]。术后给予充分的镇痛并鼓励患者早期下床活动及恢复饮食,患者术后24 h后即可下床活动及进食流质饮食,早期恢复胃肠道功能可降低胸腔积液、肺部感染及体静脉血栓等相关并发症的发生率[15]。其次肝切除术后必要清蛋白、足够热卡的补给及维生素、电解质的补充是非常必要的,低清蛋白血症是术后胆漏的独立危险因素。但同时应注意液体量的控制,遵循“偏干”的原则避免大量输液导致肝脏水肿、加重肝脏负荷[16]。
综上所述,笔者认为在董家鸿院士提出的精准肝切除理念指导下精确的术前评估及手术规划、良好的肝脏游离暴露及预置阻断、精细的手术操作、精良的术后管理,腹腔镜下肝血管瘤剥除术在位于肝脏边缘的Ⅰ型肝血管瘤治疗上安全可行并具有良好治疗效果,值得临床推广应用。
