IL-38对类风湿关节炎患者辅助性 T 细胞17转录因子的影响*
2021-03-28张继云王梅赵旌李文艳
张继云,王梅,赵旌,李文艳
新疆医科大学第二附属医院风湿免疫科(新疆乌鲁木齐 830000)
类风湿关节炎(rheumatiod arthritis,RA)是一种以持续性滑膜炎症为特征的异质性慢性自身免疫性疾病,病因不明,可能由感染和组织损伤等未知起始事件引起,各种炎性细胞因子造成关节疼痛肿胀及系统损害等炎症过程,进而导致软骨和骨质破坏[1]。目前已经证实辅助性 T 细胞17(Th17)细胞在RA中起关键性作用,属于CD4+T 细胞的一类亚群,因其分泌白细胞介素-17(IL-17),所以被称之为 Th17细胞[2]。信号转录和转导因子3(signal transducer and activator of transcription 3,STAT3)与转录因子维甲酸相关孤儿受体C(retinoic acid-related orphan receptor C,RORC)是Th17细胞重要的转录因子,通过经典的JAK/STAT3信号传导通路活化,促进Th17细胞分化[3],导致关节滑膜增殖、软骨侵蚀和全身性的炎症反应,从而引发RA的发病[4-5]。白细胞介素(interleukin,IL)-38是近年来新发现的一种细胞因子,隶属于IL-1家族(IL-1 family,IL-1F),在2001年被命名为IL-1HY2[6]。IL-38在多种组织中表达,如心脏、胎盘、婴儿肝脏、皮肤、脾脏、胸腺以及扁桃体上增殖的B细胞中表达。最近的研究表明,IL-38与慢性炎症性疾病,特别是风湿免疫性疾病,如系统性红斑狼疮(SLE)[7-8]、RA[9-10]、银屑病[9,11]和炎性肠病(IBD)有密切的联系[9]。在我们的前期研究中发现,在RA患者体内IL-38通过调控Th17细胞数量及相关细胞因子的分泌,参与了RA的发生、发展[12]。但其具体机制尚不清楚,在本研究中,通过观察RA患者IL-38对Th17细胞转录因子的影响,从而深入探讨IL-38在RA发病机制中的作用,评估IL-38作为RA临床生物标志物的潜力。
1 资料与方法
1.1 一般资料 收集新疆医科大学第二附属医院风湿免疫科2016年1—4月RA患者30例,年龄28~58岁,平均(34.2±9.6)岁,其中女19例,男11例,诊断均符合1997年美国风湿病学院修订的RA分类标准;30例新疆医科大学第二附属医院体检中心的健康人群作为正常对照组,年龄30~60岁,平均(36±8.5)岁,其中女20例,男10例,均无风湿病史和风湿病家族史。两组间年龄、性别差异均无统计学意义(P>0.05)。所有患者知情同意后,获取血液标本。
1.2 实验方法
1.2.1 外周血单个核细胞(peripheral blood monocytes,PBMCs)分离、培养 采集肝素抗凝外周血5 mL,3 000 r/min,离心10 min,吸取上层血清,-80℃冻存,待ELISA检测;向淋巴细胞分离液中加入2倍稀释的血浆分离PBMCs计数,向5×105PBMCs中加人0.5 mL含10%胎牛血清的RPMI1640培养液,置24孔板中培养,加入5 μg/mL PHA,其中一组中加入50 ng/mL人重组IL-38,置体积分数为5%CO2、37℃饱和湿度培养72 h。
1.2.2 酶联免疫吸附试验(ELISA) 将血浆标本从-80℃冰箱取出,室温下融化,将试剂盒从冷藏室拿出,室温放置15 min。采用IL-38检测试剂盒、RT-6100酶标分析仪,严格按照试剂盒及仪器操作说明对样本进行检测。
1.2.3 实时荧光定量聚合酶链反应(PCR) Trizol法抽提总RNA,用含反转录酶PrimeScriptTMRTase逆转录酶试剂盒将RNA逆转录cDNA,-70℃保存。在ABI Prism 7500测序仪上以cDNA为模版利用DNA聚合酶TaKaRa EX TapTMHS进行实时定量PCR扩增反应,具体操作参照SYBR PrimeScriptTMRT-PCR试剂盒说明书进行。以SDS2.0(PE Biosystem)软件分析各孔Ct值(模板拷贝数扩增到指数上升期所需反应循环数大小,Ct值越大,拷贝数越少)。以GAPDH作为内参,将Ct值减去GAPDH Ct值作为ΔCt值。ΔCt值越低,则表达水平越高。计算标准化后2-ΔΔCt值表示mRNA 的相对表达量。
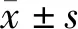
2 结果
2.1 RA组和正常对照组IL-38表达水平的比较 实时荧光定量PCR结果显示RA患者IL-38基因表达水平(2.92±1.96)显著低于正常对照组(5.79±3.55),差异有统计学意义(Z=-1.28,P<0.05);RA患者IL-38蛋白表达水平(0.44±0.03)显著低于正常对照组(0.72±0.58),差异有统计学意义(Z=-1.59,P<0.05);
2.2 RA组和正常对照组RORC mRNA表达水平的比较 RA患者RORC mRNA(6.29±3.98)显著高于正常对照组(1.6±0.95),差异有统计学意义(Z=-1.36,P<0.05);且RORC mRNA表达水平与IL-38水平呈负相关(r=-0.31,P<0.05)。
2.3 RA组和正常对照组STAT3 mRNA表达水平的比较 RA患者STAT3 mRNA(2.72±2.11)显著高于正常对照组(0.69±0.67),差异有统计学意义(Z=-1.24,P<0.05);且STAT3 mRNA表达水平与IL-38水平呈负相关(r=-0.25,P<0.05);
2.4 IL-38对转录因子STAT3表达水平的影响 在体外实验中,RA患者外周血中加入IL-38后,RORC基因表达水平(1.87±1.59)较RA患者(6.29±3.98)明显下降,差异有统计学意义(Z=-1.48,P<0.05)。
2.5 IL-38对转录因子RORC mRNA表达水平的影响 在体外实验中,RA患者外周血中加入IL-38后,STAT3基因表达水平(0.58±0.13)较RA患者(2.72±2.11)明显下降,差异有统计学意义(Z=-1.37,P<0.05)。
3 讨论
RA是一种以与炎症环境相联系的严重关节炎症和破坏为特征的自身免疫性疾病[13]。疾病的发展伴随着滑膜细胞增生、新生血管形成,以及局部大量T细胞浸润。如果不经过正规治疗,病情会逐渐发展,最终导致关节畸形、功能丧失,具有很高的致残率。据报道IL-38基因多态性与脊柱炎、RA和银屑病性关节炎易感性相关[14-16]。此外,实验研究发现IL-38的过度表达或敲除参与了自身免疫性疾病的发病[8,17-18]。由于炎性细胞因子与慢性炎症性疾病在多个层面上具有紧密的联系,结合最近IL-38相关性的研究结果,使得IL-38在炎症性疾病中的调节能力而受到关注。
本研究通过比较RA患者和对照组外周血IL-38水平,我们发现RA患者IL-38表达水平明显低于健康对照组,基于目前的多项研究报道IL-38是一种抗炎因子,可能是经由自分泌或旁分泌通路释放发挥免疫抑制作用,说明在RA患者体内IL-38分泌减少,不能发挥与受体结合以及调节炎症细胞因子的生成作用,从而参与了机体RA的发生、发展。我们前期报道了RA患者IL-38表达水平与Th17细胞数量及IL-17浓度均呈负相关,且IL-38能够抑制Th17细胞的增殖[12]。为进一步明确IL-38对RA患者Th17细胞的调控机制,我们检测RA患者组和健康对照组Th17细胞转录因子RORC、STAT3表达水平,结果显示RA患者RORC、STAT3表达水平显著高于对照组,并且分别与IL-38水平呈负相关,说明IL-38与RORC、STAT3具有一定的相关性。在体外实验中,将IL-38加入RA患者外周血中,发现外周血中RORC、STAT3 mRNA表达水平较前下降,提示IL-38能够抑制RORC、STAT3的表达,综合以上结果,我们推测IL-38通过抑制Th17细胞转录因子RORC、STAT3的转录表达,进而降低了Th17细胞的活化,导致了RA的发病。
IL-38首次被发现距今已经17年,但是目前对于IL-38的认识仍然很少。IL-38属于IL-1F,大部分IL-1F亚家族被认为是炎性细胞因子,能够调节炎症性疾病相关基因的表达。通过我们以上的研究发现,IL-38能够通过调控Th17细胞转录因子RORC、STAT3的表达,造成Th17细胞的分化成熟障碍,最终通过抑制炎性细胞因子的分泌达到抑制炎症的作用。因此,对IL-38的研究将有助于在治疗RA疾病中发掘新靶点。
