细菌抗冻蛋白研究进展及其应用潜力分析
2021-03-27高山惠廖丽胥义陈波
高山惠 廖丽 胥义 陈波
研究进展
细菌抗冻蛋白研究进展及其应用潜力分析
高山惠1,2廖丽2,3胥义1陈波2,3
(1上海理工大学, 医疗器械与食品学院, 上海 200093;2中国极地研究中心, 自然资源部极地科学重点实验室, 上海 200136;3南方海洋科学与工程广东省实验室(珠海), 广东 珠海 519000)
抗冻蛋白是一类在低温下抑制冰晶生长从而保护细胞免受冰晶伤害的特殊蛋白质。抗冻蛋白来源广泛, 包括鱼类、昆虫、植物、细菌、藻类和真菌等。相比动植物来源的抗冻蛋白, 目前针对细菌来源抗冻蛋白缺乏系统性综述与分析。因此重点描述了细菌来源抗冻蛋白的研究进展, 并以其中活性较高、研究较多的4个抗冻蛋白来源种属为代表, 详细介绍了细菌抗冻蛋白目前的研究现状、发展前景和应用潜力。
细菌 抗冻蛋白 极地 研究进展 应用
0 引言
冰冻圈约占地球总表面积的13%, 主要分布在南北两极及高山冰川等区域, 绝大部分时间均处于零度以下低温。此外, 地球上其他地区也会季节性经历低温冰冻, 而冰冻会导致冰晶的形成, 影响细胞渗透压并对细胞产生物理损伤, 给生命带来致命损害。然而, 即便在极端低温下仍然孕育着丰富多样的生命, 其中微生物是冰冻圈的重要生命类群。目前, 已知细菌在–20℃甚至更低的温度下仍然能保持代谢和生命活动[1]。因此, 为了适应冰点以下低温环境, 生物从生理、生化与基因等层面进化出了多种生存策略和机制, 其中一种重要的生存策略便是合成抗冻蛋白(antifreeze protein, AFP)。
抗冻蛋白是一类能够与冰晶吸附结合而改变冰晶生长状态、抑制重结晶的蛋白质, 在降低溶液冰点的同时不改变熔点, 具有热滞活性(thermal hysteresis, TH)、抑制冰重结晶性(ice recrystallization inhibition, IRI)、修饰冰晶形态等3个特性[2]。其中, 热滞活性是区分抗冻蛋白活性高低的重要指标之一, 指抗冻蛋白以非依数性形式改变水溶液的冰点, 而导致冰点和熔点产生差值, 这个活性被称为热滞活性(TH)。在文献中, 冰结合蛋白(ice-binding protein, IBP)、抗冻蛋白(antifreeze protein, AFP)和冰核蛋白(ice-nucleating protein, INP)存在一定的混淆。一般情况下抗冻蛋白和冰核蛋白统称为冰结合蛋白。与抗冻蛋白作用几乎相反, 冰核蛋白能促进零度低温下非均相成核, 因为冰核蛋白往往存在于细菌外表面, 因此能把冰晶形成位置控制在胞外, 从而防止细胞内部因冰晶导致的损伤[3]。抗冻蛋白和冰核蛋白同样都是细胞在冰冻环境中的生存策略, 而且报道有些抗冻蛋白也具有较低的冰核活性, 反过来有些冰核蛋白也具有一定的抗冻活性[3-5]。
抗冻蛋白最先由加拿大科学家Devries和Wohlschlag[6]从南极海域中一种名为的鱼类血清中分离。随后从昆虫[7]、植物[8-9]、真菌[10]、酵母[11-12]、藻类[13]和细菌[14]中均分离鉴定了不同类型的抗冻蛋白。除了对生物本身抵抗寒冷环境具有重要意义外, 抗冻蛋白也具有广泛的应用空间, 例如在冷冻食品行业[15]、低温生物医学领域[16]、农业[17]、航天[18]等领域具有广泛的应用潜力。
经过几十年的积累, 科学家在抗冻蛋白的基因工程操作、活性检测、抗冻机制等方面取得了诸多进展, 并且仍然不断有新的抗冻蛋白及其基因报道。细菌抗冻蛋白的发现比鱼类抗冻蛋白晚30多年, 但因为细菌抗冻蛋白具有良好的可操作性、较高的抗冻活性以及可规模化放大等特征, 逐渐成为抗冻蛋白的重要来源。
1 细菌抗冻蛋白的发现历程
最初在细菌中发现的抗冻蛋白, 其活性低于已经发现的昆虫来源高活性抗冻蛋白[19-21], 但后续研究发现, 细菌也可以产生高活性的抗冻蛋白。例如从南极Ace湖分离得到的菌株能产生一种高活性抗冻蛋白AFP, 其热滞活性在2.9 μM时能达到最大(2.0°C)[14]。接着, 在细菌中陆续发现多种具有较高热滞活性的抗冻蛋白, 这表明细菌来源的抗冻蛋白可以和高活性昆虫抗冻蛋白媲美, 甚至在其他方面更具优势, 意味着细菌可能蕴藏了丰富多样的抗冻蛋白。考虑到细菌种类的高度多样性以及大量尚未分离培养的细菌, 细菌抗冻蛋白可能成为今后抗冻蛋白, 尤其新抗冻蛋白的主要来源。
2 细菌抗冻蛋白及其来源菌株
2.1 细菌抗冻蛋白基本特征
目前研究较多的细菌抗冻蛋白约10种(见表1), 已知的分子量范围跨度很大, 为25 ~1 500 kDa,多数集中在50~80 kDa范围。由此可见细菌抗冻蛋白的大小差异很大, 但跟冰结合相关的结构域大小比较接近, 见图1a。
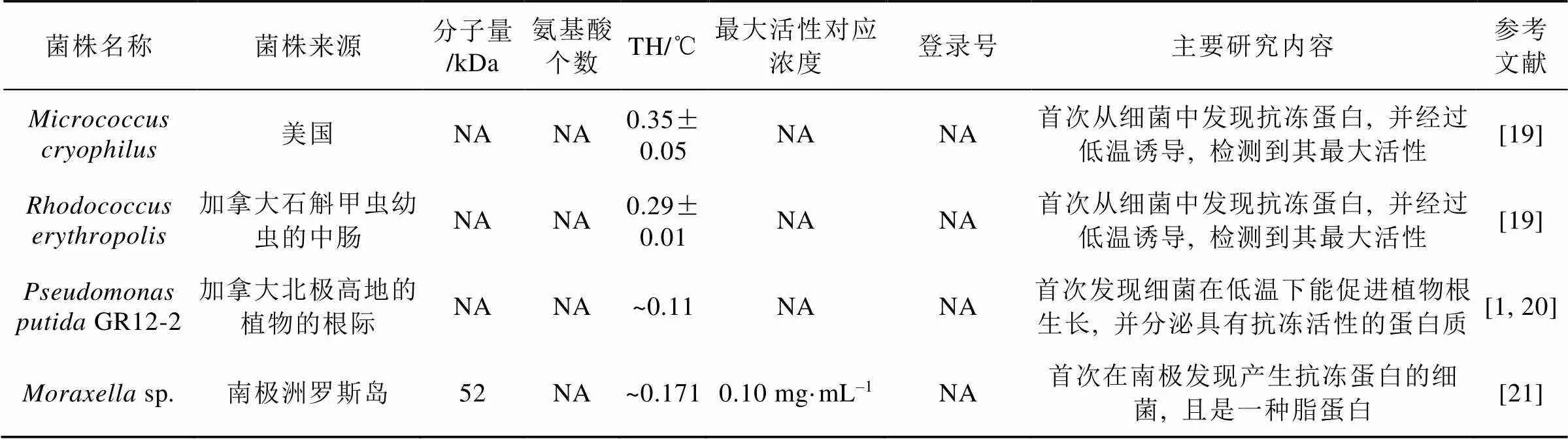
表1 细菌抗冻蛋白
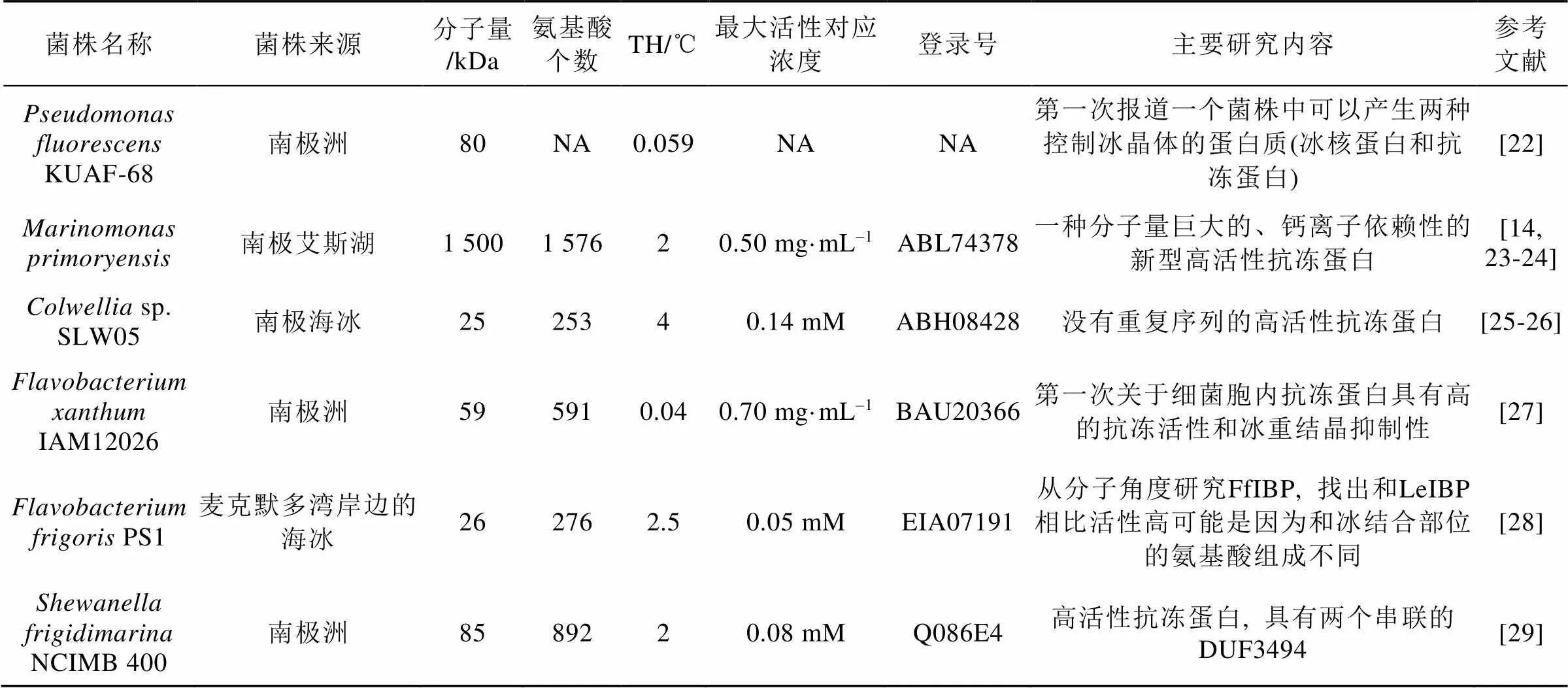
续表1
注: NA means not available.
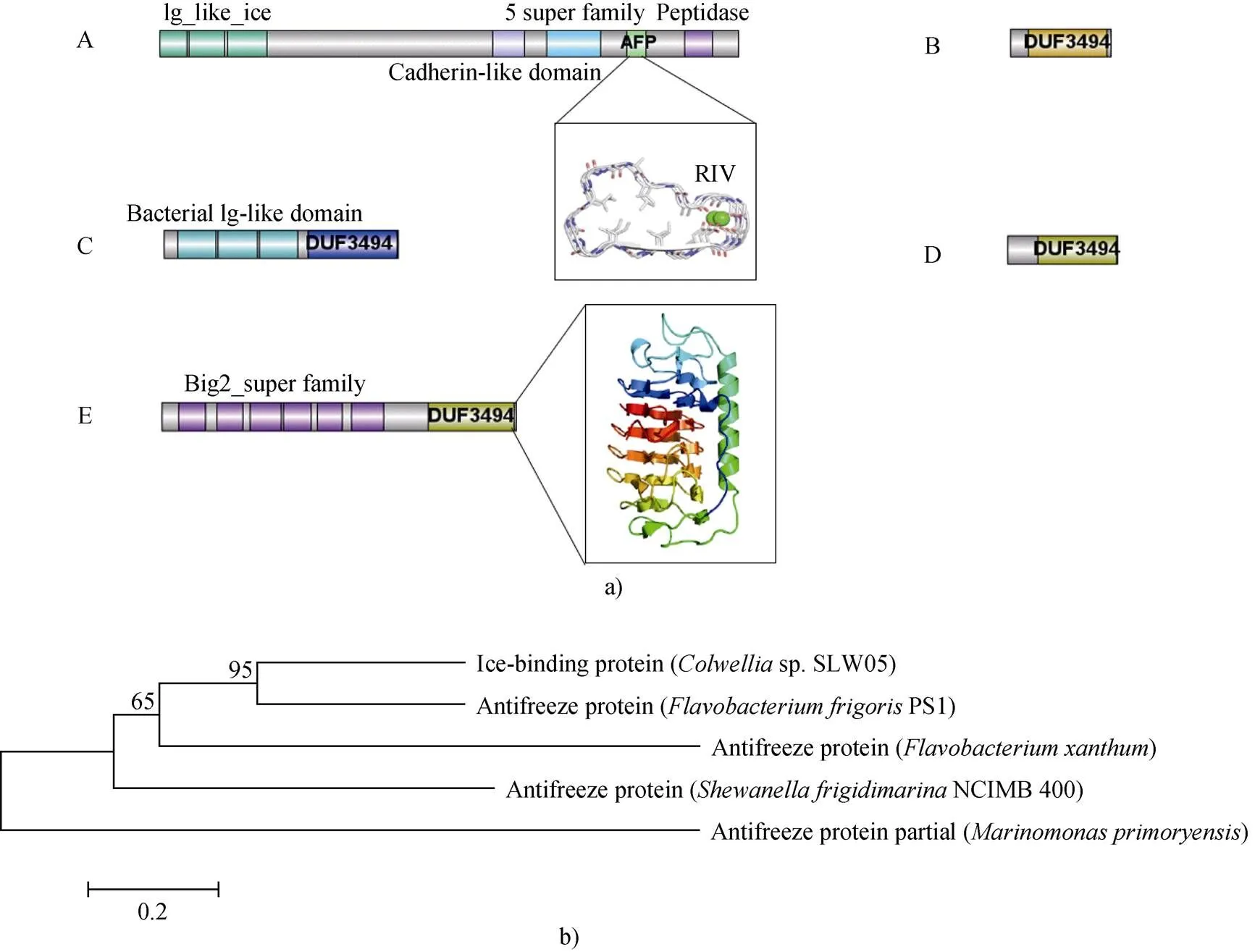
图1 细菌抗冻蛋白结构及进化树. a)5种主要细菌抗冻蛋白结构域示意图;b)进化关系分析. A—E分别代表Marinomonas primoryensis来源的抗冻蛋白MpAFP、Colwellia sp.SLW05来源的抗冻蛋白ColAFP、Flavobacterium xanthum IAM12026来源的抗冻蛋白、Flavobacterium frigoris PS1来源的抗冻蛋白FfAFP和Shewanella frigidimarina NCIMB 400来源的抗冻蛋白SfIBP_1
Fig.1. Structure and phylogenetic tree of bacterial antifreeze proteins. a) schematic diagram of antifreeze protein domains of five bacterial species; b) analysis of evolutionary relationship. A to E standards for AFPs from(AFP),sp.SLW05 (AFP),IAM12026,PS1 (AFP) andNCIMB 400 (IBP_1), respectively
其中来自的巨型抗冻蛋白因为有长串的结构域II而导致分子量巨大, 但跟冰结合的结构域仅为300多个氨基酸, 该抗冻蛋白在后面进行了详细介绍。而其他的抗冻蛋白均含有DUF3494这个未知功能结构域, 该结构域可能在抗冻蛋白中广泛存在并与冰结合, 是冰结合蛋白(IBP)中分布最广泛的一个结构域[30]。
DUF3494结构域通常属于黄杆菌和类杆菌属的细菌, 但由于其数量太多, 因此不确定含有这个结构域的蛋白是否都与冰结合有关。在Pfam数据库中, 预测865个蛋白含有DUF3494, 其中单个DUF3494结构域具有代表性, 含有一个N末端信号肽, 可以分泌到周围环境中, 为生物开辟一个新的适宜环境, 且多与别的结构域结合共同发挥作用, 如图1a中的E。有趣之处在于, 同样含有DUF3494结构域的抗冻蛋白呈现出了不同范围的TH活性, Vance等[31]推测抗冻蛋白的TH不能由单一的DUF3494结构决定, 而取决于全部结构域的组合。
将这些抗冻蛋白中和冰结合有关的结构域部分的氨基酸序列采用软件MEGA-X中的邻接法构建系统进化树, 并进行比较分析(见图1b), 发现和这两个属的抗冻蛋白在进化上较为接近, 而且经过保守结构域分析也可以发现它们都含有DUF3494结构域, 而不含DUF3494结构域的属抗冻蛋白在进化上也同其余抗冻蛋白关系较远。
此外, NCBI蛋白数据库中还有很多尚未发表但公布了序列的疑似抗冻蛋白序列, 有些序列是通过基因组测序后预测得到的。从这些尚未验证的序列来看, 最小的抗冻蛋白可能只有10 kDa左右, 平均约400 kDa大小。由此可见, 抗冻蛋白可能具有一定的普遍性和多样性, 这些未知的序列可能将为抗冻蛋白的研究带来新的认识。
从抗冻蛋白的热滞活性分析,、sp. SLW05、PS1和NCIMB 400菌株产生的抗冻蛋白均属于高活性。根据抗冻蛋白的热滞活性, 将0~2℃认为中活性, 而高活性抗冻蛋白在同等TH下, 浓度仅为十分之一, 甚至最高TH, 可达2~13℃[3, 31](表1)。其中以的抗冻蛋白热滞活性最高。热滞活性的大小跟蛋白质分子量没有直接的相关性, 但有研究[29]表明热滞活性大小和冰结合结构域的数量有正相关性。
从蛋白质空间结构特征分析, 与冰结合面常常形成β折叠片组成的β螺旋扁平状结构, 这种结构特征似乎在包括鱼类、昆虫和微生物在内的抗冻蛋白都普遍存在, 暗示着抗冻蛋白的抗冻机制可能具有普遍性。
[5] Hillary Rodham Clinton, Secretary of State, Interview With Greg Sheridan of The Australian, Melbourne, Australia, November 8, 2010, http://www.state.gov/secretary/rm/2010/11/150671.htm.
2.2 抗冻蛋白来源菌株
生产抗冻蛋白的菌株往往为嗜冷菌, 大多数分离自南极或者北极等常年寒冷地区。实际上, 南北极成为产抗冻蛋白菌株的主要来源。例如从南极拉丝曼丘陵(Larsemann Hills)和西福尔丘陵(Vestfold Hills)湖泊中分离了866个菌株, 其中187株具有可能的抗冻蛋白活性(占比22%), 进一步检测发现其中19株具有显著的冰重结晶抑制活性, 主要属于γ变形杆菌纲, 其次为α变形杆菌纲[32]。从北极冰尘中分离的14个菌株中有8个具有抗冻蛋白活性(占比一半以上), 分别来自和两个属, 其中一株能产高热滞活性的抗冻蛋白[33]。此外, 从南极发草()的叶际分离得到的菌株中, 32个(占比21%)菌株的蛋白质粗提物具有抑制重结晶的功能[34]。从南极岛屿与大陆的多处样品中, 分离获得103株菌, 经过反复冻融处理获得17株能产生冷冻保护剂的菌株, 经过热滞活性检测后, 8株菌显示了0.3~0.5℃的热滞活性, 对其中3株热滞活性最高的菌株进行了进一步分析, 鉴定为,和属的细菌, 并从这3个菌株中分离纯化了4个抗冻蛋白, 分子量在34~51 kDa; 作者还进一步测序了这3个菌株的基因组, 从中鉴定了4个抗冻蛋白编码基因。除了针对抗冻蛋白合成菌株进行广泛筛选外, 目前已经对代表性细菌抗冻蛋白进行了较为详细和深入的研究, 详见表1。产生这10个抗冻蛋白的菌株也基本都来自南极或者北极的多种环境样品, 包括海冰、湖冰、植物根际等, 只有一株分离自未知来源的甲虫肠道例外。这些前期的菌株分离与抗冻活性分析表明, 南北极确实具有合成抗冻蛋白的丰富菌株资源, 也表明有更多未知的抗冻蛋白有待发现。
从系统发育上分析, 产生抗冻蛋白的菌株主要分布在放线菌门, γ、β和α变形杆菌纲, 拟杆菌门等类群(表1), 从属的分布来看, 最常见的产抗冻蛋白的细菌属为, 其次为, 另外在和等属也有产抗冻蛋白的菌株报道。如果加上尚未验证的抗冻蛋白序列, 属水平的多样性会更高(见图2)。可见抗冻蛋白合成菌株在属水平具有良好的多样性, 表明利用抗冻蛋白来防止冰晶的损伤从而适应极端低温环境是一种比较普遍的机制, 同时也表明细菌来源的抗冻蛋白具有来源广、多样性高的优势。细菌抗冻蛋白以这4个属研究最多, 下面以这4个属的代表性抗冻蛋白为例来详细阐述细菌抗冻蛋白的研究进展。
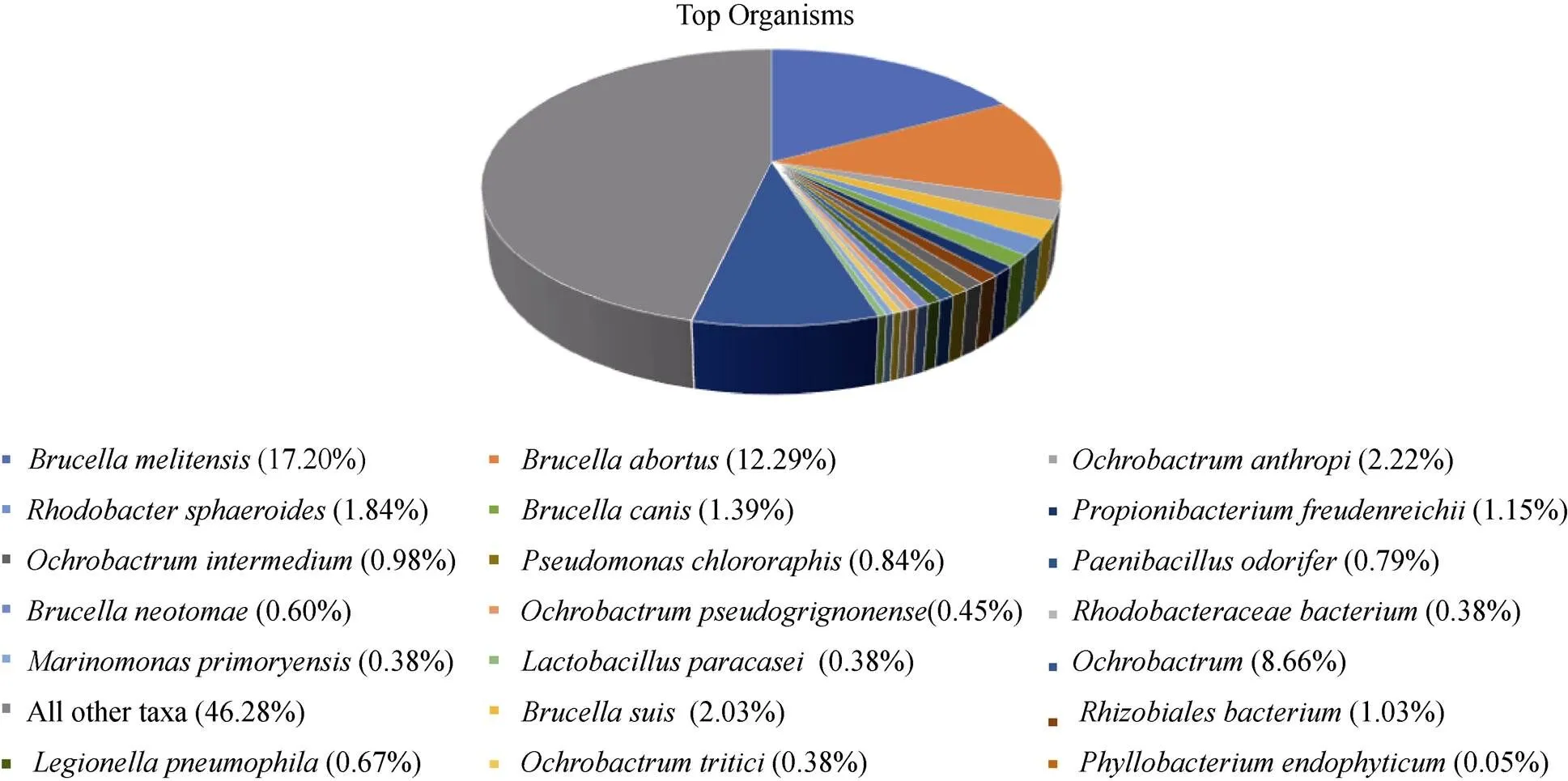
图2 疑似抗冻蛋白主要种属分布图
Fig. 2. Distribution of putative antifreeze protein-producing species
3 代表性细菌抗冻蛋白
3.1 Marinomonas属抗冻蛋白
属研究最多的抗冻蛋白来自南极Ace湖的菌株所产生的巨型抗冻蛋白。2005年, Gilbert等[23]首次在细菌中发现了巨型抗冻蛋白AFP, 其分子量高达1.5 MDa, 属于一种钙离子依赖性蛋白, 热滞活性高达2℃, 这是首次从细菌中发现高活性的抗冻蛋白。随后通过构建λ基因组文库获得AFP部分序列, Guo等[35]通过序列分析确定该AFP包含5个不同分区, 并完成冰结合结构域的克隆与表达, 共包含322个氨基酸, 建模分析表明冰结合区呈现β-螺旋结构, 重组蛋白在0.5 mg·mL–1浓度下即可达到2℃热滞活性。
2011年, Guo等[35]阐明了AFP的冰结合机制, 确定为“包合物锚定”机制。通过确定抗冻蛋白的X射线晶体结构, 解释了这个抗冻蛋白的钙离子依赖性, 并且提供了直接的实验证据, 表明固定的包合物将抗冻蛋白和冰结合。在此之前, 关于冰结合中氢键和疏水作用的贡献已经争论了30多年, 该研究确定了冰结合结构域折叠成结合了钙离子的平行β-螺旋, 通过疏水作用将水分子排列成冰状晶格并通过氢键直接结合到多肽骨架和相邻的侧链上, 由此表明这两种作用在冰结合中不可或缺。而且AFP能同时结合冰的主棱面和基面, 这也是其高活性的主要原因, 尤其和基面结合的能力是抗冻蛋白活性高低的关键决定因素, 中度活性的抗冻蛋白能够使水分子吸附到多个冰平面, 但不包括基面[35]。关于冰结合面的示意图如图3所示。
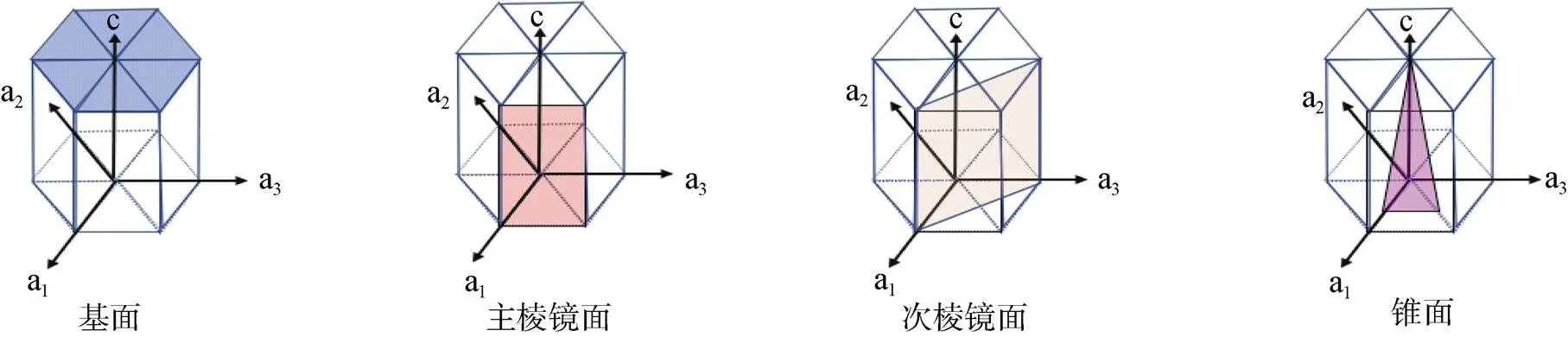
图3 六边形冰的不同晶面(修改自Voets[36])
Fig.3. Different crystal planes of hexagonal ice(Modified from Voets[36])
由于AFP分子量巨大, 结构域又多, 完整结构的解析非常具有挑战, 在多个团队[24, 27, 35, 37-38]共同努力下最终鉴定了组成AFP的5个区域的空间结构。N端区域Ⅰ负责将整个蛋白锚定到细胞外膜; 区域Ⅱ为最长最大的部分(占据整个蛋白质量的90%), 包括大约120个左右的免疫球蛋白类似的β-三明治结构域, 类似于一个长长的手臂将蛋白的余下区域投射到胞外; 区域Ⅲ包含配体结合结构域, 由5个β-三明治结构域组成一个“Y”形状, 负责将藻类和细菌本身结合起来, 起到黏附剂的作用; 区域Ⅳ为唯一的冰结合结构域, 类似毒素重复结构(RTX, repeats-in-toxin), 跟之前解析的结构一致, 除了抑制冰结晶外, 同时也能将细菌通过区域Ⅰ和Ⅱ锚定到冰面; 区域Ⅴ有两个结构部分, 包括可能从区域Ⅳ重复和分化而来的RTX结构域和作为Ⅰ型分泌信号系统(T1SS)的结构域。AFP不仅能使该菌在冰冻的南极湖泊中免受冰冻损伤, 还有利于细菌固定到冰面或藻类寻求更好的氧气和营养供应。
除了菌株外, 在多个菌株中也发现该蛋白类似序列, 但不确定是否具有冰结合和抗冻活性, 但这个属没有发现DUF3494这个广泛存在于抗冻蛋白中的结构域。
3.2 Colwellia属抗冻蛋白
属目前发现可以产生抗冻蛋白的细菌来自南极海冰菌sp. SLW05。2007年, Raymond等[25]首次从南极海冰菌sp. SLW05中发现了一种分泌在细胞外的, 可以改变冰生长形态的物质。sp. SLW05是从海冰中的盐水通道中分离出来的[25], 在海冰中, 研究者[39]认为IBP对维持生物体的生存至关重要, 在细胞外空间仅分泌少量具有有效活性的AFP, 不仅可以支持细菌本身, 而且可以支持海冰环境中的共存生物。初步鉴定分子量为25 kDa左右后, 通过基因测序, 发现这是一个编码253个氨基酸的蛋白质。序列分析显示该蛋白同此前发现的两种来自海冰硅藻和雪霉所分泌的冰结合蛋白相似度较高, 分别为59%和60%。重组蛋白显示了冰结合活性和重结晶抑制性。
在Raymond等人鉴定了AFP和多种嗜冷微生物产生的抗冻蛋白有同源性的研究基础上, Hanada等[26]对该抗冻蛋白的基因进行了克隆与异源表达, 重组的抗冻蛋白在0.14 mM浓度下表现出4℃的热滞活性, 并利用了荧光对其冰平面亲和力进行分析, 观察到这个抗冻蛋白和冰的多个平面相结合, 其中包括基面。这表明AFP是一种高活性的抗冻蛋白, 对其晶体结构的解析表明该抗冻蛋白和冰结合的部分同已知的抗冻蛋白同系物类似, 是一个不规则的β螺旋结构。通过分子对接和同系物突变研究证明,AFP具有两个冰结合位点, 分别为β螺旋区和相邻的环区, 并且这两个区域看似相连接, 但是却相对独立的和冰的多个平面结合, 发挥抗冻特性。在环境选择压力下, 有多个冰结合位点(IBS)对微生物是有益的, 当一个发生突变而失活的时候, 由于存在另一个活性IBS, 蛋白质的抗冻活性能够继续发挥作用。该研究表明, 嗜冷微生物通过抗冻蛋白以一种新的方式和冰结合来保护自身免受低温伤害。
AFP除了通过位于β螺旋平面和相邻环区的两个活性复合位点来与冰结合之外, 最突出的一个特征是与冰结合区域的序列中并没有重复序列, 而此前发现的高活性抗冻蛋白中均有特有的(TXT)重复序列出现。且AFP会在垂直于c轴的6个方向上引起冰的爆发性生长, 表明该抗冻蛋白对冰晶的基面和棱镜面具有较好的亲和力, 而冰晶在垂直于c轴方向破裂的现象是所有高活性AFP的关键特征[40], 同时映证了AFP具有较高的TH活性。且该细菌的结构域中存在高活性抗冻蛋白结构域DUF3494。
3.3 Flavobacterium属抗冻蛋白
2012年, Raymond和Kim[41]偶然从细菌PS1菌株中发现了抗冻蛋白, 并发现该抗冻蛋白在系统发育树上和藻类抗冻蛋白较为接近, 其氨基酸序列相似性达47%, 表明两者存在基因水平转移现象。在此之前, 人们认为不同生物之间的水平基因转移很少发生, 但是如果不同生物共享同一个栖息地, 那这种转移发生的概率会大大增加。 Do等[42]对此蛋白做了异源表达, 其热滞活性在50 mM时为2.5℃。同时, 研究者发现与其氨基酸序列相似度为56%的北极酵母抗冻蛋白IBP的热滞活性却只有lBP的十分之一。为了探究其活性差异的原因, Do等[42]对IBP进行了结晶和初步的X射线晶体衍射分析, 发现IBP在C端有个疏水环, 促使其形成二聚体, 而IBP的C端则没有这个结构, 因此在溶液中以单体存在。对IBP而言, C端截短体比野生型蛋白具有更高的热滞活性, 因此猜测蛋白质在单体状态下更能自由地与冰结合, 有更高的TH活性。
在进一步结构优化和建立模型的基础上, Do等[28]在2014年对其结构进行了一个详细的介绍。通过对IBP和IBP两者的结构比较, 研究者认为IBP具有高活性的原因至少有两方面, 其一与C端的环区结构有关。IBP有较短的C端环区, 在溶液中以单体形式存在, 能更自由地与冰结合而相互作用。减少IBP的C端环区序列后, TH活性提高了13%。通过多序列比对结果显示, 这个C端环区结构在抗冻蛋白中是最多变的区域, 没有很好的保守性, 因此可能是IBP的独特结构。其二在于IBP具有不同的更规则的冰结合残基, 并且在冰结合部位有较大的表面积。IBP的冰结合位点是由一个T-a/G-X-T/N模块组成的, 和高活性抗冻蛋白的氨基酸残基组成类似。因此, Do等[28]认为IBP和IBP之间TH活性的差异可能是由冰结合位点的氨基酸组成不同所引起的, 由此导致了蛋白质对冰晶体的亲和力和表面互补性的差异, 进而使得TH活性不同。且FfIBP的结构中发现有分子内二硫键的存在, 这在别的抗冻蛋白中尚未发现。
Kim等[43]利用大肠杆菌作为生物反应器, 生产重组的IBP, 以检验扩大生产规模的可行性。在发酵过程中, 氧气转移是影响细胞生长和重组抗冻蛋白产生的最重要的因素。带有pET28a-IBP载体系统的大肠杆菌产生的重组抗冻蛋白的最终产量为1.6 g·L–1, 比先前使用pCold I-IBP载体系统发表的报告中产量高3.8倍, 最高热滞活性为2.5℃, 对应的蛋白质浓度为9.7 μM。该研究成功实现了IBP的中试规模生产。
3.4 Shewanella属抗冻蛋白
DUF3494是分泌性抗冻蛋白中存在的保守结构域, 广泛分布在嗜冷菌和经常出现在寒冷环境中的细菌物种中。属发现的抗冻蛋白是一个含有DUF3494蛋白的多结构域的代表。
Vance等[29]将之前已经发现的来自南极的细菌, 通过生物信息学的分析预测到其中含有两个DUF3494结构域的假定蛋白(IBP)的存在。IBP具有两个串联的DUF3494结构域, 且这两个结构域编码序列间隔292 bp, 含有两个典型的细菌启动子, 分别属于两个不同的操纵子控制区。下游区域有一个C末端结构域, 与已知的含DUF3494结构域的抗冻蛋白AFP和IBP有大约50%的序列同源性, 与上游的C-末端片段约有30%的序列同源性。该报告中将上游的蛋白质称为IBP_1,下游的称为IBP_2, 并对其结构进行了细致的分析。在信号肽后这两个蛋白都包含了串联排列的β-三明治结构, 但IBP_1包含7个,IBP_2包含2个, 彼此间具有相当高的序列同源性。但是这两个大的亚型间的相似性则较小。
迄今为止, 并没有对含有DUF3494这个大结构域的蛋白做冰活性分析, 因此该研究对IBP_1的DUF3494结构域作为重组蛋白表达, 分析了其活性。其热滞活性介于IBP和IBP之间, 同AFP相比,IBP_1能达到与其相当的活性(~2℃)。冰亲和荧光平面分析结果显示, 这两个蛋白质都结合了整个冰球, 包括冰的基面, 且有抗冻蛋白结合的冰在融化期间会形成独特的形状, 这是高活性抗冻蛋白的典型表现。因此, 这个抗冻蛋白被认为是高活性抗冻蛋白。通过X射线研究了其冰结合区的三维结构, 进一步证实了IBP_1和冰结合的表面是一个稳定的螺线管结构, 而这个特殊的螺线管结构是由串联的脯氨酸和静电作用力共同介导下形成的两个环在相互作用, DUF3494结构域和膜之间的相互作用能够让它们的宿主菌结合到冰上。
Vance等[29]发现, DUF3494家族的TH活性范围较广, 与它们在冰结合面上的多样性有关, 这些冰结合面的氨基酸组成和与之形成的空间拓扑结构导致它们和冰面有不同的亲和力。IBP_1很可能是一个新的冰黏附素家族,具有黏附蛋白特有的3个特征, 参与细胞与环境之间的接触。这点同AFP的结构十分类似, 且功能区可直接进行比较。通过对DUF3494和冰黏附素的研究可以进一步了解生物在寒冷环境下的生存策略。
4 细菌抗冻蛋白的应用潜力
目前, 随着低温生物技术、转基因技术等的快速发展, 亟需对稀有菌毒种资源(如鼠疫杆菌、霍乱弧菌、埃博拉病毒等)、人类细胞、器官和组织, 以及各类种质资源实现高质量保存, 就需要探索安全、高效、绿色的低温保护剂方案。而抗冻蛋白作为新型低温保护剂, 在低温生物行业、食品、农业等领域的应用潜力巨大。因此, 获得廉价、功能优良、具有生产潜力的抗冻蛋白的意义重大。
根据调研结果, 目前已经投入市场的抗冻蛋白主要来源于鱼类, 但存在以下几个不足之处: (1)从鱼类中提取抗冻蛋白, 其成本过于高昂且来源不稳定, 不具有可持续性; (2)从鱼类体内提取抗冻蛋白, 作为食品添加剂使用, 会干扰添加食品的风味; (3)鱼类与昆虫的抗冻蛋白在基因操作与放大培养等方面难度大。相比之下, 细菌抗冻蛋白的分离纯化具有可操作性强, 便于量产, 来源广泛、稳定的特点, 其市场应用潜力巨大。
迄今为止, 细菌抗冻蛋白在基础分析方向发展较快, 但实际应用方面较匮乏, 其原因在于现有细菌抗冻蛋白的抗冻机理研究并不透彻, 分离纯化到高活性的细菌抗冻蛋白较困难, 利用生物反应器大量生产的实验研究较少。Sun等[20]在初次从植物根系的细菌中分离出抗冻蛋白, 并发现此细菌由于分泌抗冻蛋白不仅能维持自身的良好生长, 还能促进共生植物的生长。Kim等[43]利用大肠杆菌作为生物反应器异源表达IBP发酵生产抗冻蛋白, 成效不错。Song等[44]将分离自南极细菌的不同细菌抗冻蛋白溶液和鱼类Ⅲ型抗冻蛋白添加到黄瓜和西葫芦的切片中, 同对照组相比, 未添加任何抗冻蛋白溶液的黄瓜和西葫芦的细胞壁受到严重破坏, 而添加了抗冻蛋白后观察到了保护作用, 显示了抗冻蛋白在冷冻食品中的应用潜力。总体来讲, 尽管细菌抗冻蛋白的应用潜力较大, 但尚未得到充分发挥, 亟需加大相关基础研究工作的力度。
5 结论
关于抗冻蛋白的研究由来已久, 特别是鱼类、昆虫的抗冻蛋白研究已经比较透彻, 而细菌抗冻蛋白关注较晚。目前对细菌抗冻蛋白的结构、功能研究较全面的种属只有和关于细菌抗冻蛋白应用部分, 则研究较少, 目前仅限于实验室阶段, 仅有一则报告利用大肠杆菌作为生物反应器异源表达IBP发酵生产抗冻蛋白, 成效不错[43]。
南北极作为地球上环境最复杂的区域, 其极端寒冷、高辐射的气候使得生活在南北两极的细菌具有特殊的功能, 目前发现的所有产生抗冻蛋白的细菌均来自于两极及其附近地区。从极地微生物中发掘高活性抗冻蛋白, 并利用大肠杆菌大量生产是一种较为可行的思路。抗冻蛋白良好的应用前景能产生巨大的经济效益, 这对于我国利用、开发海洋与极地资源具有重要意义。
1 XU H, GRIFFITH M, PATTEN C L, et al. Isolation and characterization of an antifreeze protein with ice nucleation activity from the plant growth promoting rhizobacterium Pseudomonas putida GR12-2[J]. Canadian Journal of Microbiology, 1998, 44(1): 64-73.
2 王羽晗, 李子豪, 李世彪, 等. 植物抗冻蛋白研究进展[J]. 生物技术通报, 2018, 34(12): 16-26.
3 BAR DOLEV M, BRASLAVSKY I, DAVIES P L. Ice-binding proteins and their function[J]. Annual Review of Biochemistry, 2016(85): 515-542.
4 WILSON P W, OSTERDAY K E, HENEGHAN A F, et al. Type I antifreeze proteins enhance ice nucleation above certain concentrations[J]. J Biol Chem, 2010, 285(45): 34741-34745.
5 KOBASHIGAWA Y, NISHIMIYA Y, MIURA K, et al. A part of ice nucleation protein exhibits the ice-binding ability[J]. FEBS Letters, 2005, 579(6): 1493-1497.
6 DEVRIES A L, WOHLSCHLAG D E. Freezing resistance in some Antarctic fishes[J]. Science, 1969, 163(3871): 1073-1075.
7 于淑惠. 白蜡虫低温适应分子机制及抗冻蛋白功能研究[D]. 北京: 中国林业科学研究院, 2016.
8 GRIFFITH M, ALA P, YANG D S, et al. Antifreeze protein produced endogenously in winter rye leaves[J]. Plant Physiology, 1992, 100(2): 593-596.
9 SIDEBOTTOM C, BUCKLEY S, PUDNEY P, et al. Heat-stable antifreeze protein from grass[J]. Nature, 2000, 406(6793): 256.
10 NEWSTED W J, POLVI S, PAPISH B, et al. A low molecular weight peptide from snow mold with epitopic homology to the winter flounder antifreeze protein[J]. Biochemistry and Cell Biology, 1994, 72(3/4): 152-156.
11 LEE J H, PARK A K, DO H, et al. Structural basis for antifreeze activity of ice-binding protein from arctic yeast[J]. The Journal of Biological Chemistry, 2012, 287(14): 11460-11468.
12 LEE S G, KOH H Y, LEE J H, et al. Cryopreservative effects of the recombinant ice-binding protein from the arctic yeast leucosporidium sp. on red blood cells[J]. Applied Biochemistry and Biotechnology, 2012, 167(4): 824-834.
13 YU O H, KIM S J, PARK J K, et al. Identification of ice binding proteins from Antarctic Marine Algae, AnF0046 and AnF0048[J]. Journal of Bioscience and Bioengineering, 2009(108): S109.
14 GARNHAM C P, GILBERT J A, HARTMAN C P, et al. A Ca2+-dependent bacterial antifreeze protein domain has a novel beta-helical ice-binding fold[J]. The Biochemical Journal, 2008, 411(1): 171-180.
15 YIN M, GUO L, CUI H, et al. Progress in Application Research on Antifreeze Proteins [J]. Journol of Agricultural Biotechnology, 2002, 10(4): 390-396.
16 KAMIJIMA T, SAKASHITA M, MIURA A, et al. Antifreeze protein prolongs the life-time of insulinoma cells during hypothermic preservation[J]. PLoS One, 2013, 8(9): e73643.
17 VENKETESH S, DAYANANDA C. Properties, potentials, and prospects of antifreeze proteins[J]. Critical Reviews in Biotechnology, 2008, 28(1): 57-82.
18 RYKACZEWSKI K, ANAND S, SUBRAMANYAM S B, et al. Mechanism of frost formation on lubricant-impregnated surfaces[J]. Langmuir, 2013, 29(17): 5230-5238.
19 DUMAN J G, OLSEN T M. Thermal hysteresis protein activity in bacteria, fungi, and phylogenetically diverse plants[J]. Cryobiology, 1993, 30(3): 322-328.
20 SUN X, GRIFFITH M, PASTERNAK J J, et al. Low temperature growth, freezing survival, and production of antifreeze protein by the plant growth promoting rhizobacterium Pseudomonas putida GR12-2[J]. Canadian Journal of Microbiology, 1995, 41(9): 776-784.
21 YAMASHITA Y, NAKAMURA N, OMIYA K, et al. Identification of an antifreeze lipoprotein from moraxella sp. of Antarctic origin[J]. Bioscience, Biotechnology, and Biochemistry, 2002, 66(2): 239-247.
22 KAWAHARA H, NAKANO Y, OMIYA K, et al. Production of two types of ice crystal-controlling proteins in Antarctic bacterium[J]. Journal of Bioscience and Bioengineering, 2004, 98(3): 220-223.
23 GILBERT J A, DAVIES P L, LAYBOURN-PARRY J. A hyperactive, Ca2+-dependent antifreeze protein in an Antarctic bacterium[J]. FEMS Microbiology Letters, 2005, 245(1): 67-72.
24 GUO S, GARNHAM C P, WHITNEY J C, et al. Re-evaluation of a bacterial antifreeze protein as an adhesin with ice-binding activity[J]. PLoS One, 2012, 7(11): e48805.
25 RAYMOND J A, FRITSEN C, SHEN K T. An ice-binding protein from an Antarctic sea ice bacterium[J]. FEMS Microbiology Ecology, 2007, 61(2): 214-221.
26 HANADA Y, NISHIMIYA Y, MIURA A, et al. Hyperactive antifreeze protein from an Antarctic sea ice bacterium Colwellia sp. has a compound ice-binding site without repetitive sequences[J]. The FEBS Journal, 2014, 281(16): 3576-3590.
27 KAWAHARA H, IWANAKA Y, HIGA S, et al. A novel, intracellular antifreeze protein in an Antarctic bacterium, Flavobacterium xanthum[J]. Cryo Letters, 2007, 28(1): 39-49.
28 DO H, KIM S J, KIM H J, et al. Structure-based characterization and antifreeze properties of a hyperactive ice-binding protein from the Antarctic bacterium Flavobacterium frigorisPS1[J]. Acta Crystallographica Section D, 2014, 70(4): 1061-1073.
29 VANCE T D R, GRAHAM L A, DAVIES P L. An ice-binding and tandem beta-sandwich domain-containing protein in Shewanella frigidimarina is a potential new type of ice adhesin[J]. The FEBS Journal, 2018, 285(8): 1511-1527.
30 CID F P, RILLING J I, GRAETHER S P, et al. Properties and biotechnological applications of ice-binding proteins in bacteria[J]. FEMS Microbiology Letters, 2016, 363(11): fnw099.
31 VANCE T D R, BAYER-GIRALDI M, DAVIES P L, et al. Ice-binding proteins and the ‘domain of unknown function’ 3494 family[J]. The FEBS Journal, 2019, 286(5): 855-873.
32 GILBERT J A, HILL P J, DODD C E R, et al. Demonstration of antifreeze protein activity in Antarctic lake bacteria[J]. Microbiology, 2004, 150(1): 171-180.
33 SINGH P, HANADA Y, SINGH S M, et al. Antifreeze protein activity in Arctic cryoconite bacteria[J]. FEMS Microbiology Letters, 2014, 351(1): 14-22.
34 CID F P, INOSTROZA N G, GRAETHER S P, et al. Bacterial community structures and ice recrystallization inhibition activity of bacteria isolated from the phyllosphere of the Antarctic vascular plant Deschampsia Antarctica[J]. Polar Biology, 2017, 40(6): 1319-1331.
35 GUO S, GARNHAM C P, PARTHA S K, et al. Role of Ca2+in folding the tandem β-sandwich extender domains of a bacterial ice-binding adhesin[J]. FEBS Journal, 2013, 280(22): 5919-5932.
36 VOETS I K. From ice-binding proteins to bio-inspired antifreeze materials[J]. Soft Matter, 2017, 13(28): 4808-4823.
37 VANCE T D, OLIJVE L L, CAMPBELL R L, et al. Ca2+-stabilized adhesin helps an Antarctic bacterium reach out and bind ice[J]. Bioscience Reports, 2014, 34(4). DOI:10.1042/bsr20140083.
38 GUO S, STEVENS C A, VANCE T D R, et al. Structure of a 1.5-MDa adhesin that binds its Antarctic bacterium to diatoms and ice[J]. Science Advances, 2017, 3(8): e1701440. DOI:10.1126/sciadv.1701440.
39 RAYMOND J A. Algal ice-binding proteins change the structure of sea ice[J]. PNAS, 2011, 108(24): E198.
40 SCOTTER A J, MARSHALL C B, GRAHAM L A, et al. The basis for hyperactivity of antifreeze proteins[J]. Cryobiology, 2006, 53(2): 229-239.
41 RAYMOND J A, KIM H J. Possible role of horizontal gene transfer in the colonization of sea ice by algae[J]. PLoS One, 2012, 7(5): e35968.
42 DO H, LEE J H, LEE S G, et al. Crystallization and preliminary X-ray crystallographic analysis of an ice-binding protein (FfIBP) from Flavobacterium frigoris PS1[J]. Acta Crystallographica, 2012(68): 806-809.
43 KIM E J, KIM J E, HWANG J S, et al. Increased productivity and antifreeze activity of ice-binding protein from flavobacterium frigoris PS1 produced using escherichia coli as bioreactor[J]. Applied Biochemistry and Microbiology, 2019, 55(5): 489-494.
44 SONG D H, KIM M, JIN E S, et al. Cryoprotective effect of an antifreeze protein purified from Tenebrio molitor larvae on vegetables[J]. Food Hydrocolloids, 2019(94): 585-591.
REVIEW OF BACTERIAL ANTIFREEZE PROTEIN RESEARCH AND ITS POTENTIAL APPLICATIONS
Gao Shanhui1,2, Liao Li2,3, Xu Yi1, Chen Bo2,3
(1School of Medical Devices and Food, Shanghai University of Technology, Shanghai 200093, China;2Polar Research Institute of China, Key Laboratory of Polar Science, Ministry of Natural Resources, Shanghai 200136, China;3Guangdong Provincial Laboratory of Southern Marine Science and Engineering (Zhuhai), Zhuhai 519000, China)
Antifreeze proteins (AFPs) are special proteins that inhibit the growth of ice crystals at low temperatures to protect cells from damage by ice crystals. They come from a wide range of sources, and have been found in fish, insects, plants, bacteria, algae and fungi. In contrast to research on AFPs derived from animals and plants, research on AFPs derived from bacteria has yet to be systematically reviewed and analyzed. Therefore, this review reports on the latest research findings on bacterial AFPs, focusing on four bacteria species and their AFPs. We also discuss the prospects and potential applications of bacterial AFPs.
bacteria, antifreeze protein, polar regions, research progress, application
2020年3月收到来稿,2020年5月收到修改稿
国家重点研发计划(2018YFC1406702)资助
高山惠,女,1995年生。硕士,主要从事极地微生物、新型冷冻保护剂的研究。E-mail: 838130650@qq.com
廖丽,E-mail: liaoli@pric.org.cn;胥义,E-mail: xuyi@usst.edu.cn
10. 13679/j.jdyj.20200046
