不同品温大曲及其曲房空气的细菌群落变化规律和相关性
2021-03-27姚亚林邓杰任志强卫春会钟姝霞黄治国
姚亚林,邓杰,任志强,卫春会,钟姝霞,黄治国
(1.四川轻化工大学酿酒生物技术及应用四川省重点实验室,四川宜宾 644000)
(2.四川健能制药有限公司,四川自贡 643000)
“曲乃酒之骨”,大曲是大曲白酒生产必不可少的糖化发酵剂。大曲是在自然条件下制成的集微生物菌系、酶系及物系于一体的复合生物制品,其微生物群落是影响大曲品质的关键因素之一[1,2]。大曲微生物类群极为丰富,主要包括霉菌、细菌、酵母菌等,其中细菌是发酵生香的主要动力。大曲生产是采用自然接种发酵的,其发酵微生物主要来源于自然环境,而环境的变化使得微生物群落变化,从而使大曲的质量有所不同[3]。
随着分子生物学的发展,高通量测序技术越来越多地运用在解析特定的微生物群落结构等微生物研究中[4,5]。吴树坤[6]利用高通量测序比较分析四川不同地区浓香型大曲的微生物群落结构,发现不同地区大曲的微生物多样性存在差异;罗惠波[7]通过PCR-SSCP分析了浓香型大曲发酵过程中真核微生物群落的变化,发现其真核微生物群落的生物多样性在大曲发酵过程中呈先升后降再升高并保持稳定的变化趋势。目前对于大曲的研究多集中在制作工艺、微生物群落结构及储藏中的菌系与酶系等变化上[8-11],而对于制曲微生态环境对大曲微生物群落结构的影响及相关性的研究较少。唐玉明[12]应用多元方差分析法探索了制曲车间不同环境场地间空气微生物种群和数量差异,发现不同环境的微生物差异显著,并且在大曲不同的发酵阶段,微生物的含量和种类均有所不同。Li[13]研究不同工艺的中、低温大曲的微生物群落变化发现,在不同环境作用下,微生物群落结构发生改变。空气微生物在白酒酿造整个环节,无论是制曲还是发酵,都起到自然接种的作用[14,15],而微生物群落结构及多样性研究和分析是揭示酿造过程的代谢规律和生态响应的重要手段。
本研究以高通量测序技术为手段,以泸州地区的中温大曲和高温大曲及其曲房空气为研究对象,探究大曲与曲房空气的细菌群落相关性以及演替规律,并结合环境因素,初步验证环境因素与大曲微生物群落的相关性,为今后大曲生产和研究提供参考。
1 材料与方法
1.1 材料与试剂
试验材料:采自川南地区的某浓香型酒厂和某酱香型酒厂不同发酵阶段的大曲及其对应曲房空气为样品,浓香型大曲发酵周期为30 d,高温大曲的发酵周期为45 d。同一生产阶段大曲及对应曲房空气采取三个平行样本,利用Corolis μ 空气生物采样器采集曲房空气,再将其转入装有无菌水的玻璃瓶中;无菌采集大曲后装入无菌的自封袋中,置于冰盒中迅速运回,粉碎后混匀,保存于-20 ℃留待高通量测序。取样环境参数如表1、表2 所示。
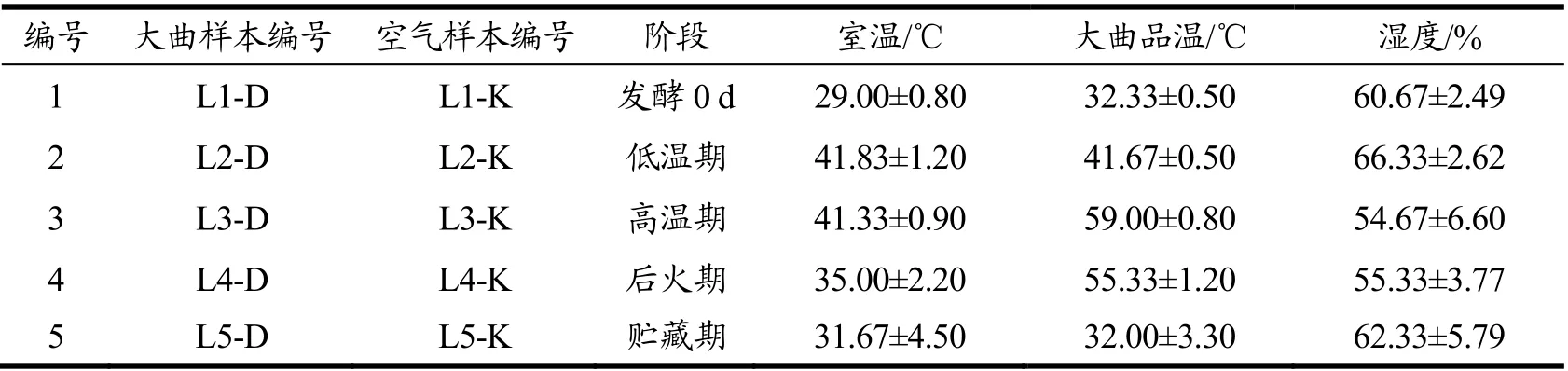
表1 浓香型大曲及空气样品参数Table 1 Sample lable of medium-temperature Daqu and workshop air

表2 高温大曲及空气样品参数Table 2 Sample lable of high-temperature Daqu and workshop air
DNA 提取纯化试剂:PowerSoil DNA Isolation Ki(tMOBIO,美国);Gel Extraction Kit(康为世纪,中国);Quant-iTPicoGreen DNA Kit(Invitrogen,美国);十六烷基三甲基溴化铵、十二烷基硫酸钠(Sigma-aldrich,美国)。
PCR 试剂:buffer、MgCl2、EX taq 酶、dNTPs、DNA Marker(Takara,日本);正反向引物(成都擎科,中国);高通量测序试剂由美国Roche 公司提供。
1.2 仪器与设备
空气生物采样器(Corolis,法国);高速冷冻离心机(Thermo,美国);高速离心机(Eppendorf,德国);均质机(SCILOGEX,美国);荧光分光光度计(Promaga,美国);高通量测序仪(Roche,美国);低温冰箱(Thermo,美国);水平电泳仪、凝胶成像系统、PCR 仪(Bio-rad,美国)。
1.3 方法
1.3.1 空气样品的总DNA 提取
空气样品前处理:在无菌条件下取200 mL 水样,先后用定性滤纸(8 μm,47 mm)和硝化纤维滤膜(0.22 μm,47 mm)进行抽滤,收集水样中的微生物,将滤膜置于50 mL 离心管中,-20 ℃保存备用。
空气样品DNA 提取:采用analytikjena 公司innu SPEED Soil DNA Kit 试剂盒提取空气中细菌的总DNA,提取后DNA 样品取5 μL DNA 样品于1%的琼脂糖凝胶电泳检测其完整性。DNA 样品于-20 ℃保存。
1.3.2 大曲样品的总DNA 提取
准称5 g(干重计)曲粉,采用改良后的CTAB[16]法提取大曲样品中的细菌总DNA。将提取的大曲和空气DNA 样品送至生工生物工程(上海)股份有限公司测序。
1.3.3 大曲理化指标的测定
大曲淀粉、水分和酸度的测定参考《酿酒分析与检测》[17]。
1.4 数据分析
高通量测序数据通过Mothur 软件处理分析,理化检测结果用“平均值±标准误”表示。主成分分析采用SPSS 25.0 软件分析作图,并使用Canoco 5.0 软件对测序数据与理化结果做冗余分析。
2 结果分析
2.1 测序有效性分析
稀释曲线是用来评价测序量是否足以包含所有类群,并能够间接性反应样品的物种丰富度。根据图1的结果可以看出,随测序深度的增加各样品的稀释性曲线变化趋势呈现先增加后趋于平缓,这表明测序的数据量较为合理,测序的深度能够反映出样品中绝大多数微生物的物种信息。

图1 大曲及其空气样品稀释曲线Fig.1 The rarefaction curve of sample in Daqu and workshop air
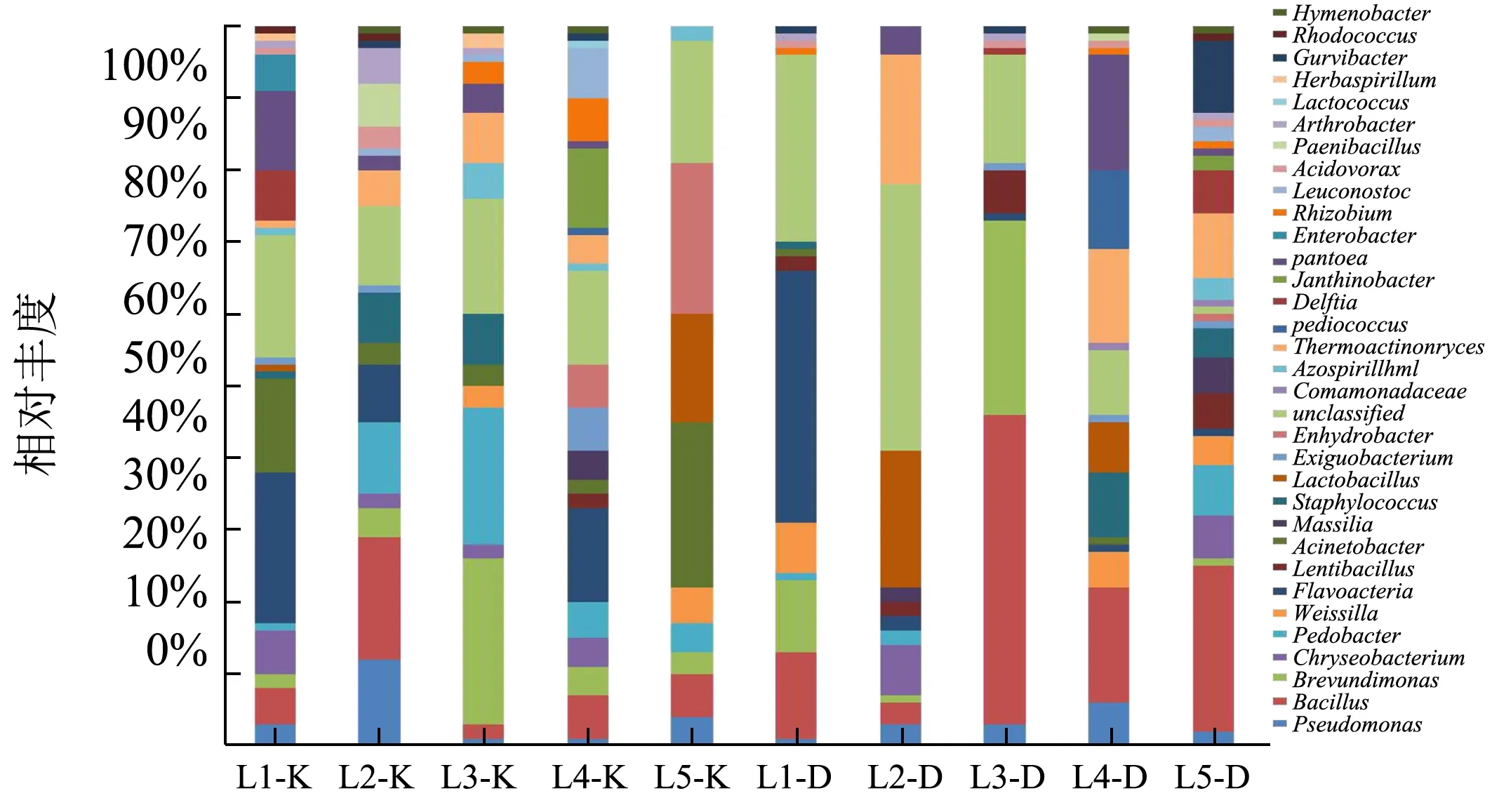
图2 中温大曲和空气细菌属群落分布Fig.2 The bacterial community structure in medium-temperature Daqu and workshop air
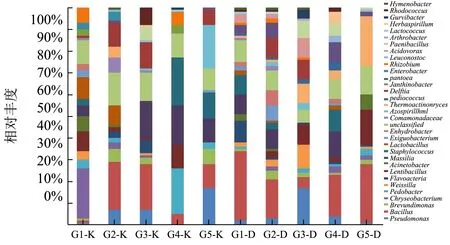
图3 高温大曲和空气细菌属群落分布Fig.3 The bacterial community structure in high-temperature Daqu and workshop air
2.2 大曲和曲房空气中细菌群落多样性分析
将高通量测序所得序列与silva 细菌数据库进行比对,得到每个OTU 在属水平上的群落结构,两个酒厂大曲和曲房空气的细菌属组成如图所示。在属分类学水平上,将没有明确的分类信息归为一类,即unclassified。
如图2 所示,从中温大曲和其曲房空气中共得到33 个细菌属的结构信息。随着发酵温度的增加,大曲与曲房空气细菌种类均呈减少趋势;发酵温度下降后,大曲与曲房空气细菌种类明显增加;到了贮存期后,曲房空气的种类逐渐减少,而大曲细菌种类较为明显地增加,并且大曲细菌种类高于空气中的细菌种类。其中,芽孢杆菌属(Bacillus)在大曲和空气的各个阶段都占有较大比例,并随着发酵进行在大曲中不断积累。芽孢杆菌属是一类抗逆特性较强的菌群,是白酒酿造中丰富酶系和白酒风味成分的重要功能菌[18]。此外,从图中还可以看出,乳杆菌属(Lactobacillus,1.74%)、高温放线菌属(Thermoactinomyces,1.92%)、泛 菌 属(Pantoea, 11.02% ) 和 金 黄 杆 菌 属(Chryseobacterium,1.37%)这几类菌属在开始发酵阶段只存在于空气中,在随后发酵的低温期逐渐进入大曲中得到积累,而魏斯氏属(Weissella,7.34%)、Gurvibacter(1.06%)和根瘤菌属(Rhizobium,1.12%)在开始发酵阶段只存在于大曲中,在低温期和高温期阶段进入空气并逐渐稳定。即在大曲发酵及储存过程中,由于大曲中营养丰富,且大曲与空气中的微生物处于动态迁移的状态,曲中的多种重要酿造微生物都是从空气中网罗而得,而随时间变化部分微生物种类不适应大曲环境而转移至空气中,使得大曲与空气中的细菌种类处于此消彼长的状态。这与车路萍[19]的研究结果较为符合。
如图3,从高温大曲和其曲房空气中得到31 个属结构信息。随着大曲的发酵,除大曲入房4 d 时的大曲细菌种类增加以外,大曲和曲房空气中细菌的种类均逐渐减少,且在整个过程中,大曲中细菌种类多于曲房空气中的细菌种类。随着大曲发酵进行,温度升高,大曲的营养物质、水分等不断变化,大曲及空气中不能适应高温的细菌逐渐消亡,而能够适应环境的细菌种类在大曲中不断富集,同时部分微生物在大曲与空气之间存在动态的物质能量交换,使得大曲与曲房空气的细菌群落组成处于动态变化。慢生芽孢杆菌属(Lentibacillus,9.32%)和乳杆菌(10.22%)属在发酵0 d 时只存在于空气中,在发酵4 d 时进入大曲中生长积累;假单胞菌属(Pseudomonas)在发酵0 d 时大曲和曲房空气中都存在,随发酵变化,逐渐在空气中累积达到较高丰度(17.14%);高温放线菌属是传统高温大曲中的优势菌属,对生长温度具有极高的耐受性,发酵全过程都存在大曲中,并在发酵、贮存中不断生长累积。
通过比较两种大曲制曲过程中的细菌群落的分布及变化发现,高温大曲及其空气细菌群落结构变化与中温大曲及空气有所差异,主要是由于所用母曲、制曲工艺、制曲环境等不同引起的。芽孢杆菌属和高温放线菌属[4]在中、高温大曲发酵的整个阶段都占较大比重,在两种大曲中都属于优势菌群,最终在储存期的丰度分别占到了 23.12%和 9.47%、27.04%和23.18%。这两类菌属都是对丰富白酒酿造的酶系和物系起着重要作用,是大曲微生物菌系中不可或缺的。近几年研究发现高温放线菌属其不仅存在于高温大曲中,在浓香型大曲中也有较高的分布,其丰度主要受制曲温度的影响[20-22]。刘延波对浓香型中温曲和高温曲的细菌群落结构研究发现,其高温放线菌属和芽孢杆菌属的的丰度从中温(5.43%和2.56%)到高温(12.29%和20.93%)都显著上升,与本研究结果基本一致。在中温大曲中,随发酵进行,高温放线菌属由空气进入大曲中累积,在大曲中呈先升高后降低的变化趋势;而在高温大曲中随发酵进行呈升高趋势,在发酵前期空气中仅短暂存在后消亡,这可能是受空气营养缺乏的影响。此外,其他微生物类群也存在动态迁移,如乳杆菌属、泛菌属等酿造功能微生物都是从空气进入中温大曲中生长累积,并影响其群落结构。在两种大曲发酵过程中,都存在着空气微生物与大曲微生物的短暂交替循环,主要是受到环境影响,微生物自主地选择适合生存的空间[23]。
2.3 大曲及曲房空气细菌群落相关性分析
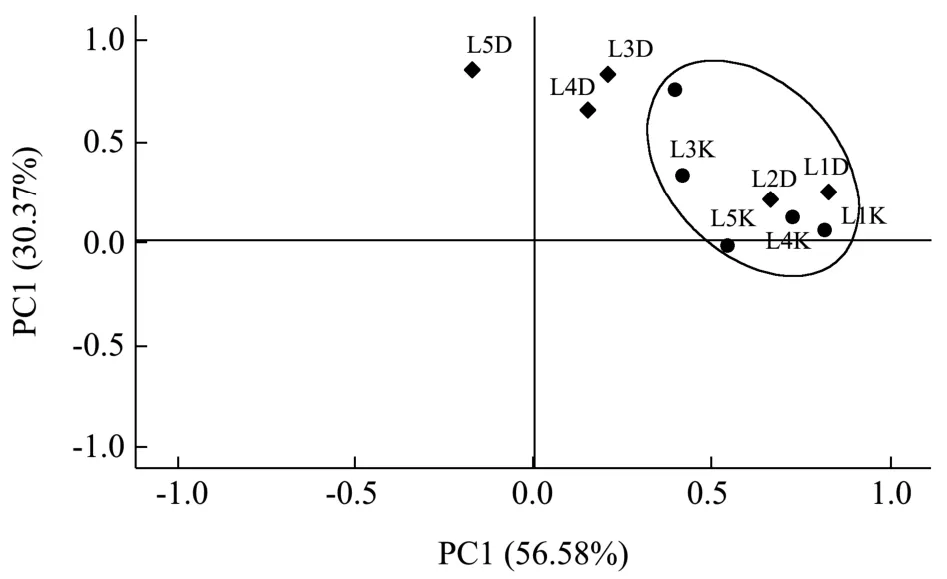
图4 中温大曲与曲房空气样品的细菌主成分分布Fig.4 Principal component analysis of the bacterial community structure in medium-temperature Daqu and workshop air
为探究大曲与曲房空气细菌群落的相关性,对两个酒厂不同阶段大曲与曲房空气样品的OTUs 各自通过SPSS 进行主成分分析,根据样品在主成分各个维度上的位置,分别以PC1 和PC2 为横、纵坐标轴作图,得到样品在主成分上的散点图,根据样品间在分布图中的距离判断其细菌群落结构的差异性和相似性。结果表明,图4中的第一轴能够解释数据56.58%的变量、第二轴能够解释数据30.37%的变量。泸州地区中温大曲及其曲房空气细菌群落在发酵初期较为相似,表明大曲前期可能是微生物自然接种培菌的重要时期之一,这与罗惠波[24]、车路萍[25]的研究结果基本一致。并且L1-K、L2-K、L3-K、L4-K、L5-K 在PC1 上距离接近,表明空气细菌群落组成在发酵整个时期都较为相似。而大曲发酵的高温阶段到储存阶段的细菌群落组成与空气相差较大,与发酵的升温以及后期储存的低水分可能有较大的关联。
高温大曲及曲房空气的细菌群落组成在PC1、PC2 上的分布如图5 所示,G2-K、G3-K、G5-K 和G1-D、G2-D、G4-D、G5-D 在PC1 上较为集中,表明这几个阶段的大曲及空气细菌群落组成相似,微生物存在相互影响。而G3-D 相距其他样点较远,可能受高温大曲的高温阶段影响较大。
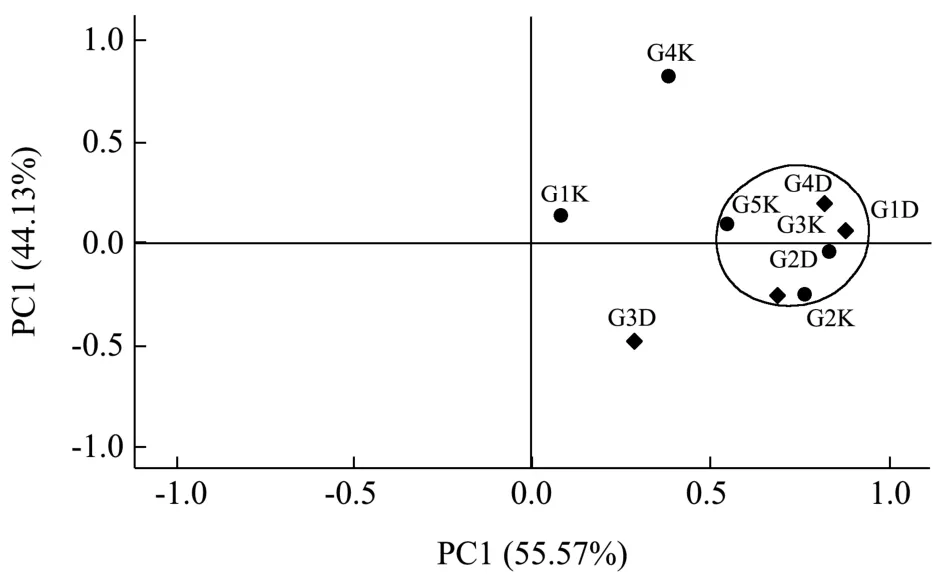
图5 高温大曲与曲房空气样品的细菌主成分分布Fig.5 Principal component analysis of the bacterial community structure in high-temperature Daqu and workshop air
制曲过程中,不同环境的微生物都存在差别,对曲药的微生物结构及感官质量有着重要影响[10,24],车路萍对中、高温大曲及空气微生物种类和生物量研究发现,不同温度大曲及其曲房空气均含其特有微生物种类,其中中温大曲以嗜热解氢杆菌、革兰氏阴性菌为优势菌群,其曲房空气以革兰氏阳性菌、革兰氏阴性菌为优势菌群;高温大曲在发酵后期以革兰氏阳性菌为优势菌群,其曲房空气以革兰氏阴性菌为优势菌群,并且中温和高温大曲及各自的曲房空气微生物在发酵前期群落组成皆相似[25]。这与本研究结果基本符合,这表明空气对大曲微生物群落形成的影响在培菌发酵前期。此研究结果对生产功能菌种强化大曲的菌种选择和添加时间等提供了重要参考。空气微生物在自主地向大曲中迁移,从而使得在发酵过程中一些阶段的空气与大曲的微生物类群相似,这是空气对大曲自然接种的结果,并且可能会赋予大曲一些特定的微生物类群。张亚丽[26]对茅台产区空气微生物的鉴定和分析,发现酱香型白酒在酿造过程中有很大一部分特征微生物来自所处的空气环境中,并且空气中的部分微生物存在一定的稳态。
2.4 不同发酵阶段大曲细菌群落特征与环境因素的关系
大曲的生产是自然接种培菌发酵,其生产环境对制曲有着重要影响,淀粉、酸度、水分和温度等环境因素可能会胁迫性地驱动大曲发酵过程的微生物群落演替[27]。本试验利用RDA 分析将两个酒厂不同阶段大曲的OTUs 与环境因素相结合,选择在发酵过程中丰度较高的22 个菌属,来探讨环境因素对不同阶段大曲细菌群落的影响。

图6 理化指标与大曲细菌群落属水平的RDA 分析Fig.6 The redundancy analysis distribution of bacteria community and physical and chemical indexes in Daqu
如图6 所示,所选择的6 个环境因素共解释57.41%的物种变化,其中第一和第二排序轴分别贡献了20.24%和17.96%。红色箭头表示经Monte Carlo 置换检验对大曲细菌群落结构变化影响显著的环境因素,箭头长度表征着对细菌群落的影响程度。各环境因素对群落结构影响的相关性大小依次为淀粉、水分、酸度、湿度、T2 和T1,其中淀粉、水分和酸度是影响大曲细菌群落结构的主要因素。从图中可以看出,T2和T1 和芽孢杆菌属、高温放线菌属、泛菌属呈正相关,与假单胞菌属、魏斯氏菌属呈负相关;酸度与魏斯氏菌属、嗜酸菌属(Acidovorax)呈正相关;水分和淀粉与黄杆菌属(Flavobacteria)、乳杆菌属、短波单胞菌属(Brevundimonas)呈正相关。在大曲整个发酵过程中,多个环境因素对微生物群落组成协调性、交互性等产生驱动作用,来影响其群落演替。从大曲发酵不同阶段而言,水分与淀粉与大曲发酵前期呈正相关,而温度(T1、T2)与发酵中后期呈正相关。环境因素的变化会推动其群落演替[13],肖辰以中温大曲为研究对象,揭示了生物热是其功能微生物群落形成的关键动力[23];李小龙揭示了乙醇与酸度协同作用推动芝麻香型白酒固态发酵过程的微生物群落演替,其对群落演替的协同解释率为23.17%[28];而本研究发现,不同发酵阶段,推动大曲微生物群落演替的因素不同。发酵前期,大曲的营养充足,淀粉、水分等营养物质对微生物群落组成的影响可能更大,对细菌群落的演替起到驱动作用;而在发酵中后期,由于淀粉、水分等消耗到一定程度,温度对大曲细菌群落的影响占主要地位。Wang[29]对三种清香型大曲的微生物群落组成进行研究,发现其存在显著差异,并推断温度对清香型大曲的微生物形成具有决定性作用。在中温和高温大曲微生物群落形成中温度也是重要的影响因素,这可能是大曲以品温区分的重要原因。
3 结论
不同品温大曲的微生物群落差异明显,本研究以高通量测序技术对两种大曲及其曲房空气微生物群落进行比较分析,初步明晰了空气微生物对大曲的微生物类群影响的变化规律,并以多元统计分析方法探究了环境因素对大曲微生物群落分布的影响。本研究在理论上阐释了传统制曲工艺“自然接种”这一工序,这对于制曲生产过程中定向接种功能微生物、调控环境参数以推动发酵演替都具有重要的指导意义。要进一步研究环境对大曲微生物群落结构的影响,应当更加细化大曲的不同发酵阶段做更深入地研究。因此,深入研究曲房空气微生物和不同品温大曲的微生物类群的关系对大曲生产和研究有重要参考价值。
