栽培种花生含油量QTL定位与上位性互作分析
2021-03-27张胜忠胡晓辉苗华荣杨伟强崔凤高邱俊兰陈四龙张建成陈静
张胜忠,胡晓辉,苗华荣,杨伟强,崔凤高,邱俊兰,陈四龙,张建成,陈静
(1.山东省花生研究所,山东 青岛 266100;2.威海种子管理站,山东 威海 264200;3.河北省农林科学院 粮油作物研究所,河北 石家庄 050035)
花生(ArachishypogaeaL. 2n=4X=40)是世界重要的油料和经济作物,是人类食用植物油的重要来源之一。当前栽培种花生的平均含油量为51.4%,依然存在很大的提升潜力[1]。据测算,花生榨油原料中含油量每提高1%,相当于产量提高2%,加工企业的效益则可提高7%以上[2]。因此,提高花生含油量,是花生遗传改良的重要目标。为了缩短育种进程,分子标记辅助育种(MAS,Marker assisted selection)已在多种作物、多种性状的改良方面得到应用[3-6]。花生含油量属数量性状,遗传基础复杂,且受环境影响较大[1,7-8],导致相关基因/QTL定位难度较大,MAS在改良花生含油量方面难以有效开展。因此,开展花生含油量相关位点的挖掘、开发连锁分子标记以及克隆相关基因显得尤为必要和迫切。
前人利用不同群体构建遗传图谱,对花生含油量基因位点进行了研究。Sarvamangala等[9]以TG26×GPBD4为材料构建的图谱包含45个SSR标记,检测出1个与含油量相关的主效QTL。Pandey等[10]通过构建的2个遗传图谱(分别包含206,378个标记位点),分别定位到6,9个含油量QTL,最大表型变异贡献率(PVE,Phenotypic variance explained)分别为10.23%,14.07%。Shasidhar等[11]基于ICGV 07368×ICGV 06420的F2群体,构建了包含854个位点的图谱,共定位到8个含油量QTL,包括2个主效位点qOc-A10(PVE=22.11%)和qOc-A02(PVE=10.37%)。Wilson等[12]利用91个SSR标记,对一个BC3F6群体进行含油量基因检测,共定位到3个QTL位点。Liu等[13]基于ddRAD-seq技术构建了包含2 595个位点的高密度遗传图谱,定位到7个含油量QTL,并且将其中的稳定主效位点qOCA08.1进一步缩小至0.8 Mb区间。另外,Selvaraj等[14]利用集群分离分析法(BSA,Bulk segregant analysis)对栽培种花生性状进行关联分析和QTL检测,发现了1个与种子含油量相关的QTL,贡献率为11.03%。黄莉等[15]通过对一个RIL群体和自然群体的含油量进行关联分析,鉴定到一个与花生含油量相关SSR标记。
随着花生栽培种狮头企、Tifrunner和伏花生的基因组序列陆续公布[16-18],以栽培种花生基因组为参考,进行相关基因/QTL定位、功能预测与分子标记开发,将更加准确和有效。目前定位到控制含油量的稳定主效QTL依然较少,可用于育种改良的位点不足,仍需要对含油量新位点进行挖掘。本研究以花育36号和高油品系6-13的181个F2∶7-F2∶8重组自交系为试验材料,开展多年份多地点进行QTL定位与互作分析,提高主效QTL的真实性,为花生高油分子辅助育种提供参考。
1 材料和方法
1.1 试验材料
以花育36号×6-13构建的重组自交系群体(F2∶7-F2∶8)为试验材料,该群体包含181个家系。母本花育36号为高产优质抗逆大花生品种;父本6-13为高油品系。
1.2 田间种植
2017年,将材料种植于海南省三亚市南滨农场(E1:N 18.65°,E 109.80°)。2018年,将材料种植于山东省东营市黄河三角洲现代农业试验示范基地(E2:N 37.46°,E 118.49°)和山东省莱西市试验农场(E3:N 36.86°,E 120.53°)。种植方式为起垄单行单粒覆膜播种,每个家系种植1行,每行种植10株,行距85 cm,株距15 cm,每隔20行种植一次亲本,每个家系均设置3次重复。田间水肥管理等同于常规大田,及时进行病虫害防治。成熟后及时收获晾晒,选择每行中间8株用于含油量检测。
1.3 含油量测定和数据处理
利用脂肪核磁共振分析仪(minispec mq one,Bruker Corporation)对群体各家系和亲本的干种子进行脂肪含量测定,每个家系至少测定3次重复,取平均值。利用SPSS软件(IBM®SPSS®statistics 19)获得群体含油量平均值、标准差、最小值、最大值、偏度、峰度,并进行正态分布检测和亲本显著性分析,利用QTL IciMapping V4.1[19]进行方差估算,用于广义遗传率计算。
广义遗传率计算公式:h2= σg2/(σg2+σge2/n+σε2/nr),其中h2代表广义遗传率,σg2代表基因型方差,σε2代表误差方差,σge2代表基因型与环境互作方差,n代表环境数,r代表单一环境下重复数。
1.4 QTL定位
利用该RIL群体构建的高密度SLAF-seq遗传图谱和表型数据,对含油量性状进行QTL定位分析。遗传图谱基于栽培种花生基因组序列构建,共包含3 866个SNP和SSR标记,覆盖20个连锁群,总图距1 266.87 cM[20]。利用R/qtl软件包[21],采用复合区间CIM方法检测不同环境下的QTL,通过CIM区间作图法定位性状,用PT检验1 000次进行设定阈值,首先考虑0.95置信度对应的LOD阈值,若没有结果则手动降低阈值到2.5。加性效应的正和负,代表增效等位基因分别来自6-13和花育36号。利用QTL IciMapping V4.1检测多环境下的上位性QTL,LOD大于5.0作为存在阈值,相关定位参数Step=1 cM,PIN=0.000 1。QTL的命名规则为QTL+性状(OC,Oil content;e,Epistatic)+染色体数+同一染色体上QTL次序。
1.5 基因功能注释
参考花生栽培种Tifrunner序列(https://peanutbase.org),确定主效QTL的侧翼标记物理位置。基于BlastX算法,将定位区间序列与UniProt数据库中的Nr(Nr,Nonredundent)蛋白序列进行比对,将比对得到的基因进行GO(GO,Gene ontology)分析[22]。
2 结果与分析
2.1 亲本和群体含油量表型分析
对不同环境下花生亲本和RIL群体含油量进行测定,发现母本花育36号平均含油量为(51.50±1.53)%,父本6-13平均含油量为(59.10±1.30)%,亲本间的含油量存在显著差异(图1、表1)。3个环境下(E1、E2、E3)RIL群体含油量变幅分别为43.18%~61.33%,46.70%~61.39%,45.83%~59.62%,存在超亲遗传。次数分布图均呈现连续单峰分布(图1),同时K-S测验表明符合正态分布,含油量的广义遗传率为0.55 (表1)。以上结果表明,含油量满足数量性状遗传特点,符合QTL定位的基本要求。

表1 亲本和RIL群体含油量表型统计分析Tab.1 Statistics of oil content in parents and the RIL population
2.2 基于RIL群体定位含油量相关QTL
利用该RIL群体构建的高密度SLAF-seq遗传图谱[19]和表型数据,对含油量性状进行QTL定位分析。由图2和表2所示,在E1、E2、E3环境下共定位到5个QTL,分布于第6,8,15,17染色体上,LOD值为2.85~4.67,表型贡献率变幅为7.39%~17.67%。在环境E1(2017SY),分别在第6,8染色体检测到2个QTL,qOC6和qOC8.1,表型贡献率为17.67%和9.17%。在环境E2(2018DY),共检测到3个位点,qOC8.2、qOC15和qOC17,表型贡献率分别为8.83%,16.53%和7.39%。在环境E3(2018LX),共检测到1个位点qOC15,表型贡献率为17.39%。其中qOC15在E2和E3环境下均可表达,覆盖约2.8 Mb基因组区间,该位点对含油量影响较大且稳定,可作为含油量育种和分子克隆的研究重点。qOC8.1和qOC8.2均位于第8染色体,表型贡献率为9.17%,8.83%,相距约30 Mb。加性效应绝对值变幅0.50~1.17,其中qOC6和qOC17的增效等位基因来自于母本花育36号,qOC8.1、qOC8.2、qOC15的增效等位基因来自于父本6-13。

表2 多环境下含油量性状相关QTL定位Tab.2 QTL identification for oil content in different environments
由图2和表3所示,基于3个环境表型数据共检测到21对存在上位性互作的QTL,分布于第1,3,5,7,8,9,10,12,13,14,15,16,17,18,19,20染色体,LOD值为5.01~8.22,上位性效应对表型贡献率变幅为1.24%~3.54%,其中,qOCe3.1与qOCe5.3之间的互作效应对表型变异贡献率最小,为1.24%;qOCe10与qOCe20之间的互作对表型变异贡献率最大,为3.54%;qOCe5.4与qOCe9.2之间的上位性效应最小,为-0.45;qOCe10与qOCe20之间的上位性效应最大,为-0.94。上位性QTL与环境互作效应在不同环境下各不相同,对表型变异的贡献率变幅为0~1.67%。这21对上位性QTL共涉及16条染色体上30个位点,其中qOCe5.3、qOCe14、qOCe17.2、qOCe18.1、qOCe20分别与2,2,2,6,5个位点存在上位性互作,其他位点仅检测到1个相应互作位点。另外,发现位点qOCe8.3(Marker4924~Marker4928)与加性位点qOC8.2(Marker4912~Marker4928)存在重叠,表明该标记区间内基因可能不仅直接影响种子含油量,也可能与基因组其他位点互作来调控种子含油量。
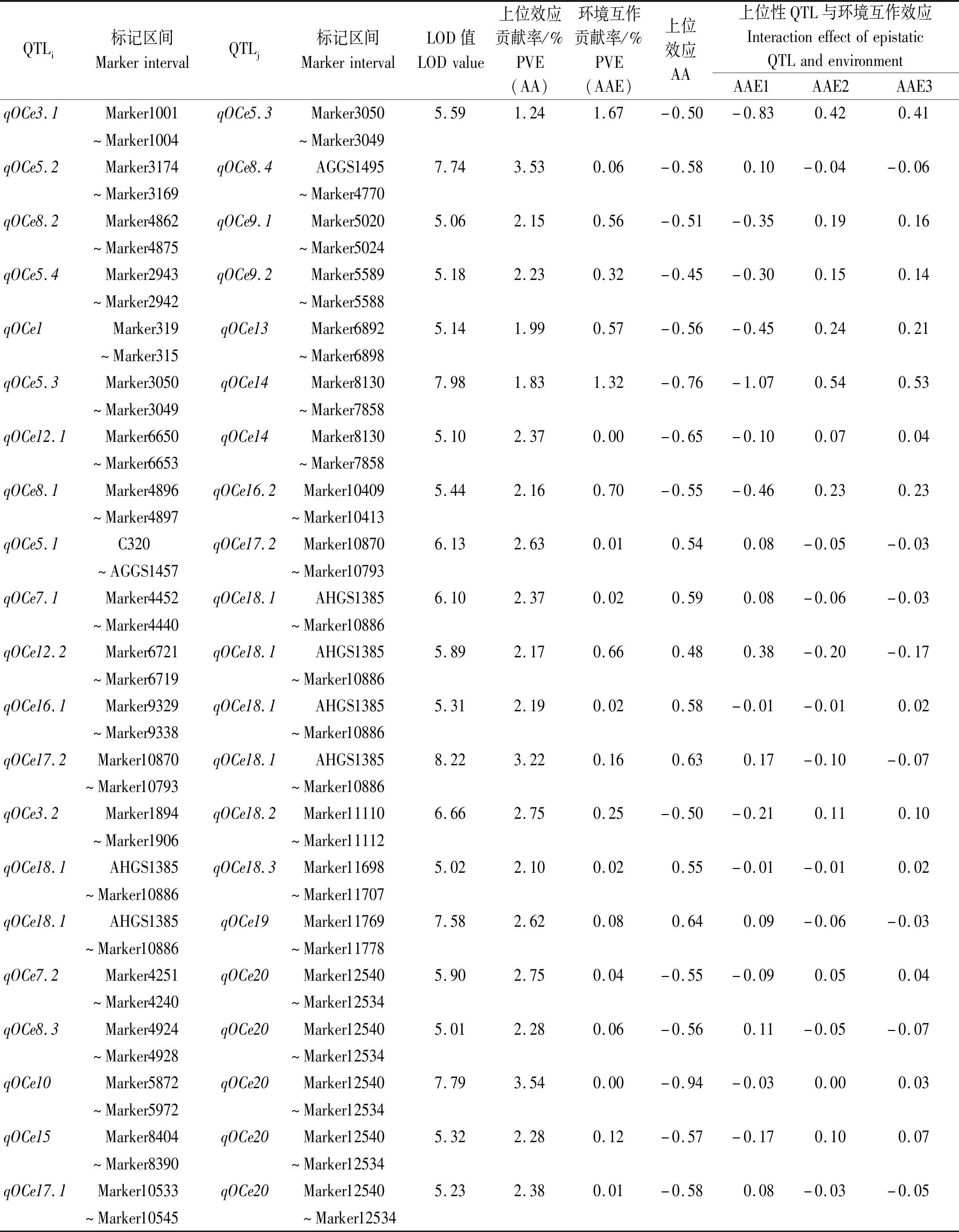
表3 基于RIL群体的含油量性状上位性QTL分析Tab.3 Identification of epistatic QTL related to oil content with the RIL population
2.3 含油量主效位点qOC15的基因注释
参考栽培种基因组确定qOC15侧翼标记的物理位置(表2)。通过将该区段序列与Nr数据库进行比对,预测候选基因的功能,共发现97个潜在候选基因。通过GO分析,发现这些基因的细胞组分分类主要为细胞组分(Cell part)和细胞(Cell);分子功能分类主要为催化活性(Catalytic activity)和结合活性(Binding);生物途径分类主要为代谢过程(Metabolic process)和细胞过程(Cellular process),可见这些基因主要参与细胞内相关催化反应和代谢途径(图3)。根据GO分析结果,发现候选基因Arahy.W2PYYJ和Arahy.0GQ7VV分别编码类絮凝蛋白(Flocculation protein)和假定蛋白(Hypothetical protein),可能分别参与脂质的转运和代谢;候选基因Arahy.8MB6Y9和Arahy.E792FE分别编码长链酰基辅酶A合成酶6(Long chain acyl-CoA synthetase 6)和过氧化物酶体脂肪酸β-氧化多功能蛋白(Peroxisomal fatty acid beta-oxidation multifunctional protein),可能分别参与脂肪酸的合成途径和β-氧化过程(表4)。

表4 候选基因功能预测和分析Tab.4 Functional analysis of the candidate genes
3 讨论
重组自交系群体是一种重要的遗传定位群体,以其稳定和相对丰富的遗传基础,广泛应用于花生等作物重要性状基因/QTL的定位[23-26]。已有研究表明,含油量遗传基础复杂,利用不同组合、不同世代的材料分析含油量遗传规律,结论可能不同。陈四龙等[8]利用不同亲本组合的F2群体对含油量进行遗传分析,发现有的组合符合主基因+多基因遗传特征,有的组合符合多基因遗传特征。禹山林等和廖伯寿等[1,7]分别利用不同杂交组合,发现含油量受主基因+多基因控制,但是基因的效应类型、大小不同。利用花育36号与6-13构建了一个重组自交系群体,共包含181个家系。父本6-13含油量为59.10%,母本花育36号为51.50%,两亲本含油量存在较大差异。对该RIL群体(F2∶6)的含油量性状进行遗传分析,发现群体含油量符合2对主基因+多基因遗传模型[27]。本研究发现RIL群体各家系含油量在不同环境(E1、E2、E3)、不同世代(F2∶7、F2∶8)下变化趋势一致,呈近似正态分布,且存在超亲遗传,有利于对稳定含油量QTL的检测。
本研究在3个环境下共检测到5个含油量相关位点,表型贡献率为7.39%~17.67%,其中有2个主效位点(qOC6和qOC15),与遗传分析预测结果一致[27]。本研究中含油量广义遗传率为0.55,表明含油量受环境影响较大,导致不同环境QTL定位结果存在较大差异,其中E1环境下检测到2个位点,环境E2定位到3个位点,而E3环境下仅检测到1个位点。这些QTL中,仅主效位点qOC15可在2个环境(E2、E3)下稳定表达,而其他位点的表达均受特定环境的影响。在E1和E2环境下,在第8染色体上共检测到2个位点,qOC8.1和qOC8.2,两者相距约30 Mb。Liu等[13,17]前期利用徐花13号×中花6号的RIL群体在第8染色体定位到一个稳定主效位点qOCA08.1,其物理位置(参考Tifrunner基因组)为42.21~44.53 Mb,与qOC8.2的相距较近。由于qOC8.2仅在一个环境下被检测到,两者是否为同一位点,有待进一步确认。Pandey等和Shasidhar等[10-11]分别在A6、A8、B7和A8连锁群也检测到含油量相关位点,由于缺乏共有标记或是无法确定这些位点侧翼标记的物理位置,因而难以与本研究结果进行比较分析。此外,Liu等[13]第15染色体上定位到2个相邻QTL,qOCB5.1和qOCB5.2,其物理位置分别为7.89~8.82,9.73~10.58 Mb[17],与本研究中的qOC15(18.52~21.36 Mb)相隔约8 Mb。因此,qOC15可能是控制含油量的新位点,可通过开发相关分子标记辅助花生含油量性状改良。
对qOC15区间内基因进行注释,发现大多数基因参与细胞内相关催化反应和代谢途径。前人研究表明,植物体内油脂含量受多种途径调控,包括油脂合成途径、降解途径和运输途径,而这些过程受到具有不同催化性质的酶类的调节,包括合成酶、连接酶、脱氢酶、酰基转移酶等[28-32]。本研究在qOC15区间发现了4个潜在的候选基因,Arahy.W2PYYJ、Arahy.0GQ7VV、Arahy.8MB6Y9和Arahy.E792FE,GO分析推测这些基因分别参与脂质的转运、代谢与脂肪酸的合成和降解。这些候选基因分子生物学功能以及对含油量的影响,有待后续研究验证。
上位性互作是数量性状遗传的重要方面,对解析复杂性状的遗传基础具有十分重要的意义[33-34]。前人研究发现,QTL上位性互作包括3种类型:主效应QTL之间互作(类型Ⅰ);主效应QTL与背景位点间互作(类型Ⅱ);互补位点间互作(类型Ⅲ),3种类型的上位性互作,可能与基因间的调控网络有关[35-36]。例如大豆中I位点和K1位点存在上位性互作,主要是K1位点的功能基因,可通过影响小RNA来调控I位点功能基因的表达,进而影响大豆种皮颜色[37]。本研究共检测到21对上位性互作,其中5个标记区间与其他至少2个位点存在上位性互作,表明花生含油量遗传存在复杂的分子调控网络。其中多数上位性QTL互作属于类型Ⅲ,即无单独个体效应的QTL间的互作。而由于qOCe8.3(Marker4924~Marker4928)与主效应位点qOC8.2(Marker4924~Marker4928)区间存在重叠,qOCe8.3参与的互作应属于类型Ⅱ,表明该区间功能基因不仅可能直接影响种子含油量,也可能与其他位点互作来调控含油量。因此,在花生含油量育种中,既要考虑聚合主效QTL的作用,也要考虑上位性QTL互作对含油量的影响。
本研究基于RIL群体多环境下含油量数据,鉴定了5个花生含油量相关的主效应QTL和21对上位性位点,明确了不同遗传效应对含油量的影响,并对一个稳定主效位点qOC15进行了候选基因功能注释,鉴定了4个可能参与油脂合成、代谢和转运的候选基因,为花生后续含油量分子育种和功能研究提供了重要基础。
