2-(4-(1,2,4-三唑)-苯氧基乙酰腙衍生物的合成与生物活性初探
2021-03-27林立文赵紫微陈秋燕梁雨秋邓先清
罗 辉,林立文,赵紫微,陈秋燕,梁雨秋,邓先清
2-(4-(1,2,4-三唑)-苯氧基乙酰腙衍生物的合成与生物活性初探
罗 辉,林立文,赵紫微,陈秋燕,梁雨秋,*邓先清
(井冈山大学医学部,江西,吉安 343009)
以对氨基酚为起始原料合成了一系列2-(4-(1,2,4-三唑)-苯氧基乙酰腙衍生物(5a-5o)。通过核磁共振氢谱和碳谱确证了目标化合物的结构,采用最大电惊厥实验(MES)和皮下注射戊四唑实验(PTZ)筛选其抗癫痫活性,采用旋转棒法评价其神经毒性,采用脂多糖(LPS)诱导TNF-α释放模型评价了化合物的体外抗炎活性。研究结果显示部分化合物显示出中等偏弱的抗MES活性和抗PTZ活性,所有化合物在300 mg/kg剂量下均未表现出神经毒性。此外,化合物5a-5h和5k-5m均表现出明显的抗炎活性,20 μg/mL剂量下可以显著抑制LPS诱导的TNF-α浓度的升高。本研究报道的2-(4-(1,2,4-三唑)-苯氧基乙酰腙衍生物的抗癫痫活性虽然未达到预期强度,但也为后续三唑类抗癫痫药物的设计提供了一定指导,该系列化合物在细胞炎症模型中的突出表现丰富了三氮唑类化合物在抗炎研究中的应用,为后续抗炎药物的研究开发提供了实验依据。
三氮唑;酰腙;抗癫痫;抗炎;TNF-α
癫痫是多种原因引起脑部神经元群阵发性异常放电所致的发作性运动、感觉、意识、精神、植物神经功能异常的一种疾病,也是一种反复性突然发作的脑功能短暂异常疾病。临床表现有大发作、小发作、失神发作、局限性和混合性发作等类型。据世界卫生组织统计,现今全球大概有5000万的癫痫患者,而我国有近1000万的癫痫患者,每年新增癫痫患者约50万人[1]。现有药物可以控制70%左右患者的癫痫发作,但仅仅是抑制发作,并不能完全治愈,需要长期服药(半年以上甚至终身),因而带来了严重的耐药性和毒副作用的问题[2], 癫痫患者的生存质量明显下降,同时也给家庭和社会增加了大量的心理和经济负担[3]。因此,开发新的具有广谱、强效、毒副作用小的新型抗癫痫药物(AEDs)仍然是癫痫治疗的重要方向。
三氮唑是一种富氮芳香杂环,三氮唑衍生物显示出广泛的生物活性,在农药和医药领域具有良好的应用前景。三氮唑类药物是临床的常用药物,在抗结核、抗癌、抗菌、抗病毒、抗炎镇痛、抗癫痫等方面优势明显,显示出低毒性、高活性和药物靶向性强等特点[4-8]。近年来,通过对三氮唑类衍生物进行结构修饰,如1位氮原子上基团的空间位阻、4位氮原子的裸露、三氮唑与其他芳环的稠合或者链接等的改造,并对所合成的三氮唑化合物进行抗癫痫活性的筛选,丰富了三氮唑类化合物抗癫痫活性的构效关系,得到一些药理性质优于临床药物的备选化合物,这一过程为开发出新抗癫痫药物奠定了基础[9]。在前期研究中,我们发现1,2,4-三氮唑与苯环直接以单键连接获得三唑-苯基片段是一个良好的抗癫痫活性片段[10-11]。为了继续探究三唑-苯基片段在抗癫痫药物发现中的价值,获得更多抗癫痫活性骨架和活性候选物,我们基于三唑-苯基片段,将酰腙结构与其连接,设计合成了一系列新的三氮唑衍生物。采用最大电休克发作实验和皮下戊四唑实验进行抗癫痫活性评价。酰腙是一类酰肼与羰基化合物缩合而成的结构片段,其结构中含有酰胺和席夫碱,后两者在抗癫痫药物设计中也被广泛应用[12-13],因此期望该设计可以获得更好的抗癫痫活性。此外,基于三氮唑和酰腙结构在抗炎药物中的广泛报道[14-15],我们还对目标化合物的抗炎活性进行了筛选。
1 实验部分
1.1 仪器与试剂
核磁共振分析采用BURKER AV-300 型核磁共振仪(Bruker, Switzerland),四甲基硅(TMS)为内标,溶剂使用CDCl3或DMSO-d;熔点采用毛细管法测定(温度计未经校正)。实验所用试剂包括对氨基苯酚(98%,麦克林试剂公司)、甲酰肼(99%,麦克林试剂公司)、-二甲基甲酰胺二甲基缩醛 (97%,麦克林试剂公司),氯乙酸乙酯 (98%,麦克林试剂公司)、苯乙酮(98%,阿拉丁试剂公司)、苯甲醛 (98%,阿拉丁试剂公司)、水合肼(80%,上海化学试剂厂),其他常规溶剂(分析纯,麦克林试剂有限公司和上海化学试剂厂)。
1.2 化合物合成
1.2.1 4-(4-1,2,4-三唑-4-基)苯酚(2)的合成
在含有30 mL乙腈的圆底烧瓶中依次加入甲酰肼(0.58 g,10 mmol),DMF-DMA(1.19 g,10 mmol),60 ℃搅拌30 min后加入对氨基酚(1.09 g,10 mmol)和6 mL乙酸,升温至120 ℃反应约10 h(TLC跟踪,展开剂:V二氯甲烷/甲醇=15:1)。浓缩至一半溶剂,冷却,抽滤,少量乙腈洗涤,干燥得到化合物2。
1.2.2 2-(4-(4-1,2,4-三唑-4-基)苯酚)乙酸乙酯(3)的合成
在含有30 mL乙腈的圆底烧瓶中依次加入化合物2 (0.64 g,4 mmol),氯乙酸乙酯(0.98 g,8 mmol),粉末状KOH(0.67 g,12 mmol)。 90 ºC下搅拌回流8 h(TLC跟踪,展开剂:V二氯甲烷/甲醇=15:1)。减压蒸干溶剂,加入20 mL水,抽滤,干燥,得到化合物3。
1.2.3 2-(4-(4-1,2,4-三唑-4-基)苯氧基)乙酰肼(4)的合成
将化合物3(4.00 g,16 mmol)和15 mL水合肼 (80%) 混合后,在120 ºC下搅拌反应约3 h(TLC跟踪,展开剂:V二氯甲烷/甲醇=15:1)。冷却,抽滤,乙醇重结晶得化合物4。
1.2.4 2-(4-(4-1,2,4-三唑-4-基)苯氧基)-N'-苯亚甲/乙基乙酰肼(5a-5o)的合成
以化合物5a为例:在50 mL圆底烧瓶中依次加入化合物4 (0.50 g,2 mmol),苯甲醛(0.23 g,2 mmol),6滴醋酸和20 mL乙醇。加毕于室温搅拌5 h(TLC跟踪,展开剂:V二氯甲烷/甲醇=15:1)。浓缩部分溶剂,冷却,抽滤,乙醇重结晶得化合物5a。相同条件下,用其他取代苯甲醛制备得到化合物5b-5j,用其他取代基苯乙酮制备得到化合物5l-5o。化合物的理化性质和波谱数据如下:
2-(4-(4-1,2,4-三唑-4-基)苯氧基)--苯亚甲基乙酰肼 (5a):
熔点205~207℃, 产率48 %。1H-NMR (DMSO-6, 400MHz):5.24 (s, 2H, OCH2), 7.12 (d, 2H,= 8.8 Hz, Ph-H), 7.43-7.45 (m,3H, Ph-H), 7.59 (d, 2H,= 8.8 Hz, Ph-H), 7.70-7.74 (m,2H, Ph-H), 8.03 (s, 1H, N=CH),9.01 (s, 2H, Triazole-H), 11.68 (s, 1H, CONH).13C-NMR (DMSO-6,100MHz):169.26, 158.33, 144.39, 142.11, 134.42, 130.46, 129.27, 127.61, 127.43, 123.39, 116.11, 65.50。
2-(4-(4-1,2,4-三唑-4-基)苯氧基)--(2-氟苯亚甲基)乙酰肼 (5b):
熔点 150~152℃, 产率 51 %。1H-NMR (DMSO-6, 400MHz):5.25 (s, 2H, OCH2), 7.13 (d, 2H,= 8.8 Hz, Ph-H), 7.27-7.50 (m, 4H, Ph-H), 7.59 (d, 2H,= 8.8 Hz, Ph-H), 8.24 (s, 1H, N=CH), 9.01 (s, 2H, Triazole-H), 11.76 (s, 1H, CONH).13C-NMR (DMSO-6,100MHz):169.39, 161.14(d,1c-f= 248.3 Hz), 158.29, 142.12, 137.23, 132.40 (d,3c-f= 8.4 Hz), 127.79, 125.38, 125.35, 123.39, 122.02, 121.92, 116.22 (d,2c-f= 21.7 Hz), 65.47。
2-(4-(4-1,2,4-三唑-4-基)苯氧基)--(3-氟苯亚甲基)乙酰肼 (5c):
熔点216~219℃, 产率36 %。1H-NMR (DMSO-6, 400MHz):5.26 (s, 2H, OCH2), 7.13 (d, 2H,= 8.8 Hz, Ph-H), 7.26-7.62 (m,6H, Ph-H), 8.03 (s, 1H, N=CH),9.02 (s, 2H, Triazole-H), 11.75 (s, 1H, CONH).13C-NMR (DMSO-6,100MHz):168.43, 161.83 (d,1c-f= 242.0 Hz), 157.25, 141.90, 141.04, 127.17, 126.71, 122.95, 122.32 (d,3c-f= 5.8 Hz), 116.11 (d,2c-f= 21.3 Hz), 115.23, 115.07, 112.23 (d,2c-f= 22.4 Hz), 64.46。
2-(4-(4-1,2,4-三唑-4-基)苯氧基)--(4-氟苯亚甲基)乙酰肼 (5d):
熔点202~204℃, 产率65 %。1H-NMR (DMSO-6, 400MHz):5.24 (s, 2H, OCH2), 7.12 (d, 2H,= 8.8 Hz, Ph-H), 7.27-7.32 (m,2H, Ph-H), 7.59 (d, 2H,= 8.8 Hz, Ph-H), 7.75-7.82 (m,2H, Ph-H), 8.02 (s, 1H, N=CH),9.02 (s, 2H, Triazole-H), 11.66 (s, 1H, CONH).13C-NMR (DMSO-6,100MHz):169.28, 163.38 (d,1c-f= 219.1 Hz), 158.31, 147.34, 143.22, 142.12, 142.06, 129.63 (d,3c-f= 8.5 Hz), 127.76, 123.40 (d,4c-f= 4.3 Hz), 116.19 (d,2c-f= 18.8 Hz), 65.48。
2-(4-(4-1,2,4-三唑-4-基)苯氧基)--(2-氯苯亚甲基)乙酰肼 (5e):
熔点106~109 ℃, 产率66 %。1H-NMR (DMSO-6, 400MHz):5.27 (s, 2H, OCH2), 7.13 (d, 2H,= 8.8 Hz, Ph-H), 7.43-7.55 (m,4H, Ph-H), 7.59 (d, 2H,= 8.8 Hz, Ph-H), 8.42 (s, 1H, N=CH),9.02 (s, 2H, Triazole-H), 11.83 (s, 1H, CONH).13C-NMR (DMSO-6,100MHz):169.46, 158.28, 144.36, 142.12, 140.38, 133.44, 131.88, 131.68, 130.35, 128.05, 127.55, 123.37, 116.12, 65.51。
2-(4-(4-1,2,4-三唑-4-基)苯氧基)--(3-氯苯亚甲基)乙酰肼 (5f):
熔点 225~226℃, 产率 71.4 %。1H-NMR (DMSO-6, 400MHz):5.26 (s, 2H, OCH2), 7.13 (d, 2H,= 8.8 Hz, Ph-H), 7.47-7.49 (m, 2H, Ph-H), 7.59 (d, 2H,= 8.8 Hz, Ph-H), 7.66-7.81 (m, 2H, Ph-H), 8.01 (s, 1H, N=CH), 9.01 (s, 2H, Triazole-H), 11.73 (s, 1H, CONH).13C-NMR (DMSO-6,100MHz):168.44, 157.23, 141.67, 141.03, 135.59, 133.06, 130.06, 129.02, 126.69, 125.53, 125.27, 122.26, 115.05, 64.46。
2-(4-(4-1,2,4-三唑-4-基)苯氧基)--(4-氯苯亚甲基)乙酰肼 (5g):
熔点 233~235℃, 产率 70.1%。1H-NMR (DMSO-6, 400MHz):5.24 (s, 2H, OCH2), 7.12 (d, 2H,= 9.0 Hz, Ph-H), 7.51 (d, 2H,= 8.5 Hz, Ph-H), 7.59 (d, 2H,= 9.0 Hz, Ph-H), 7.76 (d, 2H,= 8.5 Hz, Ph-H), 8.02 (s, 1H, N=CH), 9.02 (s, 2H, Triazole-H), 11.72 (s, 1H, CONH).13C-NMR (DMSO-6,100MHz):169.35, 158.30, 143.08, 142.12, 134.88, 133.38, 129.35, 129.10, 127.77, 123.37, 116.11, 65.47。
2-(4-(4-1,2,4-三唑-4-基)苯氧基)--(4-溴苯亚甲基)乙酰肼 (5h):
熔点 243~245℃, 产率 70 %。1H-NMR (DMSO-6, 400MHz):5.24 (s, 2H, OCH2), 7.12 (d, 2H,= 8.8 Hz, Ph-H), 7.59 (d, 2H,= 8.8 Hz, Ph-H), 7.65 (d, 2H,= 8.4 Hz, Ph-H), 7.69 (d, 2H,= 8.4 Hz, Ph-H), 8.00 (s, 1H, N=CH), 9.02 (s, 2H, Triazole-H), 11.71 (s, 1H, CONH).13C-NMR (DMSO-6,100MHz):169.36, 158.29, 147.21, 143.19, 142.12, 133.72, 132.25, 129.33, 127.77, 123.37, 116.11, 65.47。
2-(4-(4-1,2,4-三唑-4-基)苯氧基)--(4-甲基苯亚甲基)乙酰肼 (5i ):
熔点220~223℃, 产率47 %。1H-NMR (DMSO-6, 400MHz):2.34 (s, 3H, Ph-CH3), 5.23 (s, 2H, OCH2), 7.12 (d, 2H,= 8.8 Hz, Ph-H), 7.26 (d, 2H,= 8.0 Hz, Ph-H), 7.58-7.66 (m, 4H, Ph-H), 7.99 (s, 1H, N=CH), 9.02 (s, 2H, Triazole-H), 11.59 (s, 1H, CONH).13C-NMR (DMSO-6,100MHz):169.15, 158.33, 144.48, 142.12, 140.26, 131.71, 129.87, 127.60, 127.41, 123.38, 116.10, 65.47, 21.51。
2-(4-(4-1,2,4-三唑-4-基)苯氧基)--(4-甲氧基苯亚甲基)乙酰肼 (5j):
熔点 188~191℃, 产率 63 %。1H-NMR (DMSO-6, 400MHz):3.80 (s, 3H, Ph-OCH3), 5.21 (s, 2H, OCH2), 7.00 (d, 2H,= 8.8 Hz, Ph-H), 7.11 (d, 2H,= 8.8 Hz, Ph-H), 7.59 (d, 2H,= 8.8 Hz, Ph-H), 7.67 (d, 2H,= 8.8 Hz, Ph-H), 7.97 (s, 1H, N=CH), 9.01 (s, 2H, Triazole-H), 11.52 (s, 1H, CONH).13C-NMR (DMSO-6,100MHz):169.01, 161.20, 158.35, 144.26, 142.12, 129.03, 127.74, 127.01, 123.38, 116.08, 114.75, 65.47, 55.77。
2-(4-(4-1,2,4-三唑-4-基)苯氧基)--(1-苯亚乙基)乙酰肼 (5k):
熔点 214~216℃, 产率 48.8 %。1H-NMR (DMSO-6, 400MHz):2.28 (s, 3H, CH3), 5.27 (s, 2H, OCH2), 7.11 (d, 2H,= 8.8 Hz, Ph-H), 7.41-7.44 (m, 3H, Ph-H), 7.59 (d, 2H,= 8.8 Hz, Ph-H), 7.82-7.84 (m, 2H, Ph-H), 9.01 (s, 2H, Triazole-H), 10.91 (s, 1H, CONH).13C-NMR (DMSO-6,100MHz):170.12, 158.37, 148.91, 142.12, 138.42, 129.66, 128.85, 127.70, 126.69, 123.37, 116.07, 65.89, 14.04。
2-(4-(4-1,2,4-三唑-4-基)苯氧基)--(1-(4-氟苯亚乙基)乙酰肼 (5l):
熔点 205~207℃, 产率 64 %。1H-NMR (DMSO-6, 400MHz):2.28 (s, 3H, CH3), 5.27 (s, 2H, OCH2), 7.11 (d, 2H,= 8.9 Hz, Ph-H), 7.23-7.27 (m, 2H, Ph-H), 7.59 (d, 2H,= 8.9 Hz, Ph-H), 7.87-7.90 (m, 2H, Ph-H), 9.00 (s, 2H, Triazole-H), 10.90 (s, 1H, CONH).13C-NMR (DMSO-6,100MHz):170.11, 163.24 (d,1c-f= 245.0 Hz), 158.38, 147.98, 142.10, 134.93, 128.94 (d,3c-f= 8.2 Hz), 127.72, 123.37, 116.10, 115.70 (d,2c-f= 21.5 Hz), 65.91, 14.07。
2-(4-(4-1,2,4-三唑-4-基)苯氧基)--(1-(4-氯苯亚乙基)乙酰肼 (5m):
熔点210~212℃, 产率53 %。1H-NMR (DMSO-6, 400MHz):2.27 (s, 3H, CH3), 5.27 (s, 2H, OCH2), 7.11 (d, 2H, J = 8.8 Hz, Ph-H), 7.48 (d, 2H,= 8.4 Hz, Ph-H), 7.58 (d, 2H,= 8.8 Hz, Ph-H), 7.85 (d, 2H,= 8.4 Hz, Ph-H),9.00 (s, 2H, Triazole-H), 10.94 (s, 1H, CONH).13C-NMR (DMSO-6,100MHz):169.11, 157.27, 146.66, 141.04, 136.18, 133.28, 127.77, 127.41, 126.63, 122.28, 115.00, 64.80, 12.85。
2-(4-(4-1,2,4-三唑-4-基)苯氧基)--(1-(4-甲基苯亚乙基)乙酰肼 (5n):
熔点 193-194℃, 产率 64 %。1H-NMR (DMSO-6, 400MHz):2.25 (s, 3H, N=CCH3), 2.33 (s, 3H, Ph-CH3), 5.25 (s, 2H, OCH2), 7.10 (d, 2H,= 8.5 Hz, Ph-H), 7.22 (d, 2H,= 8.0 Hz, Ph-H), 7.58 (d, 2H,= 8.5 Hz, Ph-H), 7.72 (d, 2H,= 8.0 Hz, Ph-H), 9.00 (s, 2H, Triazole-H), 10.83 (s, 1H, CONH).13C-NMR (DMSO-6,100MHz):170.01, 158.41, 149.00, 142.10, 139.25, 135.69, 129.42, 127.72, 126.61, 123.39, 116.09, 65.93, 21.29, 13.97。
2-(4-(4-1,2,4-三唑-4-基)苯氧基)--(1-(4-甲氧基苯亚乙基)乙酰肼 (5o):
熔点 225~228 ℃,产率 76.3 %。1H-NMR (DMSO-6, 400MHz):2.24 (s, 3H, N=CCH3), 3.79 (s, 3H, OCH3), 5.25 (s, 2H, OCH2), 6.97 (d, 2H,= 8.9 Hz, Ph-H), 7.10 (d, 2H,= 8.8 Hz, Ph-H), 7.58 (d, 2H,= 8.8 Hz, Ph-H), 7.78 (d, 2H,= 8.9 Hz, Ph-H), 9.00 (s, 2H, Triazole-H), 10.78 (s, 1H, CONH).13C-NMR (DMSO-6,100MHz):169.90, 160.65, 158.41, 148.79, 142.11, 130.94, 130.89, 128.15, 123.38, 116.08, 114.19, 65.91, 55.71, 13.91。
1.3 化合物抗惊厥活性及神经毒性评价
按照美国NIH的抗癫痫药物开发方案,采用最大电惊厥模型和皮下戊四唑模型评价目标化合物的抗癫痫活性,旋转棒法评价目标化合物的神经毒性[16-17]。实验动物采用昆明种小鼠(湖南斯莱克景达实验动物有限公司提供,许可证号:SCXK(湘)2016-0003),体重(18~22) g,雌雄均可。实验前3 d饲养于23~27 ℃、相对湿度45%~65% 的实验室中,实验时间以外可以自由采食和饮水。测试化合物均用DMSO溶解,以0.05 mL/20 g容积腹腔注射,评价化合物在300、100、30 mg/kg三个剂下的抗癫痫活性和神经毒性。活性观测时间为给药后0.5 h。
最大电休克发作实验(MES):使用110 V,60 Hz的交流电,小鼠耳电极通电0.3 s,出现后肢强直的视为惊厥。正式实验前一天预筛小鼠,出现惊厥的小鼠用于正式实验。腹腔给药后0.5 h对小鼠进行电刺激,观察药物的抗电诱导惊厥活性而不出现后肢强直,视为化合物在该剂量下有效。
皮下戊四唑实验(-PTZ):小鼠给药后0.5 h皮下给予85 mg/kg的戊四唑(该剂量可以使97%以上的小鼠产生连续5 s的阵挛性惊厥),小鼠单独放置在鼠笼中观察30 min,以没有出现连续5 s以上的阵挛性惊厥为有效,认为该化合物可以对抗由戊四唑诱导的惊厥。
神经毒性实验:神经毒性实验采用旋转棒法,于给药0.5 h后将小鼠置于直径1英寸、转速为6 r/min的木棒上,在连续3次的测试中小鼠均不能在木棒保持1 min而掉下视为有神经毒性,反之则无神经毒性。
1.4 细胞培养与ELISA实验(TNF-α浓度测定)
小鼠RAW264.7 巨噬细胞(北京协和细胞库,北京)用添加了10% FBS(BI生物有限公司,批号:1552680)、100 U/mL青霉素和100 μg/mL链霉素混合液(索莱宝科技有限公司,批号:20160909)的RPMI 1640 完全高糖培养基 (杭州四季青生物工程有限公司,批号:170504)于37oC 5% CO2恒温培养箱中培养。每24 h更换培养基,细胞生长至 90%传代。待细胞传至3代,状态稳定后,用于实验。将细胞接种到24孔板中,培养24 h后,药物组加入20 μg/mL的化合物或阳性药地塞米松(DXMS)预处理4 h,然后加入LPS (Sigma Chemical Co., St. Louis, MO, USA) (1 μg/mL)培养24 h。收集培养液,1000 rpm离心10 min后取上清液,使用小鼠TNF-α ELISA试剂盒(San diego, CA, USA)检测TNF-α浓度水平。
2 结果与讨论
2.1 合成部分
本实验以以对氨基酚为起始原料,与甲酰肼和DMF-DMA发生环合反应,得到4-(4-1,2,4-三唑-4-基)苯酚(2),然后与氯乙酸乙酯在氢氧化钾催化下进行取代反应得到取代乙酸乙酯(3),化合物3在水合肼中进行氨解反应得到酰肼(4),最后与芳香醛(酮)缩合得到目标化合物5a-5o。并目标化合物结构通过核磁共振氢谱和碳谱来进行确证。结构解析以化合物5a为例:在1H-NMR 中,5.24处的单峰为乙酰基上CH2的吸收峰,7.12和7.59处的双重峰为对位取代苯环上的质子吸收峰,7.43-7.45范围和7.70-7.74 范围的两处多重峰则是末端苯环上的5个质子的吸收峰,8.03处的单峰为席夫碱上的质子信号,9.01和13.68位置的两个单峰则分别为三氮唑和酰胺上的质子吸收峰。13C NMR谱也准确的给出了该化合物结构的各种信息,恰好是12种不同化学环境的碳。结合氢谱和碳谱可以确证其分子结构。
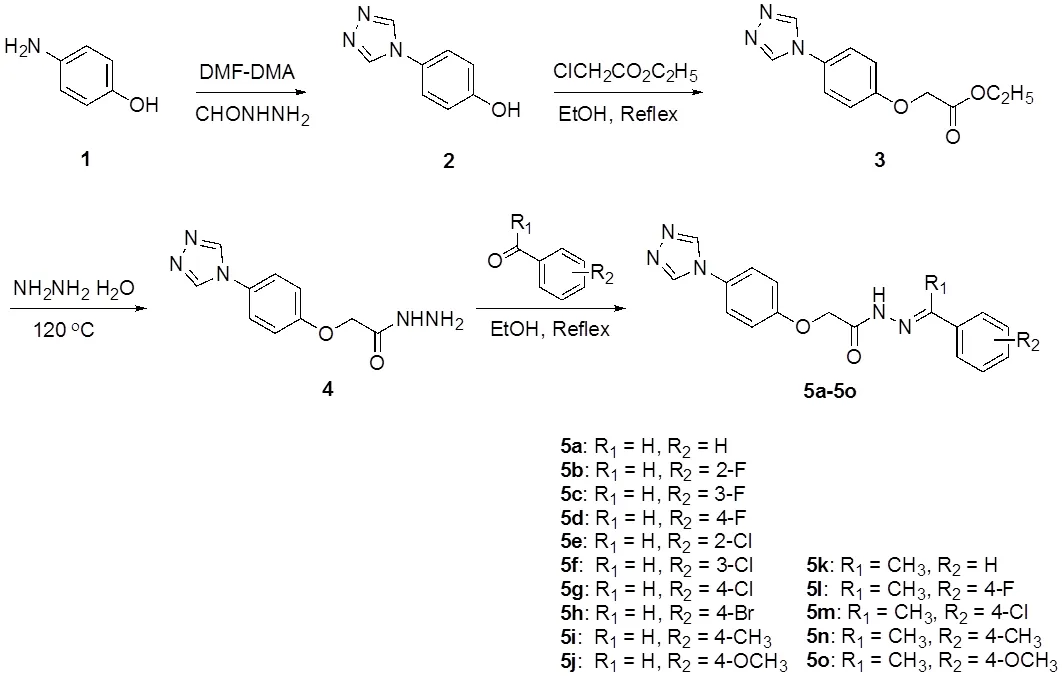
目标化合物5a-5o的合成路线
2.2 药理实验部分
2.2.1 抗癫痫活性
本实验采用MES和-PTZ 模型来评价目标化合物5a-5o的抗癫痫活性。虽然两个模型在对难治性癫痫的药物筛选方面有所欠缺,但目前依然是抗癫痫药物筛选的首要选择,被美国NIH列举为主要的抗癫痫药物筛选模型[18]。其中MES 模型用于筛选能对抗全身强直阵挛性发作的候选药[19],而Sc-PTZ 模型则用来筛选失神发作的候选药物[20]。本实验对目标化合物进行了30、100、300 mg/kg 三个剂量的活性和神经毒性初步评价,其结果见表1。化合物5b在100 mg/kg剂量下表现出对抗电刺激所致惊厥活性,化合物5c-5d, 5i和5k-5o在300 mg/kg剂量下表现出对抗电刺激所致惊厥活性。其他化合物在最大剂量300 mg/kg 下未见抗电惊厥活性。
在scPTZ实验中,化合物的抗惊厥活性与在MES模型中的表现基本相同,除了化合物5l和5m在300 mg/kg剂量下未见抗戊四唑所致惊厥活性。旋转棒实验模型中,所有化合物在最大剂量300 mg/kg下均未表现出神经毒性,说明此系列化合物安全性良好。总的来说,该系列化合物的抗癫痫活性没有达到预期,比之前报道的苯基三唑化合物明显偏低,这可能是酰腙引入的位置占据了苯基三唑类分子与相关受体疏水性结合部位,并且较大的极性导致了分子高亲水性,从而影响其透过血脑屏障来发挥体内抗癫痫活性。
表1 化合物5a-5o的抗癫痫活性及神经毒性(小鼠腹腔给药)
Table 1 Anticonvulsant activity and neurotoxicity of compounds 5a-5o in mice
CompoundsR1R2Intraperitioneal injection in micea MESb Sc-PTZc NTd 5aHH- - - 5bHo-F100 100 - 5cHm-F300 300 - 5dHp-F300 300 - 5eHo-Cl- - - 5fHm-Cl- - - 5gHp-Cl- - - 5hHp-Br- - - 5iHp-CH3300 300 - 5jHp-OCH3- - - 5kCH3H300 - - 5lCH3p-F300 - - 5mCH3p-Cl300 - - 5nCH3p-CH3300 300 - 5oCH3p-OCH3300 300 -
a每组动物数3只,给药剂量为30、100、300 mg/kg。表中数据表示该剂量下超过一半小鼠被保护,检测时间为给药后半小时后,-表示在300 mg/kg下未见活性或者神经毒性;b最大电休克发作实验;c皮下戊四唑实验;d神经毒性评价(转棒实验)。
2.2.2 抗炎活性
脂多糖(LPS)是革兰氏阴性细菌细胞壁外壁的组成成分,被认为是通过刺激炎性细胞因子(如肿瘤坏死因子(TNF-α)的释放而启动炎症过程的主要危险因素[21]。LPS诱导TNF-α 释放模型被认为是一种有效的用于筛选抗炎活性的体外模型[22]。在本研究中,通过建立LPS诱导RAW 264.7细胞炎症模型来筛选化合物5a-5o的体外抗炎活性。如图1所示,被LPS刺激的RAW 264.7细胞TNF-α浓度显著升高,阳性药地塞米松可以显著抑制LPS诱导的TNF-α浓度的升高。筛选化合物中,5a-5h和5k-5m均表现出明显的抗炎活性,可以显著抑制LPS诱导的TNF-α浓度的升高。化合物5i, 5j, 5n和5o在测试剂量下对LPS诱导TNF-α释放也有抑制作用,但没有统计学差异,而这4个化合物恰好都是甲基和甲氧基取代的化合物,这可能是给电子取代基影响了分子与受体的结合,从而降低了化合物的抗炎活性。
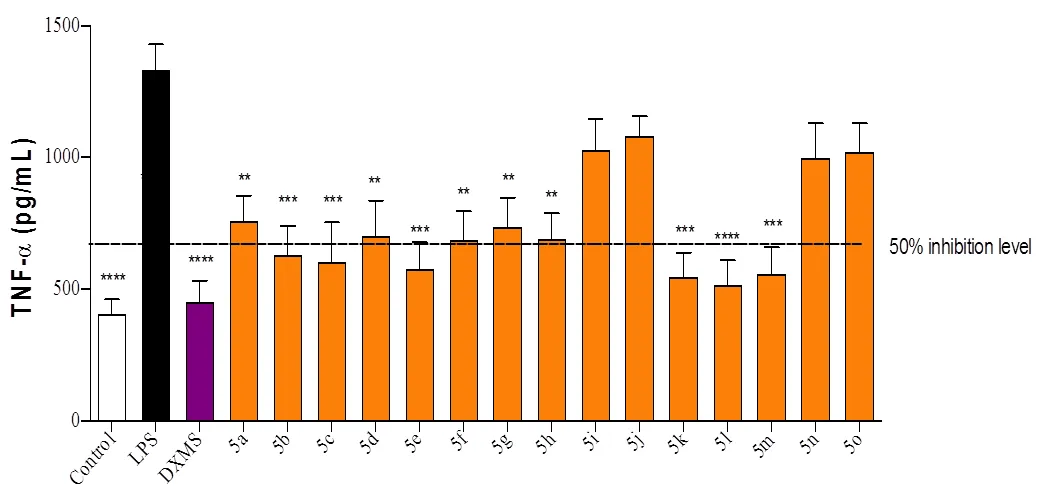
(棒形条代表三孔测定值的平均值 ± 标准误,**P < 0.01,***P< 0.001,****P < 0.0001,统计分析采用ANOVA followed by Dunnett’s test)
3 小结
本实验研究合成了一系列2-(4-(4H-1,2,4-三唑-4-基)苯氧基)-N'-(1-苯亚乙基)乙酰肼类化合物,其结构均经过核磁共振谱确证。该系列化合物虽然表现出一定的抗癫痫活性,但没有达到预期强度,这可能是酰腙的引入影响了分子与受体的疏水性结合,并降低了分子的亲脂性,从而影响其透过血脑屏障来发挥体内抗癫痫活性。该结果提示在后续设计中可以尝试调整酰腙的位置,并保留足够的分子亲脂性片段。此外,该系列化合物在LPS诱导RAW 264.7细胞炎症模型中可以显著抑制TNF-α的释放,说明其具有良好的抗炎作用,该结果丰富了三氮唑类化合物在抗炎作用中的应用,为后续抗炎药物的研究开发提供了实验依据。
[1] 梁树立. 重视老年癫痫的外科治疗[J]. 中华老年心脑血管病杂志, 2018, 20(8): 7-9.
[2] 林玉冰,许梅花.抗癫痫药物的研究进展[J]. 养生保健指南, 2019(24): 237.
[3] 孔令军,肖瑞林,朱秋根. 成人癫痫患者生活质量的研究[J]. 井冈山学院学报, 2007, 28(3): 108-110.
[4] Ganguly S, Jacob S K. Therapeutic Outlook of Pyrazole Analogs: A Mini Review[J]. Mini Rev Med Chem., 2017, 17(11):959-983.
[5] Liu J J, Zhao M Y, Zhang X, et al. Pyrazole derivatives as antitumor, anti-inflammatory and antibacterial agents[J]. Mini Rev Med Chem., 2013, 13(13): 1957-66.
[6] Ali R, Khan M A, Siddiqui N. Past, present and future of antiepileptic drug therapy-finding a place for heterocyclics[J]. Mini Rev Med Chem, 2015, 15(12): 1024-50.
[7] 陈士龙,郭东福,喻圣旺,等. 1-(3-苯氧基丙基)-1H-1,2,4-三氮唑衍生物的合成及其抗惊厥活性[J]. 井冈山大学学报:自然科学版, 2019, 40(1):88-93.
[8] 赵克谊,任娜. 三唑类药物研究新进展[J]. 临床医药文献电子杂志, 2015, 2(11): 2041,2043.
[9] 邓先清. 三唑杂环衍生物的合成及其抗癫痫活性研究[D]. 延边:延边大学, 2013.
[10] Deng X Q, Song M X, Zheng Y, et al. Design, synthesis and evaluation of the antidepressant and anticonvulsant activities of triazole-containing quinolinones[J]. Eur. J. Med. Chem., 2014, 73: 217-224.
[11] Chen J, Sun X Y, Chai K Y, et al. Synthesis and. anticonvulsant evaluation of 4-(4-alkoxylphenyl)-3-ethyl- 4H-1,2,4-triazoles as open- chain analogues of 7-alkoxyl- 4,5-dihydro[1,2,4] triazolo [4,3-a]quinolines[J]. Bioorg. Med. Chem., 2007, 15(21): 6775-81.
[12] Krivoshein A V. Antiepileptic drugs based on the α-substituted amide group pharmacophore: from chemical crystallography to molecular pharmaceutics[J]. Curr Pharm Des., 2016, 22(32):5029-5040.
[13] Angelova V, Karabeliov V, Andreeva-Gateva P A, et al. Recent developments of hydrazide/ hydrazone derivatives and their analogs as anticonvulsant agents in animal models[J]. Drug Dev Res., 2016, 77(7): 379-392.
[14] Kajal A, Bala S, Sharma N, et al. Therapeutic potential of hydrazones as anti-inflammatory agents[J]. Int J Med Chem., 2014, ID761030.
[15] Aggarwal R, Sumran G. An insight on medicinal attributes of 1,2,4-triazoles[J]. Eur J Med Chem., 2020, 205(11):112652.
[16] Krall R L, Penry J K, White B G, et al. Antiepileptic drug development: II. Anticonvulsant drug screening[J]. Epilepsia, 1978, 19(4): 409-28.
[17] Porter R J. Antiepileptic drug development program[J]. Prog Clin Biol Res, 1984, 51(2): 53-66.
[18] Wolfgang L. Animal models of seizures and epilepsy: past, present, and future role for the discovery of antiseizure drugs[J]. Neurochem Res., 2017, 42(7): 1873-1888.
[19] Smith M, Wilcox K S, White H S. Discovery of antiepileptic drugs[J], Neurotherapeutics, 2007, 4(1): 12-17.
[20] White H S. Clinical significance of animal seizure models and mechanism of action studies of potential antiepileptic drugs[J]. Epilepsia, 1997, 38(1): S9-17.
[21] Waseem T, Duxbury M, Ito H, et al. Exogenous ghrelin modulates release of pro-inflammatory and anti-inflammatory cytokines in LPS-stimulated macrophages through distinct signaling pathways[J]. Surgery, 2008, 143(3): 334-342.
[22] Guruvayoorappan C, Kuttan G. (+)-Catechin inhibits tumour angiogenesis and regulates the production of nitric oxide and TNF-α in LPS-stimulated macrophages[J]. Innate Immunity, 2008, 14(3): 160-174.
SYNTHESIS OF 2-(4-(4-1,2,4-TRIAZOL-4-YL)PHENOXY) ACETYLHYDRAZONES AND THEIR BIOLOGICAL ACTIVITIES
LUO Hui, LIN Li-wen, ZHAO Zi-wei, CHEN Qiu-yan, LIANG Yu-qiu,*DENG Xian-qing
(Health Science Center, Jinggangshan University, Ji´an, Jiangxi 343009, China)
A series of 2-(4-(4-1,2,4-triazol-4-yl) phenoxy-acetylhydrazones (5a-5o) were synthesized using paracetamol as the starting material. The structures of these compounds were confirmed by1H-NMR and13C-NMR spectrum. Their anticonvulsant activities were screened using maximal electroshock shock (MES) and subcutaneous pentylenetetrazole (scPTZ) seizure models in mice. Their neurotoxicity was evaluated with rotarod test.LPS-induced TNF-α model was used to evaluate their anti-inflammatory activity. Their moderate-to-weak anticonvulsant activities were confirmed in the MES and scPTZ models. And no neurotoxicity were found at the dose of 300 mg/kg. What’s more, compounds 5a-5h, and 5k-5m markedly inhibited the expression of TNF-α at the concentration of 20 μg/mL. These facts enrich the antiepileptic and anti-inflammatory structure-activity relationships of triazole derivatives, and provides a certain basis to the research and development of new antiepileptic or anti-inflammatory drugs.
triazole; acetylhydrazone; anticonvulsant; anti-inflammatory; TNF-α
R914.5
A
10.3969/j.issn.1674-8085.2021.02.006
1674-8085(2021)02-0032-07
2021-01-07;
2021-02-02
江西省自然科学基金项目(20202BABL206154); 江西省教育厅科技计划项目(GJJ190563)
罗 辉(1971-),男,江西吉安人,副教授,硕士,主要从事化学与生物学、分子生物学研究(E-mail: luohui9898@163.com);
林立文(1999-),男,青海西宁人,井冈山大学医学部药学专业2017级本科生(E-mail:linliwen6825@126.com);
赵紫薇(2000-),女,云南红河人,井冈山大学医学部药学专业2017级本科生(E-mail:zhaoziwei0205@126.com);
陈秋燕(1998-),女,江西景德镇人,井冈山大学医学部药学专业2017级本科生(E-mail:chenqiuyann@126.com );
梁雨秋(1998-),女,江西赣州人,井冈山大学医学部药学专业2017级本科生(E-mail:liangyuqiuu@126.com;
*邓先清(1984-),男,湖南衡阳人,副教授,博士,主要从事合成药物化学研究(E-mail:dengxianqing1211@126.com).
