栀子主要有效成分的代谢及毒性研究进展
2021-03-26高雨朱琦陈蕾蕾王子桐曹正弦黄昊妍张永杰陈西敬中国药科大学基础医学与临床药学学院临床药物代谢动力学研究室南京211198
高雨,朱琦,陈蕾蕾,王子桐,曹正弦,黄昊妍,张永杰,陈西敬(中国药科大学基础医学与临床药学学院 临床药物代谢动力学研究室,南京 211198)
中药材栀子来源于茜草科植物栀子(Gardenia jasminoidesEllis)的干燥成熟果实[1],始载于《神农本草经》,其味苦,性寒,归心、肺、三焦经,临床主治热病烦渴、肝火目赤、湿热黄疸、血热出血、疮疡肿毒等。此外,作为卫生部颁布的第一批药食两用资源,栀子的使用十分广泛,如香附栀子粥、栀子茶、菊苣栀子茶等。
栀子果实的化学成分繁多,将其归纳如表1所示[2-4]。其中与栀子药理学功效密切相关的是以栀子苷为代表的环烯醚萜类成分,以藏红花酸(西红花酸)为代表的二萜类成分,以及以绿原酸为代表的有机酸酯类成分。几种有效成分中又以栀子苷含量最高[3-4],被公认为栀子中最重要的活性成分;因此基于栀子苷的药效[5-7]、代谢和毒性[8-10]等的研究也最为广泛。

表1 栀子果实的主要成分[2-4]Tab 1 Main components of Fructus Gardeniae[2-4]
近年来,栀子毒性越来越受到关注。中药古籍中就有关于栀子“苦寒伤胃”的药性记载。如《本草经疏》中提到:“栀子禀至苦大寒之气,苦寒损胃而伤血,凡脾胃虚弱者忌之”。2017年,国家食品药品监督管理总局曾发布关于修订茵栀黄口服制剂说明书的公告,明确说明了服用茵栀黄口服制剂会引起腹泻、呕吐等不良反应。此外,近年来,许多研究发现实验动物长期大剂量灌服栀子提取物后出现不同程度的肝肾毒性反应[11-13],提示栀子有潜在的肝肾毒性。而栀子毒性的物质基础与其有效成分在体内的代谢密切相关。现将栀子主要有效成分的代谢、毒性特征及毒性机制研究进展综述如下。
1 栀子主要有效成分的体内代谢研究进展
近年来,关于栀子有效成分的体内代谢研究多集中于以栀子苷为代表的环烯醚萜苷类成分,其已发现的主要代谢路径如图1所示。
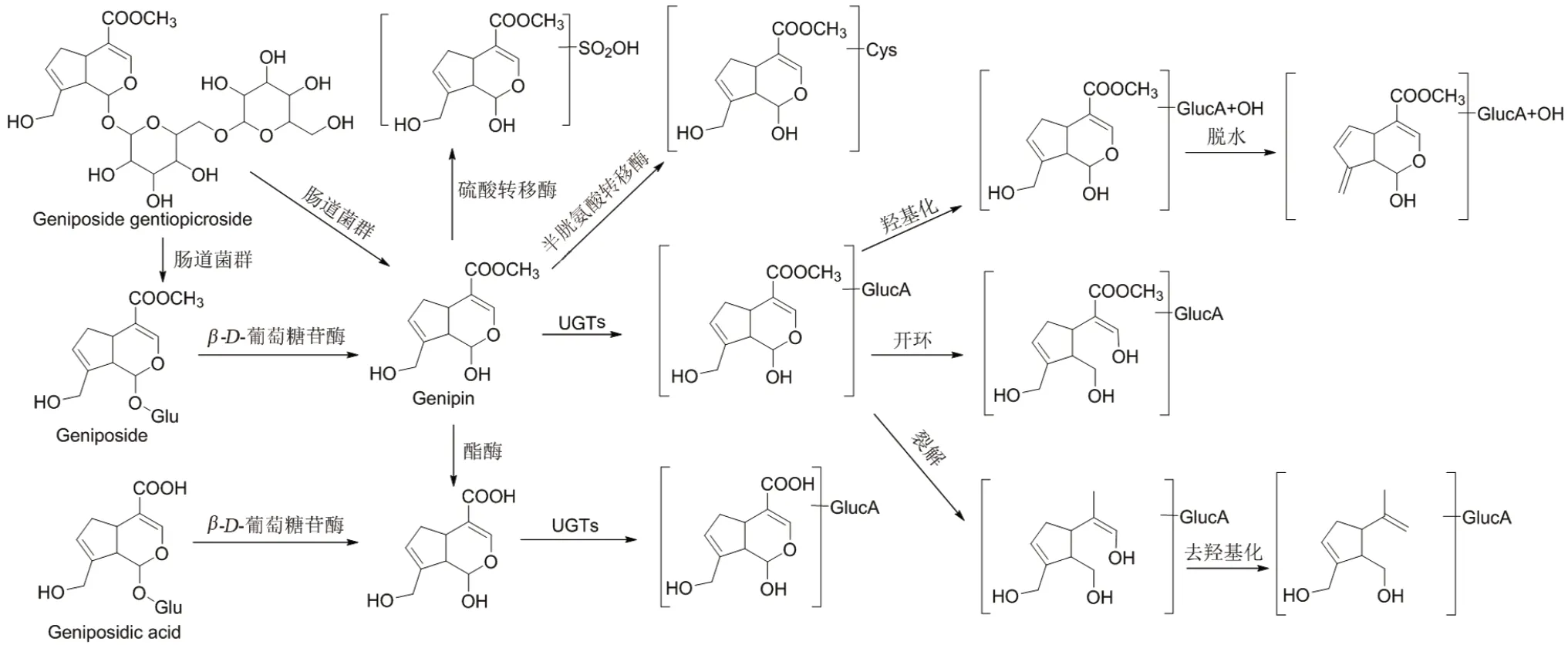
图1 栀子主要有效成分的代谢途径[14-28]Fig 1 Metabolic pathways for main effective components of Fructus Gardeniae[14-28]
1.1 在胃肠道的代谢
栀子作为常用天然药物,其给药方法一般为熬煮后口服。而经口服途径给予的很多临床用药,特别是中草药,其成分会受到胃液和肠道菌群的影响。
Miyagoshi 等[14]研究表明,栀子苷在胃液中(37 ℃,pH =1.8)没有发生改变,说明胃液环境对栀子苷没有影响。而羟异京尼平苷则在胃液中发生异构化,生成鸡屎藤次苷甲酯(SSM)和去乙酰车前草酸甲酯(DAM),且两者生成速率比为1∶8。
Kawata 等[15]筛选了25 种人体肠道菌群,将其分别在栀子苷和NH4Cl 存在条件下的厌氧环境中培养后分析,确定桅子苷代谢产物中含有京尼平及2 个新化合物,说明栀子苷在肠道菌群作用下会分解为苷元。而在具有β-D-葡萄糖苷酶和酯酶活性的大鼠肝脏匀浆中加入 KCl 及栀子苷,并在pH 7.2 的磷酸钾缓冲液中进行培养,没有检测到京尼平,说明栀子苷并没有经肝脏中的代谢酶分解[16],由此推测栀子苷很可能只在肠道菌群作用下转化为京尼平。
京尼平在肠道会进一步被酯酶水解为栀子酸苷元[16],栀子酸也在β-D-葡萄糖苷酶的作用下脱糖基生成栀子酸苷元;羟异京尼平苷在胃液中异构化生成的SSM 和DAM,也在肠道内进一步脱糖基[14]。将京尼平龙胆双糖苷在大鼠肠道菌群和大鼠原代肝细胞中分别培养,结果表明,京尼平龙胆双糖苷也在肠道内脱去糖基生成栀子苷和京尼平,栀子苷可进一步脱糖基生成京尼平[17]。
由此可见,栀子中的环烯醚萜类成分经口服后首先会在肠道菌群的作用下脱去糖基,生成相应苷元,如京尼平或栀子酸苷元。在体外,用杏仁β-D-葡萄糖苷酶在37℃、NH4Cl 存在条件下分别与栀子苷、羟异京尼平苷温孵培养,检测出京尼平和京尼平碱[15],说明栀子苷和羟异京尼平苷还可以在肠道内发生N-杂环化反应,由氮取代2 位的氧,生成含氮化合物[18]。
1.2 在肝脏等部位的代谢
体内研究表明,栀子成分中吸收入血的苷元会在肝脏等部位发生广泛的Ⅱ相反应,生成葡萄糖醛酸结合物、硫酸结合物等;之后,还会发生去羟基化、开环等反应,生成相应的代谢产物。有的苷元会再次转化成苷,通过胆汁分泌到肠道,形成肝肠循环[19]。
Han 等[20]采用超高效液相色谱-电喷雾四极飞行时间串联质谱法鉴定大鼠尿液中栀子苷代谢物。结果表明,栀子苷经肠道菌群去糖基后形成京尼平,被吸收进入血液;随后发生京尼平的葡萄糖醛酸化和吡喃环开环裂解后的去羟基化、N-杂环化、还原反应及半胱氨酸结合反应。Li 等[21]分析大鼠灌胃给予栀子苷后血液、尿液、肝脏、肾脏等部位共33 种代谢产物,发现栀子苷发生了水解、羟基化、牛磺酸结合、氢化、脱羧、去甲基化、硫酸结合、半胱氨酸结合、葡萄糖醛酸结合等一系列反应及其复合反应。本课题组前期系统地研究了栀子在小鼠体内的代谢,从小鼠胆汁、血浆、尿液和粪便中鉴定出31 种原形化合物和38 种代谢物,提出了这些代谢物在体内的生物转化途径,包括Ⅰ相反应(水解、氢化、氧化、失氧、成酮、脱羧)和Ⅱ相反应(甘氨酸、半胱氨酸、谷胱甘肽、谷氨酰胺、硫酸盐结合和葡萄糖醛酸化)[22]。
Wang 等[23]分析人口服栀子后血浆和尿液中的栀子成分和代谢产物,其中,栀子酸、京尼平-O-葡萄糖醛酸去甲基化衍生物和单羟基京尼平-O-葡萄糖醛酸脱水产物只在人尿液中发现。推测栀子苷和栀子酸在人体内先水解成苷元后经历葡萄糖醛酸化、羟基化或吡喃环开环、裂解等代谢过程排出体外,与大鼠体内代谢不同的是,在人体内存在一条不同的羟基化途径。另外,有研究表明,京尼平对CYP3A4 和CYP2C19 的mRNA 和蛋白表达均有明显的抑制作用[24],提示在人体内可能发生京尼平与CYP3A4、CYP2C19底物的药物间相互作用。
许多研究通过检测并鉴定大鼠各个部位代谢物的结构以推断潜在的代谢途径,Wang 等[25]给大鼠灌胃栀子苷100 mg·kg-1后检测各组织的AUC0→4h,结果肾>脾>肝>心>肺>脑,这表明栀子苷在肾脏分布较多,但尚未有文献系统地研究各个部位各代谢物的浓度。虽然诸多研究已经认定葡萄糖醛酸化和硫酸化是京尼平的主要代谢途径[26-27],但目前尚未有关于葡萄糖醛酸转移酶和硫酸转移酶各亚型在京尼平代谢过程中的贡献的报道,且在肝脏内代谢的各酶促反应动力学过程等参数(如Vmax和Km)也未有阐述,这些都需要进一步的研究。
对于栀子中其他有效成分,王春雪等[28]发现了栀子酸在大鼠体内经脱水、开环、双键还原和半胱氨酸结合等生物转化产生了9 个代谢产物,绿原酸经脱羧、水解、甲基化、乙酰化、半胱氨酰甘氨酸结合和谷胱甘肽结合等生物转化产生了12 个代谢产物。Jiang 等[17]分别取大鼠口服京尼平龙胆双糖苷后的尿液、血浆、粪便及各脏器,发现京尼平龙胆双糖苷口服后会发生去糖基化、羟基化、硫酸结合、9-葡萄糖醛酸化、氢化、脱甲基、糖基化和脱水共8 种生物转化。
2 栀子主要有效成分的毒性及其机制研究进展
栀子的毒性反应类型以肝脏、胃肠道、肾脏损伤为主,但其毒性特征与机制不尽相同,本节主要对实验动物水平的栀子毒性反应研究进行总结。
2.1 动物实验水平胃肠道毒性特征与机制
大量研究显示,苦寒中药可以通过影响肠道菌群的动态平衡从而影响肠道的正常生物学功能[29],栀子的肠毒性可能与此有关。俞琦等[30]以大鼠为实验对象,以抗生素组和正常组作为对照,分别灌胃给予不同剂量的栀子水提物,结果表明,中、高剂量栀子水提物可引起大鼠腹泻、体重减轻、被毛凌乱无光泽;但其对大鼠肠道的作用仅限于调节肠道菌群,并不导致肠道菌群明显失调;同时对TNF-α、IL-6 等细胞因子的释放有一定抑制作用,但机制尚未明确。陈丽艳等[31]研究了6 种具有代表性的人肠道菌群与栀子豉汤、栀子及淡豆豉的相互作用,体外实验证明栀子可明显抑制个别敏感肠菌,而栀子豉汤则可使菌群保持平衡,提示栀子与其他中药的合理配伍或许可以降低肠道毒性,但仍有待进一步研究。上述研究结果的不一致性可能是由于大鼠与人的肠道菌群存在差异,且肠道菌群组成复杂,在不同个体中的种类、数量、比例各不相同,而研究中选择测定的仅是目前认为具有代表性的一小部分,尚不全面,仍需进一步的探究。
既往对栀子毒性机制的研究多集中于其肝脏毒性,且以氧化应激和线粒体损伤的报道最为多见,内质网应激反应通路和炎症应激反应通路未见报道。本课题组利用代谢组学的方法研究表明[32],栀子提取物在大鼠体内的胃肠道毒性与其扰乱维生素B6、苯丙氨酸、花生四烯酸、牛磺酸和亚牛磺酸等内源性物质代谢密切相关,这提示栀子胃肠道毒性与炎症应激反应通路有潜在关联性,而持续的严重内质网应激会促进炎症反应,诱发细胞凋亡。
2.2 动物实验水平肝毒性特征与机制
栀子在临床上主要用于肝脏疾病的治疗,因此对其肝脏毒性的关注和相关研究也较多。
关于栀子肝脏毒性的物质基础,有学者认为是栀子中的主要药理成分栀子苷,也有人认为是其经肠道菌群水解产生的京尼平。任燕青等[33]以HepG2 肝细胞为研究对象,比较了栀子苷和京尼平的细胞毒作用,明确了京尼平为栀子肝细胞毒性物质。除京尼平外,还有研究认为京尼平在体内蓄积时会耗竭体内的谷胱甘肽,且能与体内其他氨基酸结合生成络合物栀子蓝,栀子蓝是导致栀子肝脏毒性的关键性物质。卫璐戈等[34]通过动物及细胞毒性实验,比较了栀子苷、京尼平和栀子蓝的体内外肝毒性,结果与任燕青等[33]的研究结果相一致,进一步证明了京尼平是栀子肝脏毒性的主要物质基础,其可能机制为京尼平与氨基酸结合生成络合物,其生成过程本身消耗了体内的某些活性氨基酸;同时,研究结果表明极性大的栀子蓝对肝脏的毒性很小,相对安全。
栀子苷经肠道菌群代谢生成的京尼平是目前较为公认的栀子肝毒性原因,对栀子毒性机制的研究也主要基于京尼平开展。京尼平引起的肝损伤发病机制复杂,尚未完全阐释清楚,就目前研究现状来说,主要包括以下几点:① 直接损伤肝蛋白;② 氧化应激-线粒体损伤诱发细胞凋亡/坏死;③ 直接损伤线粒体;④ 破坏胆汁酸稳态。
2.2.1 直接损伤肝蛋白 Li 等[35]研究发现,京尼平在大鼠肠道菌群的作用下能进一步生成反应性的双醛化合物中间体。该中间体可对肝蛋白赖氨酸残基进行共价修饰,从而诱导大鼠产生肝毒性。
2.2.2 氧化应激-线粒体损伤诱发细胞凋亡/坏死 氧化应激是多种中草药引起肝损伤的重要机制,是指活性氧的产生与体内抗氧化系统之间的失衡。就目前研究来看,栀子导致肝损伤的具体机制主要与氧化应激有关。Ding 等[36]对栀子苷在大鼠体内的急性毒性进行研究,发现其肝脏毒性机制主要与氧化应激、肝丙二醛浓度增加、总超氧化物歧化酶活性降低有关。任燕青等[33]也发现京尼平可显著降低HepG2 肝细胞内抗氧化的能力,导致超氧化物歧化酶、过氧化物酶活性下降以及谷胱甘肽含量降低,基于高内涵细胞成像分析技术(HCS)体外毒性评价研究发现,线粒体是活性氧的主要靶细胞器,活性氧诱发氧化应激所导致的线粒体损伤进而触发级联反应导致的细胞凋亡是京尼平肝毒性的主要机制之一。
2.2.3 直接损伤线粒体 Yang 等[37]研究表明,京尼平导致肝毒性的关键基团是1 位的羟基,它可以直接与线粒体UCP2 蛋白作用,抑制其功能,且能导致活性氧的产生,加重线粒体损伤。
2.2.4 破坏胆汁酸稳态 田婧卓[38]通过栀子苷在大鼠体内的急性毒性及长期毒性研究发现,栀子苷诱导的肝损伤作用与其诱导胆汁酸代谢紊乱、影响胆汁酸的合成与转运有关。周飞等[39]结合临床生化和组织病理学鉴别诊断,对栀子苷类药物引起的SD 大鼠肝肾中胆红素沉着进行了准确诊断,病理学检查显示,与对照组大鼠相比,给药组大鼠血清总胆红素(TB),g-谷氨酰转移酶(GGT)浓度显著性升高。并且,给药组大鼠尿液中尿胆素原(URO)和尿液胆红素(BIL)含量呈剂量相关性增加,对照组大鼠尿液中的 BIL 为阴性;肝肾组织HE 染色结果显示,给药组所有大鼠的肝脏和肾脏中出现极细微的棕黄色色素颗粒,且仅在显微镜×400 及以上倍数可辨认。这些色素颗粒主要分布于胆管周围肝细胞的胞浆、肾小管上皮细胞中。特殊染色结果显示,肝脏和肾脏出现的色素颗粒对于胆红素染色(Fouchet 染色)呈清晰的阳性(绿色颗粒),而对于三价铁/含铁血黄素染色(Perls blue 染色)呈阴性。综合药物背景及给药组大鼠血清中TB、GGT 以及尿液中URO、BIL 的升高,提示肝脏和肾脏中出现的棕黄色色素可能是胆红素,再结合特殊染色对胆红素染色呈清晰阳性的结果,最终确诊为受试物——新型栀子苷类药物引起SD 大鼠肝脏和肾脏的胆红素沉着。这一研究结论也佐证了田婧卓[38]的观点。
上述毒性机制(归纳于图2,其相关指标归纳于表2)往往不会单独作用,而是相互影响,互为因果,但具体机制的研究尚不完善,仍需进一步阐明。
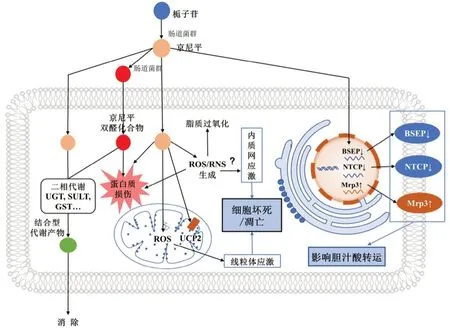
图2 栀子主要有效成分的代谢和肝脏毒性机制示意图Fig 2 Metabolism and hepatotoxicity mechanism of main active components of Fructus Gardeniae

表2 栀子肝毒性机制相关指标总结Tab 2 Hepatotoxicity index of Fructus Gardeniae
此外,免疫反应也是药物性肝损伤的常见机制之一。例如,近年来研究发现,何首乌的肝毒性就与免疫相关遗传因素的差异有关[40]。据此,栀子诱发的肝损伤也可能与其活性代谢物如京尼平双醛化合物等与肝蛋白的加合物被机体识别为抗原从而激发自身免疫反应有关,值得进一步的研究。
2.3 动物实验水平肾毒性特征
长久以来,栀子作为药食两用的中药材被广泛使用,少见其毒性报道,但在动物实验中可以观察到栀子苷的肾脏毒性。程生辉等[13]在一项研究中考察了栀子苷对正常大鼠急性肾毒性的时-毒关系,发现给予正常大鼠一次性大剂量(1.2 g·kg-1)栀子苷后,其尿素氮、肌酐升高,表明存在一定的肾脏毒性,且造成的急性肾损伤可逆,并呈现一定的时-毒关系。冯筱懿等[41]研究表明,栀子苷高剂量(300 mg·kg-1)给药3 d 可引起肾小管细胞轻度肿胀,呈现空泡样变性,肾小球基本正常,大鼠的尿液中肾脏损伤因子(KIM-1)水平显著增高,其中部分大鼠中性粒细胞明胶酶相关脂质运载蛋白(NGAL)水平也增高,但尿素氮(BUN)、肌酐(Cre)尚未产生明显变化;从高剂量组大鼠个体数据来看,尿液KIM-1 水平显著升高(P<0.01),NGAL 部分升高,且NGAL 明显增高的大鼠KIM-1 水平也明显增高,肾脏病理检查显示有病理损伤,说明两者有一定相关性。这提示,在栀子临床应用中除了目前常用的检测肾功能的指标 BUN和 Cre 以外,尚需增加新的更为敏感的指标用于监测肾脏毒性,如KIM-1、NGAL。
由于栀子苷临床常用于黄疸的治疗,而药物在正常个体与疾病状态下机体中的代谢过程往往存在一定差异,近年来,栀子在黄疸动物模型中的毒性作用逐渐受到研究者的关注。程生辉等[42]研究表明,单次大剂量给予栀子苷对正常大鼠与黄疸大鼠均有肾毒性,都能引起BUN 和Cre 升高,且栀子苷在黄疸模型大鼠体内的最低中毒剂量明显低于正常大鼠,说明在肝损伤状态下,栀子苷更容易导致肾损伤。推测其形成原因可能与黄疸状态下肝脏代谢能力下降影响了栀子苷在体内的代谢解毒有关。这提示在实际临床中,黄疸患者即使使用治疗剂量的栀子仍可能导致肾损伤,应注意栀子的临床用量,且有必要进行栀子在疾病模型中的毒性及其机制相关研究。
3 临床水平毒性特征
关于栀子的临床毒性,特别是胃肠道损伤,古籍即有记载。如明代《医宗必读》指出栀子“大苦大寒,能损胃伐气,虚者忌之”;《本草经疏》中明言:“栀子禀至苦大寒之气,苦寒损胃而伤血,凡脾胃虚弱者忌之,血虚发热者忌之。”说明长久以来,我国就已经有关于栀子胃肠道损伤、肝肾毒性的认识。而根据传统中医学理论,心与肝经络相连,栀子归心、肺、三焦经,而肺与大肠相表里,肾与三焦相通,为栀子毒性提供了理论基础。
近年来也有一些关于栀子及其复方制剂毒性的文献或报道。2015年版《中国药典》规定栀子的用量为6~10 g,超量使用可能会导致严重不良反应。2017年,原国家食品药品监督管理总局明确说明服用茵栀黄口服制剂(主要成分为栀子、茵陈、黄芩苷)会引起腹泻、呕吐等不良反应。黎冬梅[43]评价茵栀黄口服液治疗足月新生儿黄疸的临床疗效和不良反应,发现观察组不良反应发生率为13.3%,主要为腹泻、呕吐、不耐受,对照组不良反应发生率为0.0%,差异有统计学意义(P<0.05),所以建议胃肠道功能障碍的患儿谨慎使用。贺学成等[44]提出,服用栀子金花丸(主要成分为栀子、黄芩、大黄等)、泻下剂易致腹泻、腹痛。余舒乐等[45]提取2017年江苏省药品不良反应监测系统中符合纳入标准的热毒宁注射液(主要成分为青蒿、金银花、栀子)不良反应报告共1452 例,分析后得出不良反应大多轻微,主要累及皮肤如皮疹、面部潮红等,其次为消化系统,表现为恶心呕吐、腹胀腹痛、腹泻。结合古籍记载及中医学理论,可以推断报道中栀子复方制剂关于胃肠道反应、肝肾功能毒性反应的相关记载很大程度上或与栀子有关。
4 结语
本文介绍了以栀子苷为代表的栀子主要有效成分的代谢及其在不同组织、器官中的代谢依赖性毒性特征及机制。但是,目前对于栀子的代谢过程及代谢依赖性毒性的研究仍有许多疑问:如栀子的毒性代谢产物京尼平的生成和消除(尤其是Ⅱ相代谢消除)过程尚未阐明,其中参与京尼平消除的酶的具体亚型(UGT 和SULT,以及可能的GST 亚型)及其在消除中的贡献尚不明确,这些酶表达水平的变化是否可以调控京尼平的毒性等均尚未见报道。此外,不同个体对于栀子的毒性反应也大不相同。在对传统中药何首乌的研究中,Li 等[40]揭示了不同人对于何首乌所致的肝损伤的敏感性不同是由于其HLA-B*35:01等位基因存在差异性。这提示栀子毒性的个体差异或许也与等位基因的不同有关。今后的研究宜在前期工作的基础上,从栀子的代谢途径、代谢酶的表征、栀子的毒性机制及毒性相关基因的研究等方面入手,获取更多、更深入的研究数据,以期为临床合理用药提供指导,为中药成分的毒性研究提供新的思路与方法。
