活体监测植物葡萄糖的微型传感器研究*
2021-03-26李爱学
杨 磊, 陈 达, 王 成, 李爱学
(1.北京农业智能装备技术研究中心,北京 100097;2.山东科技大学 电子信息工程学院,山东 青岛 266590)
0 引 言
糖在植物生长过程中起着至关重要的作用。最近研究发现,糖类还在信号传导过程中具有激素类的信使功能[1]。因此,对植物中的糖进行定量分析是非常重要的。传统的植物可溶性糖测定方法有气相色谱法[2]、液相色谱法[3]、近红外光谱法[4]、荧光光谱法[5]等。然而,这些方法都是离体检测,植物样品的采集对植物体本身可能会造成某些不可逆转的伤害。而且这些方法得到的结果往往反映了某一时刻的静态浓度或累积效应,不能反映植物体内代谢物质随环境变化的实时动态信息。因此,需要开发新的方法来实时检测植物中的糖。
电化学生物传感器具有灵敏度高、选择性好、便携性好、响应速度快、易于集成等优点[6,7],近年来得到了较快发展。电化学生物传感器已被用于活体实时检测不同动物体内的葡萄糖、乙酰胆碱、多巴胺、ATP、胆固醇和谷氨酸[8]。一些电化学生物传感器也被用于实时监测植物体内的H2O2或NO[9,10]。葡萄糖是植物体内的一种重要的可溶性糖,在植物体内含量较多,大部分植物体内葡萄糖的含量在0到几百毫摩尔每升范围内[11~14]。而目前发展的用于人体及动物体的葡萄糖传感器的检测范围较窄,一般仅能达到几十毫摩尔每升[15~17],不能用来进行植物葡萄糖的检测。目前更没有能够实时检测植物葡萄糖的电化学生物传感器。
本文利用葡萄糖氧化酶(GOD)特异性催化葡萄糖,通过固定醋酸纤维素(CA)提高葡萄糖氧化酶的固载量,通过聚氨酯—环氧树脂(PU-Epoxy)提高传感器的选择性和稳定性,首次研制了一种适用于植物体内葡萄糖浓度实时监测的电化学微型传感器。该葡萄糖传感器具有较高的灵敏度和选择性,以及良好的重现性和稳定性。并利用所研制的生物传感器成功地对芦荟体内的的葡萄糖含量变化进行了实时检测。
1 材料与方法
1.1 化学品和材料
葡萄糖、醋酸纤维素(CA)、戊二醛(glutar)、蔗糖、乳糖、甘氨酸、山梨醇、果糖、半乳糖、聚氨酯(PU)、Epoxy(双酚A,二缩水甘油醚)、葡萄糖氧化酶(GOD)、牛血清白蛋白(BSA)、棉子糖、半乳糖、果糖购自Sigma-Aldrich Co.(上海)。磷酸盐缓冲液(PBS,0.01 mol/L, pH 7.4)购自北京Solarbio科技有限公司(北京)。所有其他化学品均为分析级,并购自北京化工厂(北京,中国)。整个实验采用了超纯水。
1.2 电镜表征
采用清华大学高分辨蔡司场发射扫描电子显微镜(GEMINISEM 500),加速电压15 kV,获得扫描电镜(SEM)图像。
1.3 PU-Epoxy/GOD/Glutar/CA/Pt微型传感器制作方法
铂(Pt)丝电极由天津艾达公司生产,铂丝长度约为1 cm,直径约为0.5 mm。使用前,依次用1.0,0.05 μm氧化铝抛光粉打磨铂丝电极,在去离子水和无水乙醇中超声5 min,然后用去离子水彻底冲洗干净,氮气吹干。
将清洁的铂丝电极浸入放置在2 %CA的丙酮溶液中浸泡2 min,然后放在空气中干燥不同时间。之后将CA/Pt电极浸入2 %的戊二醛溶液4 h,再次洗涤自然干燥。然后将Glutar/CA/Pt电极放在不同浓度的GOD溶液中4 ℃孵育24 h。冲洗干燥后,将GOD/Glutar/CA/Pt电极浸入不同配比的PU-Epoxy溶液中浸泡2 s,取出后静置5 min,重复不同次数,之后放置在室温下干燥30 min,然后将电极放置在80 ℃恒温干燥箱中固化20 min,取出后用PBS冲洗干净晾干,得到PU-Epoxy/GOD/Glutar/CA/Pt电极。该微型传感器的制作过程如图1所示。
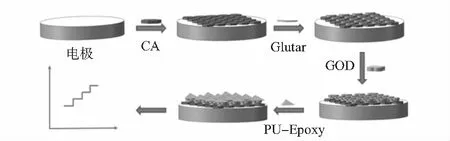
图1 植物葡萄糖微型传感器的制备过程示意
1.4 电化学测量
大部分电化学实验是在电化学工作站(CHI 660C,CH仪器,上海,中国)进行的,在室温下进行。在8通道CHI 1000C仪器上对盐胁迫下芦荟中的葡萄糖进行了实时检测。采用三电极系统。修饰后的铂丝电极作为工作电极,Ag/AgCl丝作为参比电极,另一根洁净的铂丝电极作为对电极。
1.5 活体实验
供试芦荟品种为“不夜城”,在大棚内已生长近3年。选取大小一致的芦荟,实验前需统一放置在光照充足的环境中培养1个月。
将PU-Epoxy/GOD/Glutar/CA/Pt电极、Ag/AgCl电极和铂丝电极分别插入芦荟叶部2 mm左右的深度,确保不穿透叶片,原位测定芦荟中葡萄糖含量。对于不同的植物,电极被尽可能地插入相同的位置。
在试验前和试验后,分别取10株芦荟的叶片样品,利用离子色谱法(北京市营养源研究所)测试其葡萄糖含量。并将微传感器输出与离子色谱法得到的葡萄糖含量数据进行对比,并利用两点校准法进行葡萄糖含量的计算。葡萄糖含量(G)从G1到G2(g/100 g),与传感器输出电流值为I1和I2(μA),传感器灵敏度S=(I2-I1)/(G1-G2),传感器理论输出值I0(在没有葡萄糖的情况下)=I1-(S(G1))。
2 结果与讨论
2.1 葡萄糖微型传感器修饰过程的形貌分析
利用扫描电镜(SEM)对Pt电极、CA/Pt电极、PU-Epoxy/GOD/Glutar/CA/Pt电极的形貌进行表征。Pt电极的扫描电镜图(图2(a))显示其表面清洁并且光滑,无其他杂质沉积于表面。如图2(b)所示,当CA修饰在在Pt电极上后,电极表面被覆盖了一层均匀的CA膜,CA的分子形如"米粒状",其直径约为10~15 μm。进一步修饰戊二醛、GOD及PU-Epoxy膜后(图2(c)),电极表面被一层致密的PU保护膜覆盖,状如弯曲的“脑回”,并具有孔状结构,孔的直径约为1~3 μm,从而可以允许葡萄糖等分子通过。

图2 SEM表征结果
进一步利用电化学工作站采用循环伏安法(CV)和电化学阻抗谱法(EIS)对传感器的各个制备步骤进行了表征。图3(a)显示了每个修饰步骤的CV曲线。裸Pt电极表现出Fe[(CN)6]4-/3-的可逆氧化还原行为,CA层修饰在Pt电极上后,Fe[(CN)6]4-/3-的氧化还原峰电流减小。进一步修饰Glutar及GOD后,Fe[(CN)6]4-/3-的氧化还原峰电流进一步减小。这说明GOD通过Glutar成功地交联到CA膜上。PU-Epoxy涂层在GOD/Glutar/CA/Pt电极上之后,Fe[(CN)6]4-/3-的氧化还原峰电流进一步减小,并且氧化还原曲线的可逆性变差,说明电极上已形成PU-Epoxy层。
图3(b)则显示了在电极修饰过程中阻抗变化,用一个简单的等效电路模型(图3(b)中的插图)来拟合阻抗谱。CA膜形成后,由于CA层阻断了电极表面的电子转移,电子转移电阻较裸Pt电极显著增加了24.3 kΩ。在GOD交联到电极表面的CA膜后,由于制备的层结构紧凑,Rct较之前明显增加至86.8 kΩ。在电极上形成PU-Epoxy层后,对应的Rct进一步增加。

图3 电极修饰过程中循环伏安曲线和Nyquist阻抗
2.2 葡萄糖微型传感器的制备优化
为了提高传感器的性能,对传感器的制备进行了优化。CA作为载体膜,能够增加GOD的固定量。对其干燥时间(30,60,90,120,150 min)进行了优化,利用葡萄糖浓度为50 mmol/L测定其i-t响应,如图4(a)所示,干燥60 min时,电极可以获得最高的电流响应,因此,后续试验的干燥时间选为60 min。
利用酶催化的葡萄糖传感器的分析性能高度依赖于GOD的用量,因此,针对不同浓度GOD(10,30,50,80,100 mg/mL)的优化是必不可少的。如图4(b)所示,应用本修饰方法时,当GOD浓度为80 mg/mL时,电极的电流响应最高,所以GOD的最佳浓度确定为80 mg/mL。
聚氨酯—环氧树脂(PU-Epoxy)具有多孔结构和长期稳定性,PU-Epoxy涂层可以有效地限制葡萄糖分子的扩散速率,减少氧含量的影响,同时还能抵抗其他生物分子的干扰[18]。针对聚氨酯与环氧树脂的配比进行了优化,采用了PU∶Epoxy(4∶6,5∶5,6∶4,1∶0)的不同配比,在葡萄糖浓度为50 mmol/L测定其i-t曲线,如图4(c)所示,可以看出电极在60 %环氧树脂/40 %PU时,电流的响应最高,所以认为60 %环氧树脂/40 %PU为最佳配比。其次针对电极在PU-Epoxy溶液中的浸泡次数(5,10,15,20,25次)也进行了优化,通过图4(d)可以看出,当浸泡次数为10次时,电流响应最好,因此确定PU-Epoxy的浸泡次数为10次。
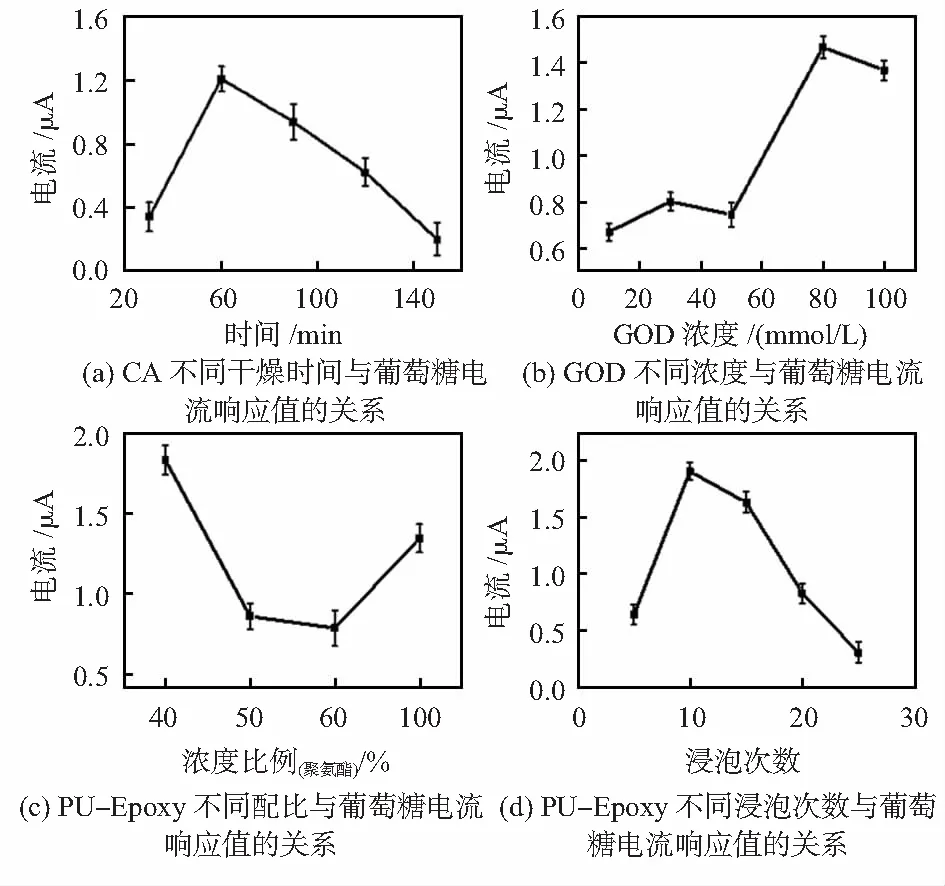
图4 制备优化
2.3 葡萄糖微型传感器的性能测试
采用PU-Epoxy/GOD/Glutar/CA/Pt葡萄糖传感器测定一系列浓度葡萄糖溶液的电流响应。将该传感器在PBS中得到稳定电流后,用微量注射器将2 mol/L葡萄糖溶液逐滴滴加至PBS溶液中,直至200 mmol/L,图5(a)显示其随时间的增加得到的葡萄糖浓度的电流响应曲线图,随着葡萄糖浓度的增加,电流响应值也越大, 右下插图为取其中一段放大图。图5(b)显示在葡萄糖浓度为1~200 mmol/L内,葡萄糖浓度与电流值成线性关系。线性方程为y=0.0068x+0.081,R2为0.992。通过实际检测,该传感器能够直接检测到0.1 mmol/L的葡萄糖,表明葡萄糖的检测限为0.1 mmol/L。该传感器的检测范围为1~200 mmol/L,能够覆盖大多数植物体内的葡萄糖含量,因此可以用于植物葡萄糖的活体检测。

图5 性能测试
同等实验条件下,采用同一根PU-Epoxy/GOD/Glutar/CA/Pt葡萄糖传感器,每间隔600 s测一次50 mmol/L葡萄糖的PBS溶液,并记录其葡萄糖溶液的电流响应值,连续测定10次。可以得到其电流响应值较为一致(RSD=8.85 %)。在同等实验条件下,同一根葡萄糖传感器每间隔2天测一次50 mmol/L葡萄糖的PBS溶液,共测定9次,记录其响应电流值,27天后,电极电流响应值仍与初始电流值相近。由此可知,该传感器具有良好的稳定性。
众所周知,植物中还有其他的可溶性糖,如乳糖、半乳糖、蔗糖等,可能会干扰对葡萄糖的检测。因此,对该传感器的选择性进行了测试。如图6所示,每种物质测试600 s,可以看出,葡萄糖传感器在保持对葡萄糖高灵敏度的同时,对其他的可溶性糖没有明显的响应。其结果表明该传感器具有良好的选择性。
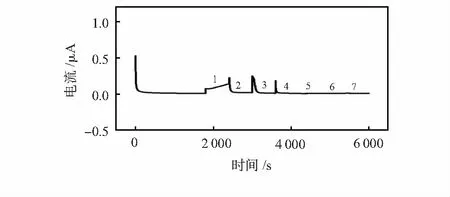
图6 葡萄糖传感器在0.01 mol/L PBS (pH 7.4)中连续添加50 mmol/L不同干扰物的i-t曲线:葡萄糖、半乳糖、蔗糖、乳糖、果糖、甘氨酸、山梨醇 (依次从1到7)
2.4 芦荟叶部葡萄糖浓度变化的活体实时监测
本实验用制备的微传感器对芦荟叶部葡萄糖浓度进行了活体实时监测。如图7所示,在测量的初始部分,传感器先处于自稳定阶段直到17 h,在19 h到第二天的7 h,可以看出芦荟体内葡萄糖含量较低;从第二天的7~18 h,芦荟体内葡萄糖含量明显增加,最大时为0.22 g/100 g,主要是由于白天植物自身的光合作用合成葡萄糖;18 h之后,芦荟进入夜晚时段,从图中可以看出其呈明显的下降趋势,最低时测得芦荟体内葡萄糖含量为0.042 g/100 g,主要是由于芦荟自身的呼吸作用消耗葡萄糖所致。结果表明研制的微型葡萄糖生物传感器能够测定芦荟叶部葡萄糖的实时变化。与传统技术相比,该传感器获得的信息能够更好地反映植物体内生理状态的实时变化,且微传感器的直径仅有0.5 mm,实时结束后经过长期观察,传感器的使用并不影响植物的正常生长。

图7 芦荟叶部葡萄糖浓度变化的活体实时监测
3 结 论
本文所研制的新型葡萄糖微型电化学生物传感器,利用葡萄糖氧化酶(GOD)特异性催化葡萄糖,通过固定醋酸纤维素(CA)提高葡萄糖氧化酶的固载量,通过聚氨酯—环氧树脂(PU-Epoxy)提高传感器的选择性和稳定性,该传感器的线性范围宽,检测限低,并且具有较高的灵敏度和选择性、良好的重现性及稳定性。并利用此传感器实时监测了植物活体内葡萄糖的含量变化,提供了植物体内代谢物质随环境变化的实时动态变化的信息。下一步的工作将进一步优化该微型传感器,并开发集成传感系统,以期真正应用于农业生产中。
