不同品种紫花苜蓿根系形态及生理特征对磷水平的响应
2021-03-26马红,孟捷,李宁
马 红,孟 捷,李 宁
(新疆农业大学草业与环境科学学院,新疆 乌鲁木齐 830052)
磷是植物生长发育必需的三大营养元素之一,在植物的光合作用、呼吸作用以及生理调节过程中起着不可替代的作用,也参与到植物体内的能量传输过程[1]。土壤中磷素的来源主要是化学肥料中的磷素输入,虽然外施磷肥能解决土壤中磷素匮乏的问题,但我国磷矿资源短缺,用于农业生产的磷肥尚需进口;且磷素在土壤中易被固定,仅处于根区表层的磷易被植物吸收利用[2-3]。我国大部分土壤中有效磷含量较低或结合态磷含量较高,已成为限制植物生产的最主要的因素之一[4]。利用植物自身磷吸收与转运高效的生物学特性来提高土壤磷肥的有效性,是解决土壤有效磷缺乏或磷利用效率低下问题的根本途径[5]。植物对土壤中磷的吸收主要依靠植物根系,良好的根系形态有助于植物对养分的高效利用,植物根系形态具有可塑性,可通过调节自身形态适应外界环境[6]。例如植物通过对根系形态变化以及生理调控来缓解低磷胁迫,这些调控包括根系变长,根体积、根冠比的增大以及根际磷酸酶活性的增加等[7]。研究发现缺磷条件下,大豆(Glycine max)通过增加根系分泌酸性磷酸酶来实现磷的高效利用,低磷处理下多个大豆品种根尖酸性磷酸酶活性之间存在显著差异,且低磷处理下的大豆根尖酸性磷酸酶活性高于正常磷处理[8],而辣椒(Capsicum annuum)则通过增加根系生物量及总根长来适应低磷的根际特征[9]。因此,植物磷高效利用的途径可能是综合根系形态和根际生理特征两方面。
我国是全球第二大苜蓿种植国,占全球种植面积的15%[10]。苜蓿作为西北干旱半干旱地区人工种植面积最大的优质多年生豆科牧草[11],是畜牧业生产中不可或缺的植物蛋白资源[12]。研究表明,施磷能提高紫花苜蓿(Medicago sativa)根瘤的固氮活性、促进根瘤的固氮能力,进而提高紫花苜蓿的饲草品质和干草产量[13]。紫花苜蓿作为喜磷作物之一,其生长过程中所需有效磷一般为10~15 mg·kg−1,但在生产中尤其是高产苜蓿田中,磷肥的合理施用还没有引起人们广泛关注[14]。已有研究证实,植物磷吸收利用效率的差异不仅出现在不同作物之间,同种作物的不同基因型之间也存在磷吸收的差异性[15]。所以提高紫花苜蓿磷吸收利用效率,解决苜蓿生产中有效磷缺乏的问题,可以考虑通过筛选耐低磷品种,挖掘紫花苜蓿自身遗传潜力,改善磷营养遗传特性等手段来实现。本研究通过设定6 种磷水平,研究了新牧一号、耐盐之星、陇东、龙牧801、肇东、巨能Ⅱ 6 种紫花苜蓿在不同磷浓度处理下的总根长、根表面积、根体积、根系磷吸收效率及根系酸性磷酸酶活性对磷肥的响应特征,以期为紫花苜蓿磷高效品种的选育、耐低磷性评价及土壤缺磷地区紫花苜蓿品种的选择提供科学依据。
1 材料与方法
1.1 供试材料与试验设计
试验于2019 年6 月 − 10 月在新疆农业大学草业与环境科学学院植物光照培养室、土壤与生态过程实验室开展。选取前期筛选出的具有磷效率差异的6 份紫花苜蓿种质材料(新牧一号、耐盐之星、陇东、龙牧801、肇东、巨能Ⅱ)。营养液采用改良的Hoagland 营养液配方(表1)[16],其中全量Hoagland营养液中铁盐溶液2.5 mL·L−1、微量元素5 mL·L−1,营养液中的磷源采用KH2PO4(分析纯)配制,用KCl调平钾离子。共设6 个磷水平,分别为0 (P0)、50 (P1)、100 (P2)、500 (P3)、1 000 (P4)和1 500 μmol·L−1(P5),以KH2PO4为磷源的Hoagland 营养液。挑选颗粒饱满、颜色纯正的紫花苜蓿种子,用75%酒精灭菌后晾干,置于含有滤纸的培养皿发芽。保持湿润条件,待幼苗生长10 d 时,即胚根长度约为3 cm 时移至长宽 高分别为38 cm × 27 cm × 14 cm 的含有改良的Hoagland 营养液的方形培养盆,每盆移植30 株,用定植棉和定植篮定植于方形培养盆,置于温室培养,光照条件为光照14 h/黑暗10 h,昼/夜温度为25℃/20 ℃,每4 d 换一次营养液,期间调节营养液pH 保持在6.0~6.3。紫花苜蓿幼苗在适磷(500 μmol·L−1KH2PO4)条件下生长10 d 后,即幼苗高度3 cm 左右时,按事先设定的6 种磷水平进行处理,每个处理重复4 次(即培养4 盆),共24 盆,且完全随机排列。连续处理50 d 后分别检测6 种磷处理条件下各紫花苜蓿相关性状指标,每个指标检测3 个重复,每个重复5 个单株。

表1 Hoagland 营养液配方Table 1 Hoagland nutrient solution formula
1.2 测定指标与方法
(1)根系形态指标:各重复随机取5 株剪取完整根系,用 Win RHIZO Pro V850Pro 加拿大根系扫描分析系统扫描,获得分辨率为300 dpi 的黑白根系扫描图像,进一步分析图像获得总根长、根表面积、根体积等参数。
(2)根系酸性磷酸酶活性(ACP):对硝基苯磷酸盐法测定[17]。
(3)植物磷素测定:H2SO4-H2O2消煮–钼锑抗比色法测定[18],将地上部与地下部分开测定。
(4)根系磷吸收效率 = 地上部含磷量/总根长[19]。
1.3 数据统计分析
利用Excel 2016 整理汇总数据,用SPSS 20.0 分别对不同磷水平处理下各品种紫花苜蓿测定指标进行ANOVA 单因素方差分析,并用Duncan 法对各测定数据进行多重比较,显著水平为0.05,用平均值 ± 标准误表示结果;Origin 2018 进行图表的制作。
2 结果与分析
2.1 紫花苜蓿根系形态特征对磷肥的响应
6 种供磷水平下,在同浓度磷处理时紫花苜蓿总根长在各品种间存在差异性(表2),其中新牧一号、耐盐之星、肇东、巨能II 4 个品种紫花苜蓿在低磷处理P1时总根长达到最大,而陇东、龙牧801 总根长分别在适磷P3、高磷P4处理下达到最大。新牧一号、龙牧801 根长最小值出现在P0磷处理下,肇东、巨能II 根长最小值出现在P4磷处理下,而耐盐之星、陇东的根长最小值出现在P5磷处理下。6 种磷处理下各品种总根长最大值与最小值相比,降幅具有明显差异,表现为新牧一号、耐盐之星、陇东、龙牧801、肇东、巨能II 总根长降幅分别达到29.8%、18.0%、12.9%、17.1%、27.1%和12.6%。在设定的 6种供磷水平下,P0时肇东根表面积显著低于(P <0.05)新牧一号、耐盐之星、巨能II;P1处理时新牧一号与耐盐之星显著高于陇东、龙牧801,陇东、龙牧801、肇东、巨能II 之间无显著差异(P > 0.05);P2处理时肇东显著低于其他5 个品种;P3处理时所有品种间无显著差异;P4处理时肇东显著低于(P < 0.05)耐盐之星、龙牧801;P5处理时耐盐之星显著高于新牧一号、陇东、龙牧801、肇东。新牧一号、耐盐之星、肇东、巨能II 4 个品种根表面积在P1低磷处理下出现最大值,在P4高磷处理下出现最小值;陇东、龙牧801 在P3适磷处理下出现最大值,在P5高磷
处理下出现最小值。设定的6 种供磷水平下,耐盐之星根体积仅在P0、P1处理时显著高于新牧一号、陇东、龙牧801;P2、P3、P4、P5处供磷水平下,根体积在各品种间并无显著差异。6 种紫花苜蓿根体积峰值均在较高磷水平时出现,其中陇东紫花苜蓿根体积在P1、P5处理下均小于其他品种。

表2 不同供磷水平下6 种紫花苜蓿根系性状分析Table 2 Morphological character analysis of six types of alfalfa under different phosphorus supply levels
2.2 紫花苜蓿根系磷吸收效率对磷肥的响应
6 种供磷水平下,不同品种紫花苜蓿根系磷吸收效率在同浓度磷水平时各品种间存在差异性(图1)。P0处理下新牧一号紫花苜蓿根系磷吸收效率高于其他5 个品种,P1处理下陇东根系磷吸收效率显著(P < 0.05)高于其他品种。P2处理下龙牧801 与肇东根系磷吸收效率显著高于其他品种,P3、P4处理下肇东根系磷吸收效率显著高于其他品种,P5处理下龙牧801 根系磷吸收效率显著高于其他品种。所有品种在P0处理下出现最小值,P4处理下新牧一号、耐盐之星、陇东、肇东达到峰值,龙牧801、巨能II在P5处理下达到峰值。除龙牧801 与巨能II 紫花苜蓿外,过高磷浓度P5对其他4 种紫花苜蓿根系磷吸收效率有抑制作用。
2.3 紫花苜蓿根系酸性磷酸酶活性对磷肥的响应
6 种供磷水平下,不同品种紫花苜蓿根系酸性磷酸酶活性在同浓度磷水平时各品种间存在差异(图2)。在P0、P1、P23 个低磷处理的6 个品种紫花苜蓿根系酸性磷酸酶活性高于P3适磷及P4、P5高磷水平。P1处理下,6 个品种根系酸性磷酸酶活性均达到最大值,其最小值均出现在P5处理下,且峰值分别为最小值的15.0、18.0、9.0、14.2、15.7 和22.5 倍。在P0、P1处理下,耐盐之星、巨能II 根系酸性磷酸酶活性显著高于其他4 个品种,表明在设定的6 种磷水平处理下,耐盐之星与巨能II 较其他品种具有较强的耐低磷性。

图1 磷水平对不同品种紫花苜蓿根系磷吸收效率的影响Figure 1 The effect of phosphorus level on phosphorus absorption efficiency of different alfalfa varieties
3 讨论与结论
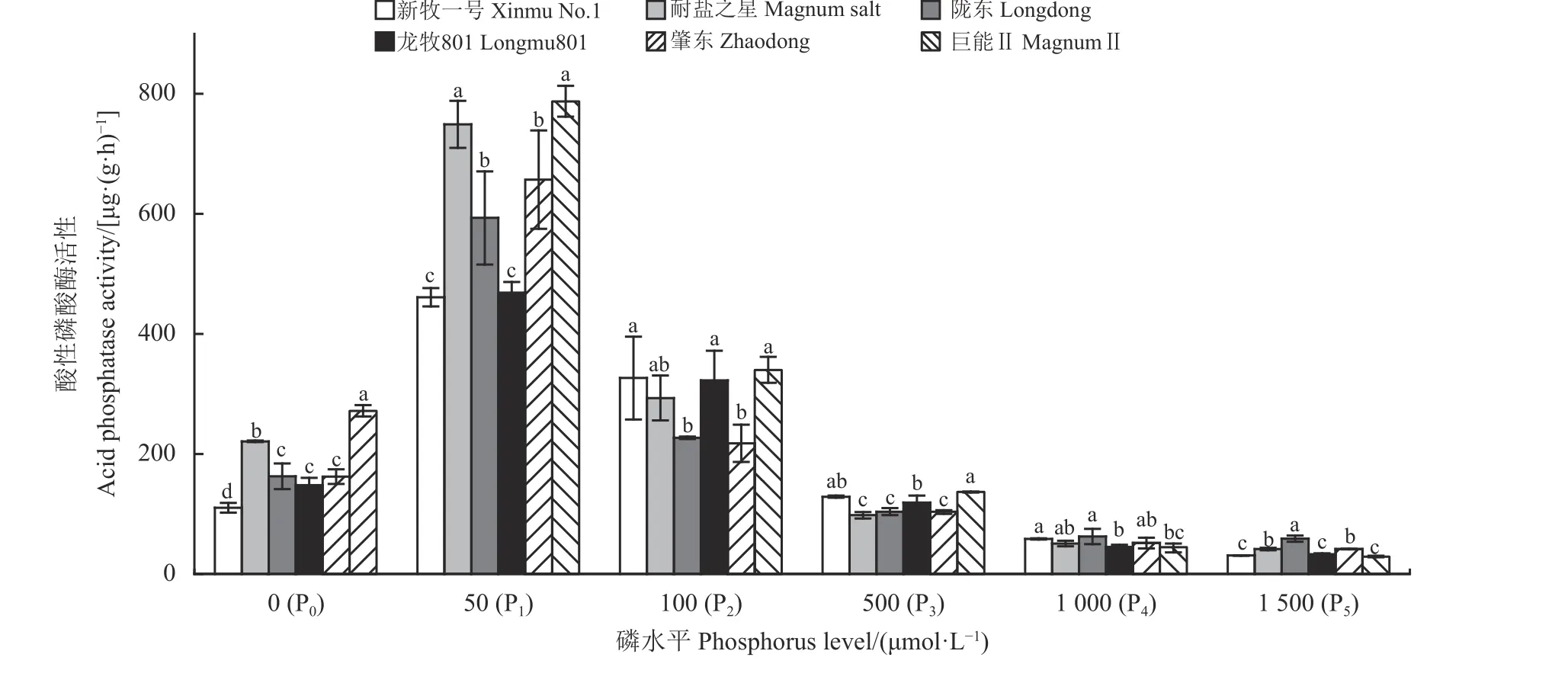
图2 磷水平对不同品种紫花苜蓿根系酸性磷酸酶活性的影响Figure 2 The effect of phosphorus levels on the acid phosphatase activity of different alfalfa roots
植物生长与新陈代谢的过程中都需要大量磷的参与,因此植物在生长过程中对外界低磷环境的刺激形成了一系列应激机制,保证在低磷环境中可以正常生长[20]。此外,低磷环境下植株可以通过转变自身的根系生长形态和根冠之间物质分配的变化,来促进根系吸收土壤中磷,增加植物磷的吸收效率,包括抑制主根的伸长、促进侧根的分布、增加根系表面积等[21]。陈波浪[22]在水培条件下,研究了2 种具有磷效率差异的棉花(Anemone vitifolia),发现磷高效品种具有较强的磷素利用效率和较好的根系形态参数。低磷时磷高效品种新海18 号总根长、根总表面积和根总体积均显著增加,而磷低效品种新陆早13 号总根长和根总表面积则显著下降,磷高效品种根系各参数均高于磷低效品种。本研究发现,在低磷处理下6 种紫花苜蓿总根长均大于正常磷处理时总根长,且在低磷水平下新牧一号、耐盐之星、肇东、巨能Ⅱ 4 个品种总根长、根表面积高于陇东、龙牧801,这可能是因为磷胁迫条件下,植物通过增加总根长、根表面积、根体积等应激反应来获取更多的养分,以维持自身正常生长,而新牧一号、耐盐之星、肇东、巨能Ⅱ 4 个磷效率较高的品种则会在相同条件下具有更大的根长、根表面积和根体积。同时发现磷胁迫条件下,新牧一号、龙牧801紫花苜蓿根系磷吸收效率要大于其他品种,即在低磷水平下,这两种紫花苜蓿较磷低效紫花苜蓿能够更好地发挥根系对磷的吸收与转运能力,使植株地上部磷吸收量大于其他品种紫花苜蓿,而过高磷浓度则会导致植株总根长减小,抑制植株正常生长。Marschner 等[23]研究结果显示,低磷胁迫会促使植物光合产物优先向根系分配,来加快根系生长,同时又相对抑制地上部分生长,植物根系生长量的相对增加被认为是植物应对磷缺乏的一种重要机制。本研究同样发现,低磷(P1、P2)水平下总根长明显增加,根系生长速度加快,显著高于高磷(P4、P5)水平。
低磷下植物根系分泌酸性磷酸酶也是植物适应低磷胁迫的重要机理[24]。研究发现,随着磷浓度的升高,植物根系酸性磷酸酶的活性下降,而当磷浓度降低时,酸性磷酸酶活性随之增强,说明在低磷胁迫下根系可以通过分泌更多的酸性磷酸酶以缓解低浓度磷的胁迫[25]。高彬等[26]指出,大豆(Glycine max)缺磷时根系磷含量降低,但根系组织酸性磷酸酶活性是全磷培养植株的1.3 倍。王伟伟等[27]研究表明,磷高效燕麦(Avena fatua)品种和磷低效燕麦品种在低磷胁迫下其根系和叶片分泌的酸性磷酸酶活性较正常磷水平显著升高。本研究结果显示,6 种紫花苜蓿根系酸性磷酸酶活性均在P1处理时达到最大,且低磷处理时所有品种根系磷酸酶活性均高于高磷P4、P5处理。6 种磷处理下耐盐之星、巨能Ⅱ紫花苜蓿根系酸性磷酸酶活性变化程度要大于其他品种,陇东、龙牧801 根系酸性磷酸酶活性变化幅度较其他品种小,说明其对磷浓度的变化反应不敏感。这表明,低磷胁迫能激发紫花苜蓿根系分泌更多酸性磷酸酶,促进植物根系对磷素的活化吸收,进而确保植物的正常生长。当磷素供应充盈时,根系周围磷营养也较为充足,根系可直接接触和吸收的磷素足够供应植株生长需求,根系酸性磷酸酶活性也随之下降。
综上所述,紫花苜蓿总根长、根表面积、根系磷吸收效率、根系酸性磷酸酶活性在同浓度磷水平时各品种间存在差异。从根系形态来看,新牧一号、耐盐之星、肇东、巨能Ⅱ 4 个品种紫花苜蓿在低磷(P2)水平时总根长、根表面积高于陇东、龙牧801,具有较强的耐低磷能力,陇东耐低磷能力最弱。从根系磷吸收效率来看,新牧一号、肇东、龙牧801 较其他品种具有较高的磷吸收效率,即较其他品种具有较强的耐低磷能力。从根系酸性磷酸酶活性来看,在低磷(P0、P1)水平下,耐盐之星、巨能Ⅱ 品种紫花苜蓿根系酸性磷酸酶活性显著高于其他4 个品种,较其他品种具有较强的耐低磷能力。各耐低磷指标比较发现,新牧一号、耐盐之星2 个品种紫花苜蓿的耐低磷能力要高于其他品种,是较好的磷高效紫花苜蓿品种;其次是肇东、巨能Ⅱ,而陇东、龙牧801,为磷低效品种。
