产新德里金属β-内酰胺酶大肠埃希菌耐碳青霉烯类药物相关机制研究和分子分型
2021-03-26傅芬蕊潘玉红曹颖平郑培烝
傅芬蕊,张 娅,潘玉红,曹颖平,郑培烝
大肠埃希菌是引起人类各种感染如泌尿道、呼吸道、创面伤口的感染以及菌血症常见的病原体之一。近年来,由于抗菌药物使用不规范,大肠埃希菌对抗菌药物的耐药性明显增强,出现耐碳青霉烯类药物的大肠埃希菌。根据全国耐药性监测网2018年的数据,大肠埃希菌对碳青霉烯类药物全国平均耐药率为1.5%。碳青霉烯类药物是目前临床上控制革兰阴性菌感染最有效的抗生素之一,对大肠埃希菌具有强大抗菌活性,一旦出现耐药,将使得感染后的治疗变得十分困难。
大肠埃希菌对碳青霉烯类药物最常见的耐药机制是产碳青霉烯酶[1]。碳青霉烯酶是指所有能水解碳青霉烯类的β-内酰胺酶,依据Ambler分子分类将碳青霉烯酶分为A类碳青霉烯酶、B类金属β-内酰胺酶(Metallo-β-lactamase,MBL)和D类苯唑西林酶(Oxacillinase,OXA)。自2009年在印度分离的大肠埃希菌中发现新德里金属β-内酰胺酶1(New Delhi metallo-β-lactamase-1,NDM-1)以来,产NDM型酶的大肠埃希菌在世界范围内被广泛报道,而亚洲大陆被认为是主要的流行区域,特别是中国和印度[2],目前已发现20多种型别的NDM。本文收集来自住院患者的耐碳青霉烯类药物大肠埃希菌8 株,对其耐药机制和分子分型进行研究,结果报道如下。
1 材料和方法
1.1菌株来源 从住院患者临床标本中分离的8株对亚胺培南耐药的大肠埃希菌。
1.2仪器与试剂 VITEK-2 compact全自动微生物分析仪、革兰阴性细菌鉴定卡(GN)、药敏卡片(AST-GN16)、亚胺培南Etest试纸条(法国生物梅里埃公司)、PCR扩增仪(美国Applied Biosystems公司)、凝胶成像分析系统(美国BIO-RAD公司)、Taq DNA聚合酶(2.5 U/μL)、dNTP(2.5 mmol/L)、DNA纯化回收试剂盒、质粒小提试剂盒及TOP10感受态细胞(北京天根生化科技有限公司)、pCR2.1载体(25 ng/μL)(美国Invitrogen生命技术公司)、M-H琼脂(英国Oxoid公司)、引物的合成及PCR产物测序(上海博尚生物技术有限公司)。
1.3 方 法
1.3.1菌株鉴定与药敏 使用VITEK-2 compact全自动微生物分析仪进行菌株鉴定和药敏。采用亚胺培南 Etest 试纸条对亚胺培南耐药性进行验证。药敏结果根据2019年CLSI的抗菌药物敏感性试验标准进行判断。以大肠埃希菌ATCC 25922为质控菌株。
1.3.2碳青霉烯酶基因检测及测序 煮沸法提取细菌DNA模板,采用PCR法扩增常见的A类碳青霉烯酶基因(KPC、GES、SME、IMI/NMC)、B类金属酶基因(NDM-like、IMP-like、VIM-like、SIM-1、GIM-1和SPM)、D类苯唑西林酶基因(OXA-23-like、OXA-24-like、OXA-58-like和OXA-143-like)和广谱β-内酰胺酶类耐药基因(SHV、TEM、CTX-M-1群、CTX-M-2群、CTX-M-8群、CTX-M-9群和CTX-M-25群)。PCR的扩增体系均为25 μL:上下游引物各0.5 μL(10 μmmol/L),1 μL模版DNA,2.5 μL 10×Taq Buffer,2 μL dNTP, 0.5 μL Taq聚合酶(2.5 U/μL),用灭菌水补足至25 μL。反应参数为:94 ℃ 预变性5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,循环30 次;72 ℃ 延伸10 min。扩增产物用1%琼脂糖凝胶进行电泳,凝胶成像分析系统进行结果观察。电泳阳性产物送测序公司纯化并双向测序,所得测序结果使用BLAST与GenBank中的序列进行比对。NDM-like基因阳性的标本再用NDM-full引物扩增NDM型基因全长,经测序确定具体的NDM基因型别。引物名称、引物序列及预计产物长度见表1。
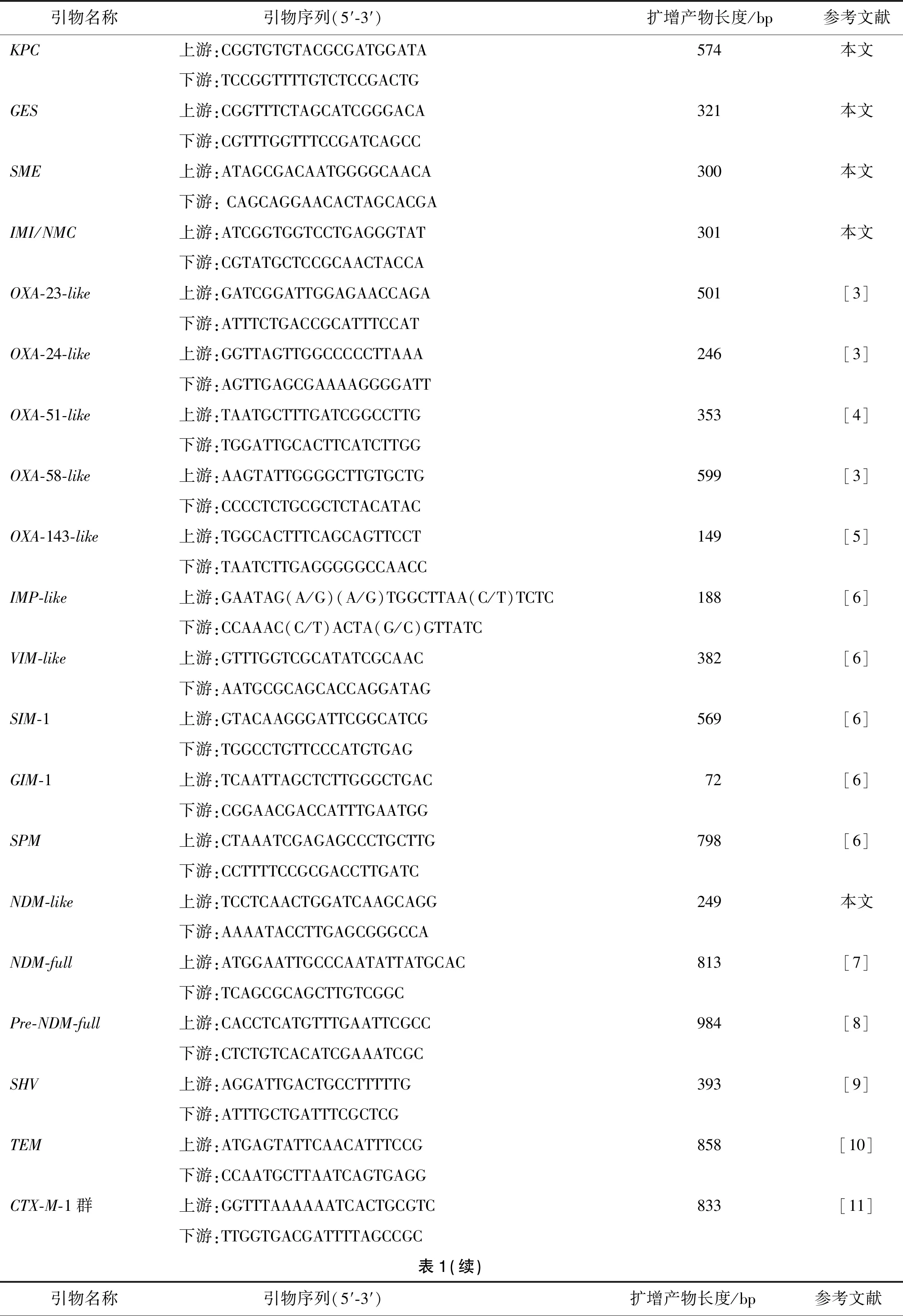
表1 扩增耐药基因相关引物信息Tab.1 Primer information for resistance gene amplification

CTX-M-2群上游:ATGATGACTCAGAGCATTCG865[12]下游:TGGGTTACGATTTTCGCCGCCTX-M-8群上游:ATGATAGAGACATCGCGTTAAG860[13]下游:CGGTGACGATTTTCGCGGCAGCTX-M-9群上游:ATGGTGACAAAGAGAGTGCA863[12]下游:CCCTTCGGCGATGATTCTCCTX-M-25群上游:CACACGAATTGAATGTTCAG923[14]下游:TCACTCCACATGGTGAGT
1.3.3NDM-1、NDM-6与NDM-9酶水解亚胺培南能力的比较 实验分为8组,见表2。分别扩增含与不含启动子序列的NDM-1、NDM-6及NDM-9型基因全长(携带NDM-1型基因的菌株来源于本实验室保存的菌株),引物分别为Pre-NDM-full与NDM-full,引物序列见表1,反应体系及条件同上。按DNA纯化回收试剂盒方法对上述基因全长进行纯化,根据pCR 2.1载体试剂说明书进行转化。根据抗性筛选与蓝白筛选挑选转化成功的重组TOP10感受态细胞,进行PCR检测耐药基因,测序证实转化是否成功和NDM型别是否正确,琼脂稀释法测亚胺培南MIC值。
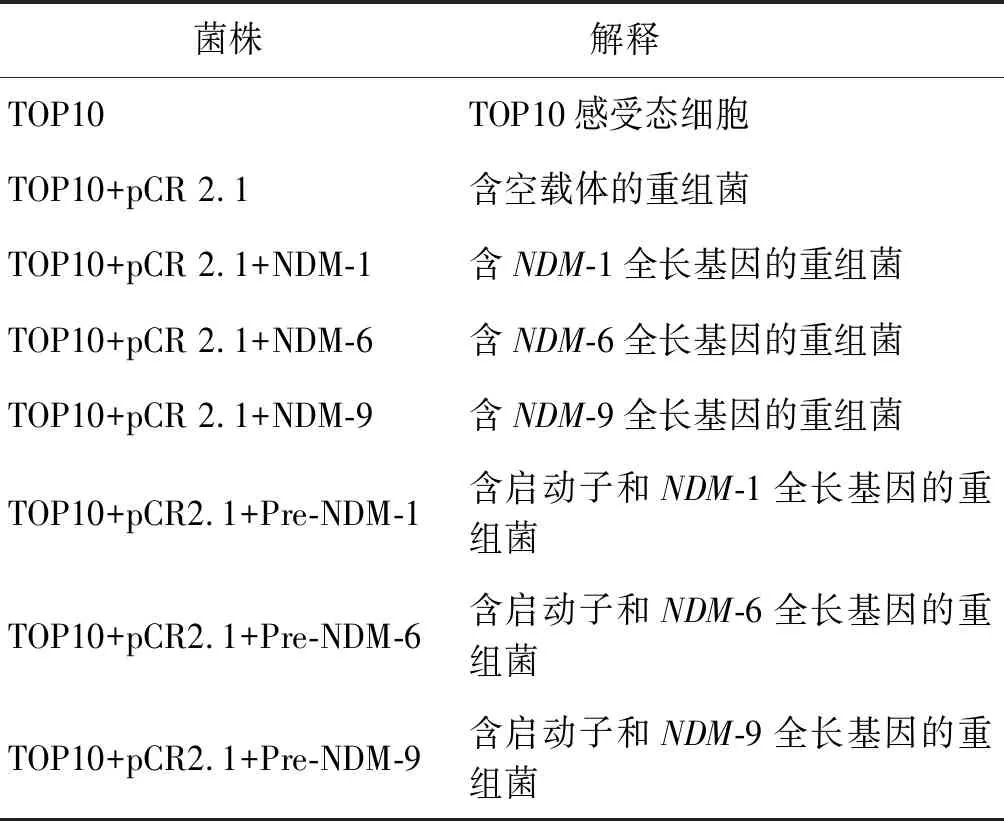
表2 NDM-1、NDM-6及NDM-9水解亚胺培南能力试验分组情况Tab.2 Grouped evaluation of the imipenem-hydrolysis ability of NDM-1, NDM-6 and NDM-9
1.3.4多位点序列分型(MLST) 对携带有NDM基因的8 株大肠埃希菌进行分型,PCR扩增7 个管家基因,即adk、fumC、gyrB、icd、mdh、purA和recA,所用引物序列及预计产物长度参考网站(https://enterobase.readthedocs.io/en/latest/mlst/mlst-legacy-info-ecoli.html)。PCR的扩增体系及扩增参数同上。扩增的PCR产物的测序结果提交到pubMLST数据库进行在线序列比对获得序列型。
2 结 果
2.1菌株鉴定与表型筛查结果 本次收集的8 株大肠埃希菌,经鉴定均为对亚胺培南不敏感的大肠埃希菌。经亚胺培南 Etest 试纸法验证所有菌株均对亚胺培南不敏感。见表3。
2.2碳青霉烯酶基因筛查与测序结果 8株对亚胺培南不敏感大肠埃希菌所测A类和D类碳青霉烯酶基因均为阴性,B类碳青霉烯酶基因中除NDM-like基因为阳性外,其余均为阴性;广谱β-内酰胺酶基因中7株TEM基因阳性,4株CTX-M-1基因阳性,1株CTX-M-9基因阳性,具体见表3。扩增8株NDM基因全长,电泳结果与预计条带大小(813 bp)相近,如图1所示。将PCR产物进行双向测序,序列经比对分析,6株为携带NDM-6基因,2株为携带NDM-9基因,见表3。
2.3NDM-1、NDM-6和NDM-9水解亚胺培南能力结果 以TOP10感受态细胞和含有空载体的重组菌作为阴性对照,仅含有NDM-1-full基因、NDM-6-full基因和NDM-9-full基因的重组菌,因不含启动子,NDM型基因无法表达,故表现为对亚胺培南敏感,与阴性对照组结果相同,MIC值均为0.25 μg/mL。而含有Pre-NDM-1-full基因、Pre-NDM-6-full基因及Pre-NDM-9-full型基因的重组菌对亚胺培南均耐药,对亚胺培南的MIC值分别为32 μg/mL、128 μg/mL和64 μg/mL。

表3 8株产新德里金属β-内酰胺酶大肠杆菌临床相关信息、耐药基因检测及分子分型结果Tab.3 Related clinical information, resistance gene detection and molecular typing of eight strains of Escherichia coli producing New Delhi metal β-lactamase
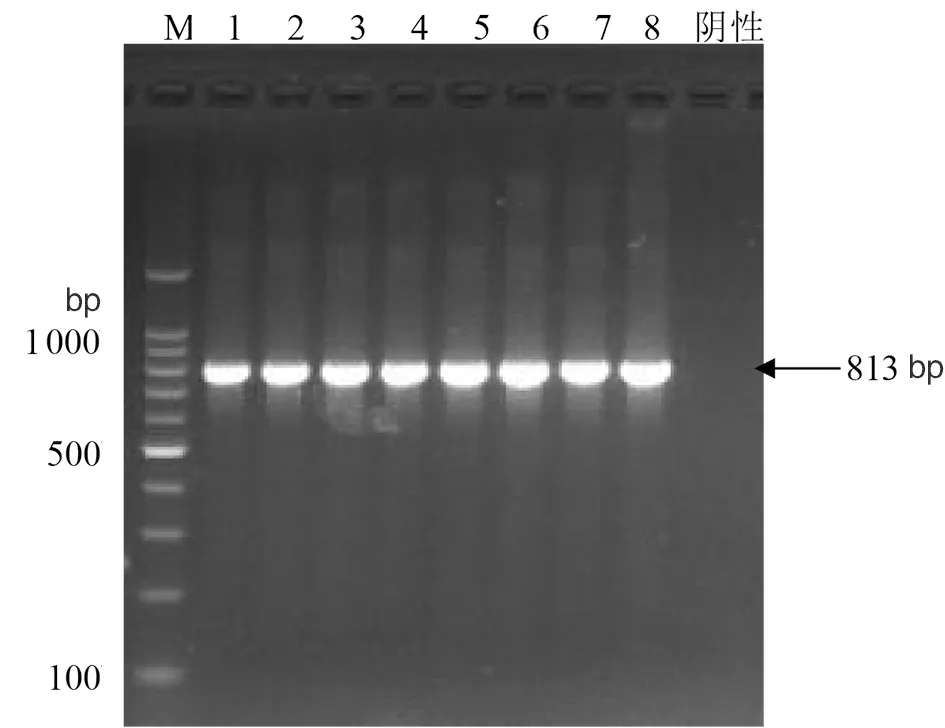
1-8分别为8株待检菌株;M为DNA marker;阴性为阴性对照图1 NDM基因扩增产物电泳图Fig.1 Electrophoresis of PCR products of the NDM gene
2.4MLST结果 对该8 株耐药大肠埃希菌进行分子分型, ST101型有5株、ST226、ST648和ST1284型各1株。 见表3。
3 讨 论
自2009年首次发现产NDM-1酶的菌株以来,产NDM型酶的菌株迅速向其他国家播散,在世界各地均有发现并报道。我国及世界上流行的分离菌中检出率较高的NDM型酶基因主要为NDM-1和NDM-5[15]。本次实验在8株大肠埃希菌中均检测出NDM基因,其中6株携带NDM-6基因,2株携带NDM-9基因。而NDM-6基因在2012年第一次从新西兰病人携带的大肠杆菌中鉴定出来以来[16],国内外关于NDM-6基因报道均较少见。NDM-9基因是我国学者2014年在肺炎克雷伯菌中首次报道发现[17],目前已在韩国、我国大陆及台湾地区等地均发现了携带NDM-9基因的大肠杆菌、肺炎克雷伯菌等细菌[18]。
为了进一步分析菌株耐药基因的携带情况,还筛查8 株耐药菌的广谱β-内酰胺酶基因,发现大肠埃希菌中存在多种耐药基因共存现象,几乎所有的耐药菌株均携带有TEM基因,4 株耐药菌同时携带有NDM-6、TEM和CTX-M-1基因,1 株同时携带NDM-6、TEM和CTX-M-9基因,目前国内外均未见此类报道。
本文结果显示NDM-1、NDM-6和NDM-9水解亚胺培南能力从强到弱依次为NDM-6、NDM-9和NDM-1,文献中未见同时比较以上3种型别NDM水解亚胺培南能力的报道。对于NDM型基因,目前已发现了20 多个型别,而它们之间大多只有几个碱基的不同。NDM-6基因、NDM-9基因与NDM-1基因的区别是分别在基因698 位置(C→T)和454位置(G→A)上存在有一个碱基的改变,从而导致氨基酸分别由丙氨酸转变为缬氨酸、谷氨酸转变为赖氨酸。氨基酸的改变会影响NDM蛋白的二级结构,可能改变NDM蛋白的空间结构,从而改变NDM与底物即碳青霉烯类药物的结合特性,表现出不同的水解能力。不同类型的NDM水解碳青霉烯类药物的具体机制有待进一步研究。
本次研究还采用MLST法对8 株耐药大肠埃希菌进行分型,结果为:5株携带NDM-6基因大肠埃希菌为ST101型,1株携带NDM-6基因大肠埃希菌为ST648型,有2株携带NDM-9基因大肠埃希菌分别为ST226型和ST1284型。在2012年首次报道产NDM-6基因的大肠埃希菌,其分型结果也为ST101型,而在国外报道,产NDM型基因的大肠埃希菌中,也有发现其MLST分型结果为ST101型[19],提示大肠埃希菌ST101型与NDM型碳青霉烯酶基因关系密切。ST648型大肠埃希菌常在产超广谱β-内酰胺酶的大肠埃希菌中发现[20],在英国、日本分别首次报道产NDM-5和NDM-7基因的大肠埃希菌,其分型结果均为ST648型[21],国内学者也有在ST648型大肠埃希菌中发现NDM-5基因,但并未检测出携带有NDM-6基因,国际上也并未发现携带有NDM-6基因的ST648型。产NDM基因的ST1284型大肠埃希菌在国内外鲜有报道发现,第一次在ST1284型大肠埃希菌中检出NDM-5基因是在2015年,而后虽有再次检出NDM-5基因,但到目前为止未检出携带有包括NDM-9基因在内其它NDM型基因。国内外均未在ST226型大肠埃希菌中发现NDM型基因。
本次分离的8 株耐药大肠埃希菌有5株MLST分型结果一致,均为ST101型,且均检出NDM-6基因。其中4株来自神经内科患者,1株来自康复科患者。通过查阅临床相关资料发现,这位康复科患者是在神经内科治疗一段时间后转入康复科的,且与2号患者曾在同一个病房治疗。2号患者长期卧床治疗,在其住院期间,3号、4号和5号患者也在神经内科治疗,而且3号和4号患者前后入住同一张病床。以上患者多为免疫力低下、有留置导尿管史和长期卧床的老年人。综合以上因素提示这些病人极有可能是在医院内发生了交叉感染。对此,临床上应尽量缩短留置导尿管的时间、合理使用抗菌药物、规范医护人员的操作和加强对各种医疗器械的消毒措施,同时应重视并加强院感监控力度,避免耐药菌株的传播和医院内感染的发生。
利益冲突:无
