制备大颗粒氯化钾的工艺条件优化试验研究
2021-03-26林泽中杜柄璇
林泽中,杜柄璇
(青海民族大学 化学化工学院,青海 西宁 810007)
氯化钾是高浓度的速效钾肥,其物理性质好,吸湿性小,属于生理酸性肥料,有助于农作物的生长。提高植物的抗病抗灾能力,提升植物钾元素的营养状况,是目前世界上使用量最大的一种钾肥。但在钾肥使用中,存在颗粒粒径小、质量轻、易被风吹散、不易运输和储存等弊端,因此不能保证钾肥全部进入植物根系周围土壤,从而造成浪费。结晶过程是利用溶液过饱和度为推动力,以制取高质量和适宜粒度的产品为目的,且具有粒径分布均匀、反应条件平稳、能耗低等优点,因此利用结晶制取大颗粒氯化钾对提高钾肥利用率有非常重要的价值和意义。此前,针对大颗粒氯化钾的制备进行了试验研究,但过程存在研究不全面、参数梯度范围太宽等弊端[1-7]。因此,笔者在上述研究的基础上,从不同温度下饱和氯化钾的自然冷却结晶、冷-热耦合结晶及其最佳配比、不同转速搅拌下的氯化钾结晶以及不同表面活性剂对氯化钾结晶的影响方面进行了工艺参数筛选和优化。
1 试验内容
1.1 试验药品与仪器
主要试验药品见表1。

表1 主要试验药品
试验仪器:TAS-990AFG Super原子(石墨炉)吸收光谱,DF-101S集热式恒温加热磁力搅拌器,DZF-6090F真空干燥箱,水银温度计,PL203 METTER TO-LEDO电子天平,380、830、2 360 μm(40、20、8目)分子筛。
1.2 试验方法
1.2.1自然冷却结晶
配制一定温度下100 mL的氯化钾饱和溶液,在一定时间里自然冷却结晶,固液分离,烘干,并分别用380 μm(40目)、830 μm(20目)、2 360 μm(8目)标准分样筛进行筛分。自然冷却结晶试验温度分别设定45、50、55、60、65、70、75、80 ℃,烧杯容量250 mL,结晶时间2 h。
1.2.2冷-热耦合结晶
配制不同温度的氯化钾饱和溶液,与35 ℃的氯化钾饱和溶液(体积比为1∶1)在250 mL的烧杯中进行混合、冷却,2 h后固液分离、烘干,并分别用380 μm(40目)、830 μm(20目)、2 360 μm(8目)标准分样筛进行筛分。该试验温度分别设定45、50、55、60、65、70、75、80 ℃。
1.2.3冷-热耦合结晶最佳配比
配制2个不同温度下的氯化钾饱和溶液,并按照一定体积比进行混合、冷却,2 h后固液分离,烘干,并分别用380 μm(40目)、830 μm(20目)、2 360 μm(8目)标准分样筛进行筛分。该试验选取65 ℃和35 ℃时的氯化钾饱和溶液,选取体积比为:1∶0.5、1∶0.3、1∶1、1∶2、1∶3和1∶4。
1.2.4不同转速搅拌下的氯化钾结晶
配制一定转速下的35 ℃与65 ℃(3∶1)混合的氯化钾饱和溶液,冷却,2 h后固液分离,烘干,并分别用380 μm(40目)、830 μm(20目)、2 360 μm(8目)标准分样筛进行筛分。该试验选取转速为5、10、20 r/min。
1.2.5不同表面活性剂对氯化钾结晶的影响
配制35 ℃与65 ℃(3∶1)的混合氯化钾溶液,在混合液中分别加入Na2S2O3、乳糖、十二烷基磺酸钠、氯化钡,冷却,2 h后固液分离,烘干。
2 结果与分析
2.1 自然冷却结晶
各温度自然冷却结晶,晶体粒径分布见表2。
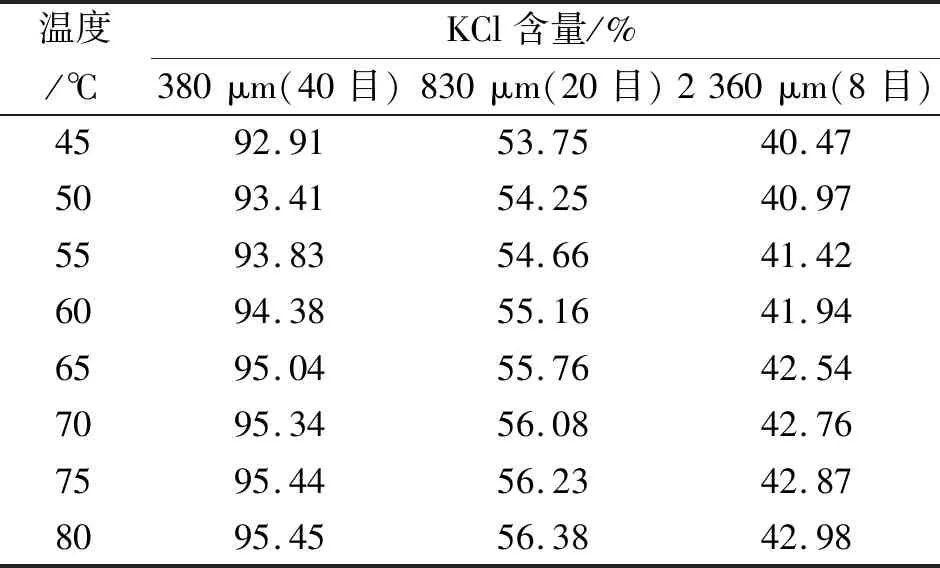
表2 不同温度KCl自然冷却结晶粒径分布
根据表2的试验结果,氯化钾晶体粒径随温度升高而增大,但在65 ℃以上,氯化钾的粒径增幅降低。具体表现为:若过饱和度处于稳定区,不会产生晶核,会继续溶解晶体;若过饱和度处于介稳区,只有在外界的干扰下通过成核,易生长形成平均粒度较大的晶体;若过饱和度处于不稳定区,则自发产生并快速析出较小晶核且难以控制。综合考虑,选取65 ℃下的氯化钾饱和溶液进行自然降温,可以得到2 360 μm以上的KCl晶粒。
2.2 冷-热耦合结晶
各温度溶液混合,晶体粒径分布见表3。

表3 35 ℃与不同温度溶液以体积比1∶1混合自然降温结晶粒径分布
根据表3的试验结果,并对照大颗粒氯化钾制备试验研究中表3的结果可知,35 ℃和65 ℃(1∶1)混合溶液与35 ℃和60 ℃(1∶1)混合溶液进行自然冷却结晶得到的粒径较大,前者2 360 μm以上的晶粒为60.82%,而后者则为59.98%[1]。因此,选取35 ℃与65 ℃(1∶1)混合溶液进行自然冷却结晶,有利于大颗粒氯化钾的制备。
2.3 冷-热耦合结晶最佳配比
不同体积比溶液混合,晶体粒径分布见表4。35 ℃与65 ℃的KCl溶液以1∶1和1∶3的体积进行混合的对比图见图1。
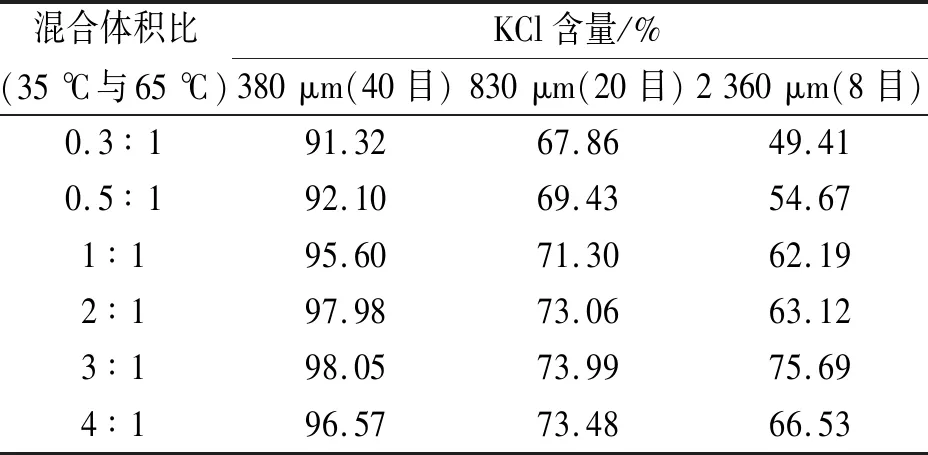
表4 65 ℃与35 ℃ KCl溶液以不同体积比得到晶体粒径分布

图1 35 ℃与65 ℃的KCl溶液以1∶1和1∶3的体积进行混合时的结晶图
根据表4的试验结果以及对照图1,晶体粒径有明显变化,35 ℃与65 ℃的KCl溶液以3∶1的体积进行混合时,得到的晶体晶形较大。具体表现为:35 ℃与65 ℃的KCl溶液以3∶1的体积进行混合时,过饱和度处于最佳范围,晶体易形成且形状易控制,得到的晶体也较为稳定。因此,选取35 ℃与65 ℃的KCl溶液以3∶1的体积进行混合时,有利于大颗粒氯化钾的制备。其中,2 360 μm以上晶粒的百分比为75.69%。
2.4 不同搅拌速率下的氯化钾结晶
35 ℃与65 ℃的混合KCl溶液以3∶1的体积比进行混合,不同转速搅拌下冷却结晶晶体粒径分布见表5。35℃与65℃的KCl溶液以3∶1体积比混合在转速为50 r/min和70 r/min的自然冷却结晶下的对比图见图2。
根据表5的试验结果以及图2对比,混合KCl溶液配制不同转速时,KCl晶体的粒径随着转速的增大而减小。具体表现为:搅拌会影响结晶器内的流场,搅拌的转速会影响二次成核,适当的搅拌有利于晶体粒径的生长,但转速过快不利于大颗粒的形成。因此,选取转速为50 r/min,有利于大颗粒氯化钾的制备。
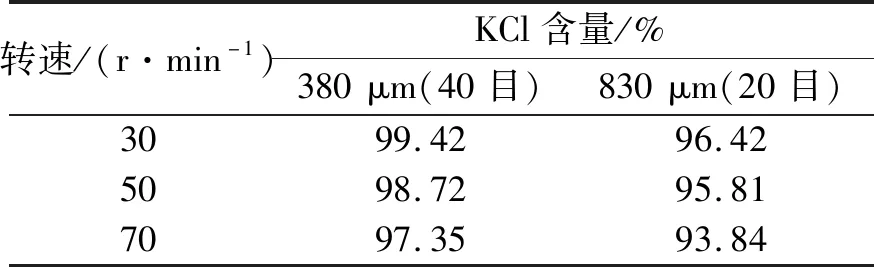
表5 不同转速下KCl晶体粒径分布

图2 35 ℃与60 ℃的KCl溶液以3∶1体积比混合在转速为50 r/min和70 r/min时的自然冷却结晶图
2.5 不同量的表面活性剂对氯化钾结晶的影响
35 ℃与60 ℃的KCl溶液以3∶1体积比混合时,加入不同质量Na2S2O3的KCl晶体分布见表6。在混合KCl溶液中加入6 g和8 g Na2S2O3自然冷却结晶下的对比图见图3。
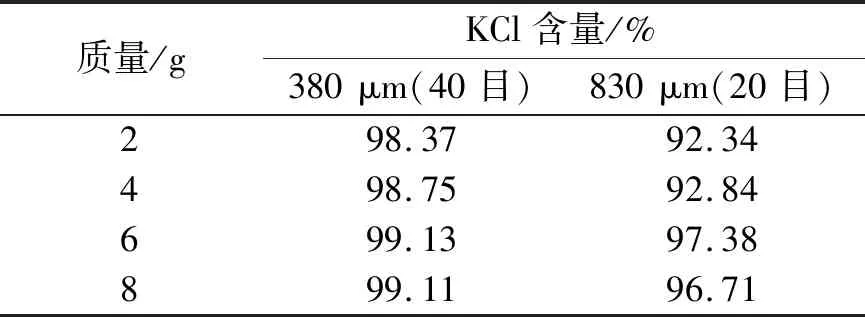
表6 混合KCl溶液中加入Na2S2O3的KCl晶体粒径分布

图3 混合KCl溶液中加入6 g和8 g Na2S2O3自然冷却结晶图
在35 ℃与65 ℃KCl溶液以体积比3∶1的混合,分别加入Na2S2O3试剂2、4、6、8 g;乳糖 0.5、1.0、2.0 g;氯化钡2、3、4 g;十二烷基磺酸钠0.5、1.0、1.5 g。实验表明:当加入乳糖无明显变化,且含有大量杂晶;加入十二烷基磺酸钠不利于大颗粒氯化钾结晶;加入3 g BaCl2变化不明显。根据表6的试验结果以及对比图3,当加入Na2S2O36 g和8 g时可得到大颗粒氯化钾,但加入8 g Na2S2O3的KCl结晶中含有较多杂晶。因此,综合考虑,在35 ℃与65 ℃的混合KCl溶液(体积比3∶1)中选择加入6 g Na2S2O3有利于大颗粒氯化钾的制备。
3 结论
以大颗粒氯化钾制备试验研究为基础和对照,笔者针对大颗粒氯化钾的制备进行一系列优化试验。结果表明:①35 ℃与65 ℃的混合KCl溶液(体积比3∶1)比35 ℃与60 ℃的混合KCl溶液(体积比3∶1)在自然冷却结晶下更有利于大颗粒氯化钾的制备。②适当的搅拌有利于晶体粒径的生长,但转速过快不利于大颗粒的形成。因此,选取转速为50 r/min,有利于大颗粒氯化钾的制备。③Na2S2O3、BaCl2有利于得到大颗粒氯化钾,乳糖对KCl颗粒的生长不明显,十二烷基磺酸钠不利于大颗粒氯化钾的形成。综上所述,在35 ℃与65 ℃的混合KCl溶液中(体积比3∶1)加入6 g Na2S2O3,并在转速为50 r/min的自然冷却结晶下,有利于大颗粒氯化钾的制备。
