利用CRISPR/Cas9技术敲除OsEIL1和OsEIL2基因改良水稻耐盐性
2021-03-26莫天宇徐善斌邹德堂王敬国刘化龙赵宏伟郑洪亮
莫天宇,徐善斌,邹德堂,王敬国,刘化龙,孙 健,贾 琰,赵宏伟,郑洪亮
(东北农业大学 寒地粮食作物种质创新与生理生态教育部重点实验室,黑龙江 哈尔滨 150030)
盐胁迫会抑制植物体内的蛋白质合成、降低光合效率、造成离子失衡以及高渗透胁迫、导致植株萎蔫和细胞凋亡[1],使作物大幅度减产,已成为影响作物生长发育的重要环境因素。近年来,伴随灌溉方式不当、过度施用化肥与工业污染等问题的出现,土壤盐渍化程度不断加重[2]。据统计,全球已有约6%的土地遭受盐害侵袭[3]。我国盐渍土总面积约为0.36亿hm2,占全国可利用土地总面积的4.88%,并以每年1%的速度增加[4]。
水稻(Oryzasativa)是世界上主要的粮食作物之一,全球有超过一半的人口以稻米为主食[5-6]。水稻是一种盐敏感作物,在遭受盐胁迫后会导致产量急剧下降[7]。因此,提高水稻耐盐性,创制耐盐性水稻种质是水稻育种的一个重要目标。近些年来,水稻中已经有很多盐胁迫相关的基因被克隆,如OsDST、OsSOS1、OsHKT、OsWRKY13、OsSNAC1、OsMYB、OsNAC等[8-14]。OsEIL1和OsEIL2基因是拟南芥EIN3在水稻中的同源基因,二者均为转录因子[15]。Yang等[16]研究表明,OsEIL1基因突变会导致水稻根生长对乙烯钝感,OsEIL2基因突变后水稻胚芽鞘生长对乙烯钝感,此外,OsEIL1和OsEIL2基因会结合OsHKT2;1基因启动子的EBS(EIN3-bindingsites)区域,促进OsHKT2;1基因的转录,OsEIL1和OsEIL2基因突变后会导致OsHKT2;1基因表达量下调,从而减少盐胁迫下根对钠离子的吸收,进而增强水稻的耐盐性。
CRISPR/Cas9技术是继ZFN技术和TALEN技术之后的第三代基因编辑技术[17-19]。CRISPR/Cas9系统由sgRNA(Single guide RNA)和Cas9(CRISPR associated protein 9)核酸酶2个部分构成,其中,sgRNA是一个具有颈环结构的单链RNA,起识别靶序列和连接Cas9核酸酶的作用,Cas9是一种限制性核酸内切酶,具有RuvC和HNH 2个核酸酶结构域,分别起到切割DNA正反双链的作用。Cas9核酸酶的识别位点被称为PAM(Protospacer adjacent motif),序列为NGG,Cas9在识别到PAM位点之后会在其上游第3或第4个碱基处造成DNA双链断裂[20],DNA双链断裂后会触发生物体的同源重组(HDR,Homologous direct recombination)修复和非同源末端连接修复(NHEJ,Nonhomologous end joining),其中,同源重组修复会导致碱基的插入或替换,非同源末端连接修复会导致碱基的插入或缺失,从而达到基因敲除的目的[21]。
目前,CRIPSR/Cas9技术已经在多种作物中进行应用,如水稻[22-23]、小麦[24-25]、大豆[26-27]、玉米[28-29]、高粱[30]等。在水稻中,Wang等[31]利用CRISPR/Cas9技术对水稻3个减数分裂相关基因:OsREC8、OsPAIR1、OsOSD1和一个单倍体诱导基因OsMTL进行敲除并获得了水稻无性繁殖的后代,实现了杂交水稻F1杂合性状的固定。Tang等[32]利用CRISPR/Cas9技术敲除水稻中镉离子运输基因OsNramp5降低了水稻镉离子含量。Zhang等[33]利用CRISPR/Cas9技术敲除水稻OsRR22基因获得了耐盐性增强的水稻突变体。
本研究以粳稻品种东农427为研究材料,利用CRISPR/Cas9技术同时对耐盐负调控基因OsEIL1和OsEIL2进行敲除以期获得耐盐性提高的水稻突变体材料,为粳稻耐盐性种质资源改良提供理论指导。
1 材料和方法
1.1 试验材料
本研究以粳稻品种东农427为试验材料,试验所用菌株大肠杆菌(Escherichiacoli)感受态Mach1-T1和农杆菌(Agrobacteriumtumefaciens)感受态EHA105均购自上海唯地生物技术有限公司,PrimerStarGXL、BsaⅠ核酸内切酶购自NEB公司,T4DNA ligase 购自宝生物(大连)有限公司。试验所用载体pYL-U3-gRNA、pYL-U6a-gRNA和pYLCRISPR/Cas9-MTmono双元载体由华南农业大学刘耀光院士惠赠。
1.2 敲除靶点设计及载体构建
靶点设计:在RAP(https://rapdb.dna.affrc.go.jp/index.html)数据库下载OsEIL1(Os03g0324300)和OsEIL2(Os07g0685700)基因序列,序列比对发现OsEIL1和OsEIL2的CDS序列存在较高的相似度,因此,利用CRISPR-GE在线工具包(http://skl.scau.edu.cn)[34]在OsEIL1和OsEIL2基因靠近5′端的高度同源区域设计一个敲除靶点,保存接头引物序列。本研究中使用的所有引物均由哈尔滨博仕生物技术有限公司合成(表1)。
参照Ma等[35]的试验方法进行载体构建。
接头制备:将合成好的接头引物原液(100 μmoL/L)各取1 μL混合,加98 μL 0.5×TE Buffer稀释至1 μmoL/L,90 ℃ 30 s后移至室温冷却退火,进行连接头反应。
gRNA表达盒制备:利用酶切法将退火后的双链接头连接到pYL-U3-gRNA载体上,反应体系(10 μL):pYL-U3-gRNA 1 μL,退火后的接头产物1 μL,10×DNA ligase Buffer 1 μL,BsaⅠ限制性内切酶(10 000 U/mL)0.5 μL,T4连接酶(400 000 U/mL) 0.1 μL,ddH2O 6.4 μL。反应程序:37 ℃ 5 min,20 ℃ 5 min,共5个循环。取1.5 μL反应产物作为PCR模板,用上游引物U-F和下游引物gRNA-R进行一轮PCR扩增,反应体系(10 μL):连接头产物1.5 μL,5×PS Buffer 2 μL,U-F/gRNA-R引物(10 μmol/L)各0.2 μL,dNTP(2 mmol/L) 0.6 μL,PrimeStarGXL 0.1 μL, ddH2O 5.4 μL。反应程序:98 ℃ 预变性2 min;98 ℃ 10 s,60 ℃ 10 s,72 ℃ 20 s 共25个循环。将1轮PCR产物稀释20倍后取1 μL为模板,用B1′和BL引物进行第2轮PCR扩增。反应体系(20 μL):稀释后的一轮PCR产物1 μL,5×PS Buffer 2 μL dNTP(2 mmol/L) 1 μL,B1′/BL引物(10 μmol/L)各0.3 μL,PrimeStarGXL 0.2 μL,ddH2O 12.2 μL。反应程序:98 ℃预变性2 min;98 ℃ 10 s,60 ℃ 10 s,72 ℃ 30 s 共25个循环。琼脂糖凝胶电泳检测PCR产物,切胶回收g-RNA表达盒。
CRISPR/Cas9表达载体构建:将二轮PCR胶回收产物克隆到pYL-CRISPR/Cas9-MTmono载体,反应体系(15 μL):二轮PCR胶回收产物2.5 μL,pYL-CRISPR/Cas9-MTmono质粒0.6 μL,BsaⅠ核酸内切酶1 μL,10×cutsmart Buffer 1.5 μL,ddH2O 8.8 μL,PCR反应37 ℃ 15 min后暂停程序,加入T4Ligase Buffer 1.5 μL,T4Ligase 0.1 μL,PCR反应 37 ℃ 5 min,10 ℃ 5 min,20 ℃ 5 min,共15个循环。

表1 本研究中使用的引物Tab.1 Primers used in this study
1.3 质粒扩繁及阳性克隆筛选
将连接产物通过热激法转化至Mach1-T1感受态大肠杆菌中,在含有卡那霉素(50 mg/L)的LB培养基上涂板培养,挑取单菌落,用NOS-F和T1-R引物进行PCR检测阳性菌落,阳性菌落接种于含有卡那霉素(50 mg/L)的LB液体培养基,37 ℃,160 r/min过夜摇菌,用康为世纪公司(北京)的高纯度小量质粒提取试剂盒抽提质粒。抽提好的质粒用AscⅠ内切酶进行酶切检测,将酶切检测正确的质粒通过热激法转入到EHA105感受态农杆菌中。
1.4 T0植株获得及突变情况、潜在脱靶效应检测
用携带载体的农杆菌侵染水稻品种东农427的愈伤组织,潮霉素筛选出阳性愈伤组织并分化成T0植株。采用CTAB法[36]提取T0植株全基因组DNA,以潮霉素基因特异性引物Hyg-F和Hyg-R进行PCR扩增,检测阳性植株。设计引物OsEIL1-T1-F/R和OsEIL2-T1-F/R扩增OsEIL1和OsEIL2基因靶点及其附近的序列,对所有转基因阳性植株进行分析,PCR产物送至擎科生物技术有限公司(北京)进行测序,测序结果使用兼并序列解码(DSDecode)方法进行分析[37]。
利用CRISPR-GE在线工具包预测潜在脱靶位点,选择分值最高的5个位点作为潜在脱靶位点,利用PCR扩增测序分析所有T0突变植株的脱靶效应。
1.5 T1纯合突变植株及无T-DNA元件植株的筛选
在田间选取T1植株50株挂牌,取叶片提取全基因组DNA,利用OsEIL1-T1-F/R和OsEIL2-T1-F/R引物PCR测序,筛选出纯合双基因纯合突变的植株,再利用Hyg-F和Hyg-R引物在纯合的植株中筛选无T-DNA元件插入的植株,将这些植株自交繁殖至T2。
1.6 T2植株盐胁迫鉴定
取野生型种子与突变体种子于28 ℃浸种萌发3 d后加入Hoagland营养液,转移至培养箱中培养,培养温度为26 ℃,设置光周期为16 h光照(3 000 lx)8 h黑暗。幼苗培养28 d后加入200 mmol/L的NaCl溶液进行盐处理,同时设置对照,处理5 d后分别测量突变植株和野生型植株的鲜质量和干质量,并收取处理条件下突变植株和野生型植株的地上部分和地下部分,利用火焰光度法[38]测量Na+、K+离子含量。将盐处理后的植株换成营养液进行恢复处理,7 d后观察处理前后野生型幼苗和突变体幼苗的长势,统计幼苗存活率。
1.7 T2植株农艺性状考察
在大田环境下种植东农427野生型和T2无T-DNA元件插入的纯合突变体材料,成熟时期测量株高、有效穗数、穗粒数、结实率和千粒质量。
2 结果与分析
2.1 水稻OsEIL1和OsEIL2敲除靶点设计及载体构建
根据水稻OsEIL1和OsEIL2基因序列比对结果(图1),在两基因高相似度区域设计1个敲除位点(图2),利用单个sgRNA同时敲除2个基因,将构建好的载体命名为pYLCRISPR/Cas9-OsEIL1-OsEIL2,载体图谱如图3所示。
2.2 T0转基因阳性苗检测及突变情况、脱靶情况的分析
通过农杆菌介导法将基因编辑载体转入到受体材料东农427中,在T0共获得30株再生植株,用载体特异性引物Hyg-F/R进行PCR检测,筛选阳性植株,结果表明,30株再生植株中有25株为阳性苗,阳性率为83.3%(图4)。
利用特异性引物OsEIL1-T1-F/R和OsEIL2-T1-F/R扩增25株阳性植株的靶点区域序列并将PCR产物进行测序,测序结果表明,25株阳性植株中有5株(eil1-eil2-9、eil1-eil2-12、eil1-eil2-13、eil1-eil2-16、eil1-eil2-25)发生了突变(图5),突变率为20.0%,其中,OsEIL1基因突变植株有5株,1株为双等位突变,4株为杂合突变,OsEIL2基因突变植株有1株,突变类型为纯合突变(表2),eil1-eil2-9植株为OsEIL1和OsEIL2基因同时发生突变。对5株T0突变植株的潜在脱靶位点进行了分析,测序结果表明,5株T0突变植株均未发生脱靶效应(表3)
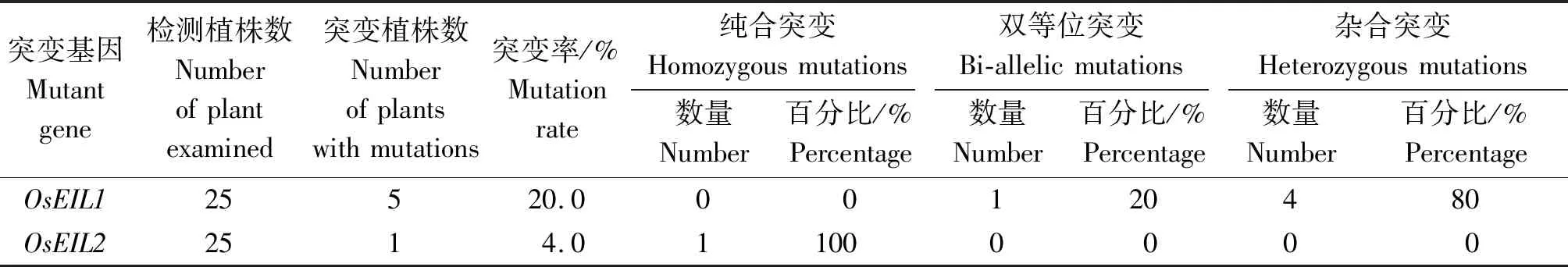
表2 T0转基因植株突变检测Tab.2 Mutation detection of T0 plants
2.3 无T-DNA元件的双基因纯合突变植株的筛选
将双基因突变植株eil1-eil2-9自交繁殖获得T1种子,将T1种子种成株行,随机挑选50株挂牌提取全基因组DNA,利用OsEIL1-T1-F/R和OsEIL2-T1-F/R筛选出双基因纯合突变植株16株,其中,OsEIL1和OsEIL2基因的突变方式均为单碱基插入,OsEIL1基因起始密码子(ATG)后第372和第373个碱基之间插入“A”导致该蛋白在第278个氨基酸处翻译提前终止,OsEIL2基因起始密码子(ATG)后第384和第385个碱基之间插入“T”导致该蛋白在第535个氨基酸处翻译提前终止。进一步利用Hyg-F/R引物在16株纯合突变植株中筛选出4株无T-DNA元件插入的植株,留种,自交加代,获得T2突变株系,将该株系命名为eil1-eil2HM(图6,7)。
2.4 T2植株耐盐性鉴定
将eil1-eil2HM突变株系进行苗期盐处理,处理前,突变体与野生型植株的长势、鲜质量和干质量与野生型差异不大。用含有200 mmol/L NaCl的营养液处理5 d后,野生型植株的长势受到了明显的抑制,而突变体植株的长势受到部分抑制,大部分植株仍继续存活(图8-A)。在鲜质量和干质量方面,盐处理后突变体植株的鲜质量和干质量均显著高于野生型植株(图8-B,C);在Na+离子含量方面,突变体植株的地上部及地下部Na+含量均显著低于野生型植株(图8-D);在K+离子含量方面,突变体植株地上部及地下部钾离子含量均与野生型植株差异不显著(图8-E);在换成正常营养液恢复7 d后,野生型植株基本全部死亡,存活率为8.3%,而突变体植株仍有大部分存活,存活率为75.0%(图8-F)。
2.5 T2植株农艺性状考察
在成熟期对野生型和突变体植株的农艺性状进行调查,结果表明,野生型植株与突变体植株在株高、有效穗数、穗粒数、结实率和千粒质量上无显著差异(图9-A-F)
3 结论与讨论
CRISPR/Cas9被称为继ZFN和TALEN之后的第3代基因编辑技术,因其具有构建简单、高效定点编辑等优势而广泛应用于作物种质改良,与传统育种相比,CRISPR/Cas9系统可高效快速定点编辑目标基因,改良受体材料的性状,通过自交,在T1或T2即可获得纯合突变且不含T-DNA元件插入的突变株系,极大地缩短了水稻育种的周期。
本研究以耐盐负调控基因OsEIL1和OsEIL2为目标基因,通过序列比对的方式,在OsEIL1和OsEIL2高相似度区域设计一个sgRNA同时对这2个基因进行敲除。在T025株转基因苗中获得了5株突变植株(突变率为20.0%),该频率显著低于前人的研究结果[35, 39],推测可能与本研究所用的受体材料和sgRNA序列位点有关。有研究表明,CRISPR/Cas9系统在动物或植物中均可能发生脱靶效应[40-41],选择了5个与sgRNA序列最相近的位点作为潜在脱靶位点,并对T0的5株突变植株进行PCR测序,结果表明,5株突变植株均未发生脱靶效应。将T0双基因突变的植株进行自交,在T1筛选出纯合突变,且不含T-DNA元件插入的植株。纯合突变植株的OsEIL1和OsEIL2基因的突变类型均为单碱基插入,OsEIL1基因为“A”碱基插入,OsEIL2基因为碱基“T”插入。氨基酸序列比对结果显示,OsEIL1和OsEIL2基因单碱基插入后均引起了移码突变,导致翻译提前终止进而引起该蛋白不能发挥正常的生物学功能,由此可导致OsHKT2;1基因表达量下调,从而减少盐胁迫下根对钠离子的吸收,进而增强水稻的耐盐性。
将T2纯合突变株系进行苗期耐盐性鉴定及农艺性状调查,结果表明,OsEIL1和OsEIL2基因突变后,植株对Na+的吸收减弱,从而减轻了Na+毒害,最终提高了水稻的耐盐性。在成熟期对野生型植株和突变体植株的农艺性状进行考察,OsEIL1和OsEIL2基因突变后植株的株高、有效穗数、穗粒数、结实率和千粒质量均未发生显著变化,说明OsEIL1和OsEIL2基因突变并未对植株的主要农艺性状造成影响。
综上所述,本研究以粳稻品种东农427为材料,通过CRISPR/Cas9技术对OsEIL1和OsEIL2基因进行定点敲除并获得了双基因纯合突变且不含T-DNA元件的突变体材料,突变体材料的耐盐性明显提升且主要农艺性状未受到影响。该结果为耐盐水稻品种的培育提供了理论和材料基础。
