甲钴胺对牙髓干细胞体外成神经向分化的影响
2021-03-26吴作栋潘爽李艳萍何丽娜张维甲牛玉梅
吴作栋,潘爽,李艳萍,何丽娜,张维甲,牛玉梅
(哈尔滨医科大学附属第一医院牙体牙髓病科,哈尔滨 150001)
面神经损伤是口腔科常见疾病之一,可由外伤、肿瘤、炎症以及医源性损伤引起,会导致患者出现语言障碍、进食困难、无法传达面部表情等,严重影响患者身心健康。目前神经损伤的治疗仍是临床上的挑战之一,近年来应用干细胞治疗神经损伤成为研究热点。干细胞能够增强运动神经元的再生能力,并且干细胞可以分化为神经元样细胞以代替受损的神经元,恢复神经支配以避免肌肉的早期萎缩[1-2]。牙髓干细胞和神经细胞均起源于神经嵴细胞,有较强的神经分化潜能,可分化为功能性神经元以及神经胶质细胞,还能分泌和表达多种神经营养因子。牙髓干细胞可通过拔除的阻生第三磨牙获取,是较为理想的替代受损神经细胞的来源[3-4]。甲钴胺是内源性维生素B12,在维生素B12中心的钴分子上结合了1个甲基,其活性更高,可促进核酸、蛋白和脂肪的代谢。甲钴胺是甲硫氨酸合成酶的辅酶,在高半胱氨酸向甲硫氨酸转化过程中起重要作用。神经组织发生损伤时,甲钴胺可以促进损伤区域施万细胞的分裂以及髓鞘的再生,从而促进受损神经恢复,是临床上治疗神经系统病变的常用药物[5]。研究表明,甲钴胺能够诱导大鼠的骨髓间充质干细胞分化为神经元样细胞[6],而甲钴胺对牙髓干细胞成神经向分化的影响鲜有报道。本研究主要分析甲钴胺对牙髓干细胞成神经向分化的作用,以期为临床上应用甲钴胺及牙髓干细胞治疗面神经损伤提供理论参考。
1 材料与方法
1.1主要试剂和仪器 甲钴胺(上海阿拉丁生化科技股份有限公司生产,批号:20191203),0.25%胰酶/乙二胺四乙酸二钾、青霉素/链霉素、胎牛血清(美国Gibco公司),磷酸盐缓冲液(phosphate buffer saline,PBS)、DMEM高糖培养基(美国Hyclone公司),四甲基偶氮唑盐(methyl thiazolyl tetrazolium assay,MTT)(美国Sigma公司),巢蛋白(Nestin)、神经丝H(nerve filament H,NF-H)、S100一抗(武汉博士德生物工程有限公司),倒置荧光显微镜IX73(日本Olympus公司),酶标仪ELX800(美国BioTek公司)等。
1.2兔牙髓干细胞的分离和培养 清洁级健康新西兰家兔8只,雄性,体重2.0~2.5 kg,购自哈尔滨珍宝药业有限公司,许可证号:SCXK(黑)2018-0001,实验于哈尔滨医科大学附属第一医院动物实验中心进行(实验动物及方案通过哈尔滨医科大学附属第一医院动物伦理委员会批准),饲养条件:室温20~25 ℃,湿度55%~65%。完整拔除兔牙,无菌环境中取出牙髓组织,采用酶解组织块法分离和培养兔牙髓干细胞[7]。
1.3MTT法测定 MTT法检测不同浓度甲钴胺对兔牙髓干细胞活性的影响,将第四代兔牙髓干细胞以3×103个/孔的密度接种于96孔板中,放入孵箱24 h,待细胞贴壁后,去除培养基。将细胞按照不同的处理方式分为对照组和实验组,对照组加入含10% FBS、1%双抗的DMEM高糖培养基,实验组分别加入含有25、50和100 mg/L甲钴胺的DMEM高糖培养基,分别于第1、2和3天时加入MTT溶液(0.5 mg/mL),放入孵箱4 h后小心吸取培养基,加入二甲基亚砜15 min后在490 nm处测量吸光度值,每组设置3个平行对照。
1.4牙髓干细胞的神经诱导及分组 配制神经诱导液进行神经诱导[8],A液是包含10 ng/mL碱性纤维母细胞生长因子、500 μmol/L β-巯基乙醇和10% FBS的DMEM/F12培养基;B液是含有100 μmol/L丁基羟基茴香醚和2%二甲基亚砜的无FBS的DMEM高糖培养基。按照不同的处理方式分为4组,对照组:兔牙髓干细胞在DMEM高糖培养基中培养72 h;甲钴胺组:兔牙髓干细胞在含有100 mg/L甲钴胺的DMEM高糖培养基中培养72 h;神经诱导液组:兔牙髓干细胞在DMEM高糖培养基中培养42 h,然后依次在A液、B液中培养24 h和6 h;甲钴胺+神经诱导液组:兔牙髓干细胞在含有100 mg/L甲钴胺的DMEM高糖培养基中培养42 h,然后依次在A液和B液中培养24 h和6 h,每组设置3个平行对照。
1.5蛋白免疫印迹 采用蛋白免疫印迹法检测神经诱导后兔牙髓干细胞NF-H和S100蛋白的表达情况。以3×105个/孔的密度将第四代兔牙髓干细胞接种于6孔板中,24 h细胞贴壁后进行神经诱导实验。神经诱导实验后用含有苯甲基磺酰氟的组织快速裂解液(苯甲基磺酰氟∶组织快速裂解液=100∶1)提取细胞总蛋白,二喹啉甲酸法测定蛋白浓度。每孔总蛋白上样量25 μg,8% Tris-甘氨酸十二烷基磺酸钠聚丙烯酰胺凝胶电泳后,湿转法转到聚偏二氟乙烯膜上,配制5%脱脂奶粉封闭液,室温条件下封闭2 h。孵育、Nestin、NF-H和S100一抗4 ℃过夜,用含0.05% Tween-20的Tris-HCl缓冲盐溶液漂洗3次,室温条件下进行二抗孵育1 h,Tris-HCl缓冲盐溶液漂洗3次,采用电化学发光液曝光显影。用Image J软件分析图像的灰度值,以β-actin为内参,每组设置3个平行对照。
1.6免疫荧光 兔牙髓干细胞接种于24孔板中,每孔接种量为1×104个/mL。用含有100 mg/L甲钴胺的DMEM高糖培养基培养3 d,对照组为不含甲钴胺的DMEM高糖培养基培养3 d。PBS漂洗3次,4%多聚甲醛固定20 min,PBS漂洗3次,0.1% Triton X-100透膜15 min,PBS漂洗3次,1%封闭液封闭20 min,孵育NF-H和S100一抗4 ℃过夜,PBS漂洗一遍,避光下孵育荧光二抗1 h,PBS漂洗一遍后荧光显微镜下拍照,每组设置3个平行对照。
1.7茜素红染色 兔牙髓干细胞接种于24孔板中,每孔接种量为1×104。用含有100 mg/L甲钴胺的DMEM高糖培养基培养3 d,对照组为不含甲钴胺的DMEM高糖培养基培养3 d。PBS漂洗3次,4%多聚甲醛固定20 min,PBS漂洗3次,配置浓度为1%的茜素红染色染液,然后加入1 mL室温保持30 min,蒸馏水冲去表面染色,自然风干,显微镜下观察,拍照,随机选取5个视野统计矿化结节数量,实验重复3次。

2 结 果
2.1细胞形态学观察 采用酶解组织块法分离和培养兔牙髓干细胞,原代细胞培养2 d时可见组织块周围有细胞游出,细胞贴壁,呈纺锤形和梭形(图1a),培养7 d传代,细胞呈单一长梭形(图1b)。
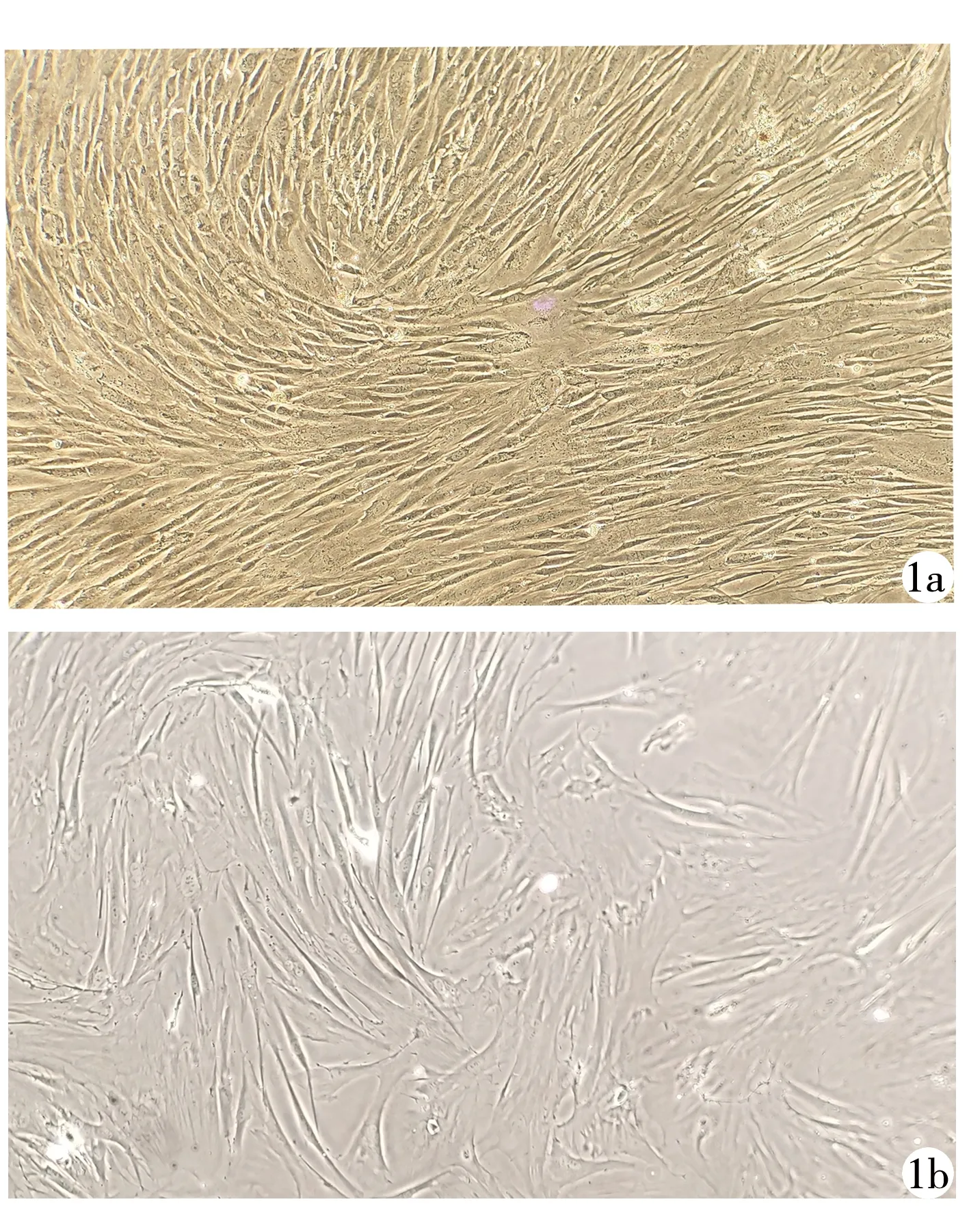
1a:原代细胞形态;1b:传代细胞形态
2.2甲钴胺对兔牙髓干细胞活性的影响 MTT结果显示,第1、2和3天时,各组间OD值比较差异均无统计学意义(P>0.05),见表1。

表1 不同浓度甲钴胺OD值的比较
2.3甲钴胺诱导兔牙髓干细胞成神经向分化的浓度选择 蛋白免疫印迹法结果显示,不同浓度甲钴胺处理兔牙髓干细胞3 d后Nestin蛋白的相对表达量比较差异有统计学意义(P<0.01),25 mg/L、50 mg/L 和100 mg/L甲钴胺组Nestin蛋白的相对表达量高于对照组,50 mg/L和100 mg/L甲钴胺组高于25 mg/L甲钴胺组,100 mg/L甲钴胺组高于50 mg/L甲钴胺组(P<0.05),见图2和表2。因此,选择100 mg/L甲钴胺用于后续实验。

Nestin:巢蛋白;β-actin:β-肌动蛋白

表2 不同浓度甲钴胺处理兔牙髓干细胞3 d后Nestin蛋白的相对表达量比较
2.4甲钴胺对兔牙髓干细胞成神经向分化的影响 蛋白免疫印迹法结果显示,各组细胞的NF-H和S100蛋白相对表达量比较差异有统计学意义(P<0.01),100 mg/L甲钴胺组、神经诱导液组、100 mg/L甲钴胺+神经诱导液组NF-H和S100蛋白相对表达量高于对照组,神经诱导液组、100 mg/L甲钴胺+神经诱导液组高于100 mg/L甲钴胺组,100 mg/L甲钴胺+神经诱导液组高于神经诱导液组(P<0.05),见图3和表3。免疫荧光染色结果显示,与对照组相比,经过100 mg/L甲钴胺处理3 d后,兔牙髓干细胞的NF-H和S100明显呈阳性表达,见图4。

NF-H:神经丝H;β-actin:β-肌动蛋白

表3 各组细胞的NF-H和S100蛋白相对表达量比较
2.5甲钴胺对兔牙髓干细胞矿化结节的影响 茜素红染色结果显示,经过100 mg/L甲钴胺处理3 d后细胞排列呈以矿化结节为中心的火山口样、漩涡状,局部聚集成灶,矿化结节数为(2.41±0.14)个,对照组为(0.82±0.11)个,两组比较差异有统计学意义(t=15.468,P<0.001)。见图5。
3 讨 论
面神经缺损的修复一直是口腔医学界的难题之一,神经受损后患者的生活质量大大降低。自体神经移植仍是目前修复神经缺损的金标准,但该技术有一定的局限性,包括可移植的神经数量有限、造成供区额外损伤、形成神经瘤等[9]。
近年来,神经损伤的干细胞疗法备受关注。牙髓干细胞是来源于神经嵴的间充质干细胞,其增殖能力强,具有多向分化潜能,在体外可被诱导分化为神经元样细胞[10]。牙髓干细胞可以从阻生齿或正畸拔除的牙中提取出来,其不仅能表达多种神经标志物(Nestin、胶质纤维酸性蛋白抗体、S100等),还能分泌多种神经营养因子[11],是一种理想的促进神经损伤恢复的干细胞。甲钴胺作为内源性维生素B12,对维持神经系统的稳定发挥着重要作用,人体缺乏甲钴胺会引起神经系统病变[12]。甲钴胺参与甲基化循环过程,为该循环中的某些甲基化反应提供甲基供体[13]。有研究表明,甲钴胺可以促进大鼠小脑颗粒神经元神经突触的生长[14],大鼠骨髓间充质细胞经甲钴胺诱导后会分化为神经元样细胞[6]。甲钴胺还能促进大鼠脱髓鞘坐骨神经中施万细胞的分化和髓鞘的再生[15-16]。本研究采用酶解组织块法分离和培养兔牙髓干细胞开展研究,MTT检测结果显示,经过含有不同浓度甲钴胺的DMEM完全培养基培养后,第1、2和3天时各组OD值比较差异无统计学意义(P>0.05),表明甲钴胺对兔牙髓干细胞的活性无抑制作用,不会影响牙髓干细胞的增殖。

图4a-4f为NF-H的染色;图4g-4l为S100的染色;NF-H:神经丝H

图5 用含和不含100 mg/L甲钴胺的DMEM培养基培养兔牙髓干细胞3 d后兔牙髓干细胞矿化结节情况(茜素红染色,×400)
Nestin主要在胚胎期的神经干细胞和神经前体细胞中表达,被广泛用于神经干细胞鉴定,并被视为神经细胞再生的生物学标志物[17-18]。本实验蛋白免疫印迹法结果显示,不同浓度的甲钴胺在3 d后均明显促进兔牙髓干细胞Nestin蛋白的表达,证明甲钴胺可促进兔牙髓干细胞的神经向分化,且100 mg/L甲钴胺组表达量高于50 mg/L甲钴胺组和25 mg/L甲钴胺组。神经丝是细胞骨架的一种,其主要存在于神经元,能够支持细胞,对细胞间的物质交换以及细胞的分化起重要作用。NF-H是高分子神经丝蛋白,其出现代表着神经元的成熟[19]。S100蛋白能够调节细胞的能量代谢和钙离子水平,具有营养神经的作用,能够促进神经损伤的修复[20-21]。本实验中蛋白免疫印迹法和免疫荧光实验检测NF-H和S100蛋白相对量,结果显示,经过甲钴胺处理后,兔牙髓干细胞的NF-H和S100表达升高;免疫荧光实验也显示,经过甲钴胺处理后,兔牙髓干细胞的NF-H和S100呈明显的阳性表达,神经向分化的最终环节是细胞外基质矿化,经过100 mg/L甲钴胺处理3 d后细胞排列呈以矿化结节为中心的火山口样、漩涡状,局部聚集成灶,均证明了甲钴胺能够促进兔牙髓干细胞的成神经向分化,但具体的调节机制还有待进一步实验探究。
综上所述,甲钴胺处理3 d后能够促进兔牙髓干细胞的成神经向分化,且不影响细胞的活性,进一步应用于动物实验是可行的,该实验可为未来临床应用甲钴胺及牙髓干细胞治疗面神经损伤及其他神经系统病变提供理论参考。
