非小细胞肺癌GATA4启动子甲基化检测及其对细胞增殖和凋亡的影响
2021-03-26党海舟
李 源,党海舟
(1.汉中市三二0一医院呼吸科,陕西 汉中 723000; 2.空军军医大学第二附属医院胸腔外科,西安 710000)
目前,肺癌是最常见的癌症,也是全球癌症死亡的主要原因[1]。非小细胞肺癌(NSCLC)是指除小细胞肺癌(SCLC)外的肺癌,约占所有肺癌病例的85%,其5年总生存率仅为15%[2],已成为严重危害人类健康和患者生命质量的疾病。因此,探索其发病机制和影响因素,加强预防和干预成为目前急待解决的关键问题。NSCLC的发生、发展和预后与DNA修复突变相关基因[3]、DNA甲基化[4]等表观遗传修饰水平异常有关。而DNA甲基化会导致DNA、染色质以及DNA和蛋白质相互作用的变化,从而引起基因表达发生改变[5]。
GATA4属于转录因子GATA家族,GATA4是调控一些组织特异性表达的关键因子[6],此外,GATA4可能驱动内胚层特异性分化[7]。研究发现,转录因子GATA4基因功能的丧失与肺癌[8]、浆液性卵巢癌[9]、胃癌[10]、结直肠细胞系和原发性结肠癌[11]等恶性肿瘤密切相关,其可能是肺癌功能丧失的靶点,且GATA4启动子甲基化参与其中[12]。研究发现过表达GATA4会抑制结肠癌细胞的增殖[13],而GATA4的缺失使恶性胶质瘤细胞的细胞增殖加速,患者生存率大大降低[14]。本文采用人NSCLC细胞系A549细胞研究其GATA4启动子的甲基化和GATA4 mRNA的水平,并加入DNA甲基化抑制剂5-Aza-2′deoxycytidine,观察其GATA4的mRNA水平和细胞的增殖及凋亡情况,以期为临床NSCLC治疗提供可能的靶点。
1 材料与方法
1.1 试剂
人正常肺上皮细胞系BEAS-2B和人NSCLC细胞系A549(均购自美国典型培养物保藏中心)。Genomic DNA试剂盒(宝日医生物技术(北京)有限公司),DNA重亚硫酸盐处理试剂盒(天根生化科技有限公司),基因甲基化特异性PCR扩增(MSP)试剂盒(宝日医生物技术(北京)有限公司),焦磷酸测序试剂盒(宝日医生物技术(北京)有限公司),PCR引物(上海生工生物工程有限公司),总RNA提取试剂盒(北京索莱宝科技有限公司),SYBR Green PCR试剂盒(宝日医生物技术(北京)有限公司),CCK-8检测试剂盒(博士德生物工程有限公司),anti-PCNA抗体(CST公司)、anti-cleaved-caspase 3和anti-caspase 3(abcam公司)、β-actin(abcam公司),ANNEXIN V-FITC/PI凋亡试剂盒(博士德生物工程有限公司)。
1.2 细胞的分组与处理
以人正常肺上皮细胞系BEAS-2B为对照组,人NSCLC细胞系A549为NSCLC组进行甲基化检测。之后在A549细胞中加入2 μmol·L-1的甲基化抑制剂5-Aza-2′deoxycytidine,分为NSCLC组和NSCLC+5-Aza-2′deoxycytidine组,继续培养48 h之后进行实验。
1.3 甲基化特异性PCR(MSP)法检测NSCLC GATA4启动子甲基化水平
选取对数生长期的BEAS-2B和A549细胞,待其生长汇聚至80%,胰蛋白酶消化细胞,1000 r·min-1离心5 min,收集细胞,按照试剂盒说明提取基因组DNA,采用超微量分光光度计测定提取DNA的浓度和纯度。DNA亚硫酸氢钠修饰,采用25 μL的反应体系进行PCR扩增。甲基化GATA4引物序列为:上游5′-GTATAGTTTCGTAGTTTGCGTTTAGC-3′,下游5′-AACTCGCGACTCG-AATCCCCG-3′;非甲基化GATA4引物序列为:上游5′-TTTGTATAGTTTTGTAGTTTGTGTTT-TT-3′,下游5′-CCCAACTCACAACTCAA-ATCCCCA-3′。琼脂糖凝胶电泳,120 V、5 min进行电泳,溴化乙锭(EB)染色,成像并拍照记录。
1.4 Real-time PCR检测GATA4的mRNA水平
选取对数生长期的BEAS-2B和A549细胞,待其生长汇聚至80%,胰蛋白酶消化细胞,1000 r·min-1离心5 min,收集细胞。逆转录试剂盒合成cDNA,每次反应使用5 μg的总RNA。之后进行PCR扩增检测GATA4 mRNA的表达水平。GATA4引物:上游5′-CTGGCCTGTCATCTCACTACG-3′,下游5′-GGTCCGTGCAGGAATTTGA-GG-3′。PCR扩增采用25 μL反应体系,95 ℃、30 s预变性,95 ℃、5 s变性,60 ℃、30 s退火。最后按2-ΔΔCt检测GATA4的mRNA表达水平。
1.5 CCK-8检测细胞的增殖率
取对数期细胞使用细胞计数板进行细胞计数,用完全培养基将细胞密度调整为105·mL-1,在96孔板中接种细胞悬液,培养24 h,分别加入0.2、0.5、2.0和5.0 μmol·L-1的甲基化抑制剂5-Aza-2′deoxycytidine,继续培养24 h,避光加入CCK-8液,孵育2 h后酶标仪检测吸光度值并计算增殖率。
1.6 Western blot检测PCNA、cleaved-caspase 3和caspase 3的蛋白表达
待细胞汇聚至80%左右时,胰蛋白酶消化细胞,4000 r·min-1、10 min离心,弃上清留细胞沉淀。加入100 μL裂解液和1 μL蛋白酶抑制剂(PMSF),超声破碎细胞。12 000 r·min-1、15 min离心,取上清,BCA法测蛋白浓度。80 V电泳至marker分开,换120 V电泳。转膜、脱脂奶粉封闭。孵一抗4 ℃过夜、孵二抗2 h,曝光机上曝光并拍照。分析灰度值,以β-actin为内参。
1.7 流式细胞术检测细胞凋亡
将细胞接种于六孔板内,待细胞生长至70%,胰蛋白酶消化细胞,加入4 mL PBS,800 r·min-1、5 min离心,弃上清。轻轻吹打细胞使细胞悬液均匀,加入Annexin V-FITC结合液重悬细胞,再加入Annexin V-FITC液重悬细胞,避光孵育10 min,相继加入Annexin V-FITC结合液和碘化丙啶染色液,上机。根据所得数据进行结果分析。
1.8 统计学方法

2 结果
2.1 A549细胞GATA4启动子甲基化频率的变化
用甲基化特异性PCR(MSP)法对BEAS-2B细胞和人NSCLC细胞系A549的GATA4启动子DNA甲基化水平进行检测发现,与BEAS-2B相比,A549细胞的GATA4启动子的DNA甲基化水平显著升高[(3.383±0.614)%比(35.53±1.89)%,t=16.14,P<0.01],见图1。提示GATA4启动子的甲基化可能与NSCLC的发生发展有关。

**P<0.01与BEAS-2B比较,n=6。图1 A549细胞中GATA4启动子甲基化频率显著升高
2.2 A549细胞中GATA4 mRNA水平的变化
用Real-time PCR检测BEAS-2B细胞和A549细胞的mRNA表达水平,结果显示,与对照组相比,NSCLC组细胞的GATA4 mRNA水平显著降低(1.000±0.000比0.358±0.027,t=23.98,P<0.01),见图2。提示NSCLC细胞GATA4启动子甲基化水平的升高会导致GATA4 mRNA表达水平的降低。
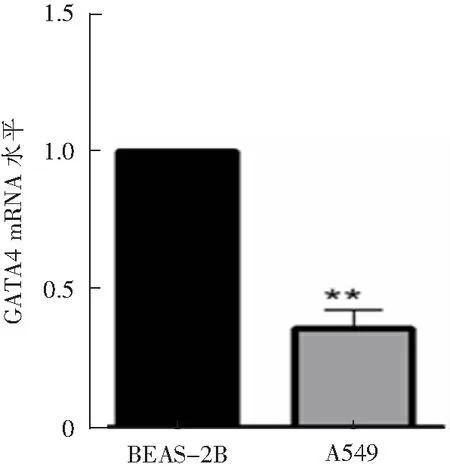
**P<0.01与BEAS-2B比较,n=6。图2 A549细胞中GATA4 mRNA水平明显降低
2.3 抑制GATA4启动子甲基化对NSCLC细胞的GATA4 mRNA水平的影响
在A549细胞中加入2 μmol·L-1的甲基化抑制剂5-Aza-2′deoxycytidine,用Real-time PCR检测A549细胞的mRNA表达水平,结果显示,与NSCLC组相比,NSCLC+5-Aza-2′deoxycytidine组细胞的GATA4 mRNA水平显著升高(1.000±0.000比3.100±0.188,t=11.17,P<0.01),见图3。提示加入2 μmol·L-1的甲基化抑制剂5-Aza-2′deoxycytidine后,NSCLCGATA4启动子甲基化水平受到抑制,导致GATA4的mRNA水平升高。
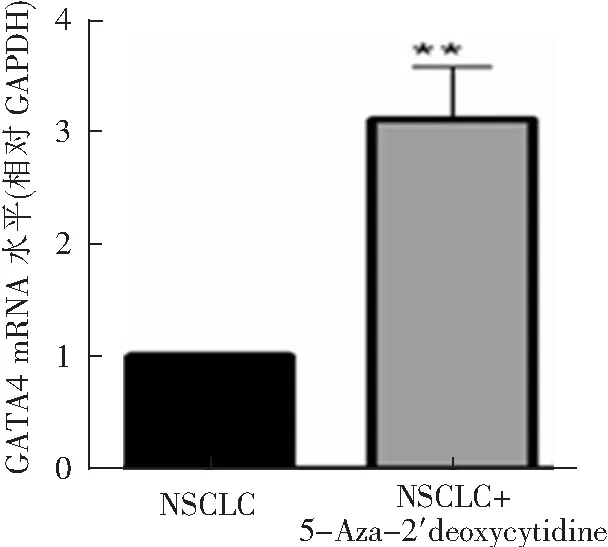
**P<0.01与NSCLC比较,n=6。图3 抑制GATA4启动子甲基化对NSCLC细胞GATA4 mRNA水平的影响
2.4 抑制GATA4启动子甲基化对NSCLC细胞增殖的影响
除Control组外,其余分别加入0.2、0.5、2.0和5.0 μmol·L-1的甲基化抑制剂5-Aza-2′deoxycytidine,CCK-8结果显示,随着抑制剂浓度的升高,NSCLC细胞的增殖率逐渐降低(F=18.95,P<0.01),见图4A;用Western blot检测细胞中增殖相关指标PCNA的蛋白表达,发现与NSCLC组相比,NSCLC+5-Aza-2′deoxycytidine组PCNA的蛋白表达水平降低(0.998±0.003比0.721±0.020,t=13.74,P<0.01),见图4B。提示GATA4启动子甲基化能增加NSCLC细胞的增殖。

A:CCK-8检测细胞的存活率,**P<0.01与Control比较,n=5;B:Western blot检测PCNA的表达,**P<0.01与NSCLC比较,n=6。
2.5 抑制GATA4启动子甲基化对NSCLC细胞凋亡的影响
Western blot结果显示,与NSCLC组细胞相比,NSCLC+5-Aza-2′deoxycytidine组凋亡指标cleaved-caspase 3/caspase 3的比值增高(0.998±0.003比1.682±0.051,t=13.50,P<0.01),见图5A;流式细胞术检测细胞的凋亡情况,发现与NSCLC组细胞相比,NSCLC+5-Aza-2′deoxycytidine组的凋亡率增高[(6.222±0.399)%比(14.990±0.690)%,t=11.00,P<0.01],见图5B。提示GATA4启动子甲基化能降低NSCLC细胞的凋亡。
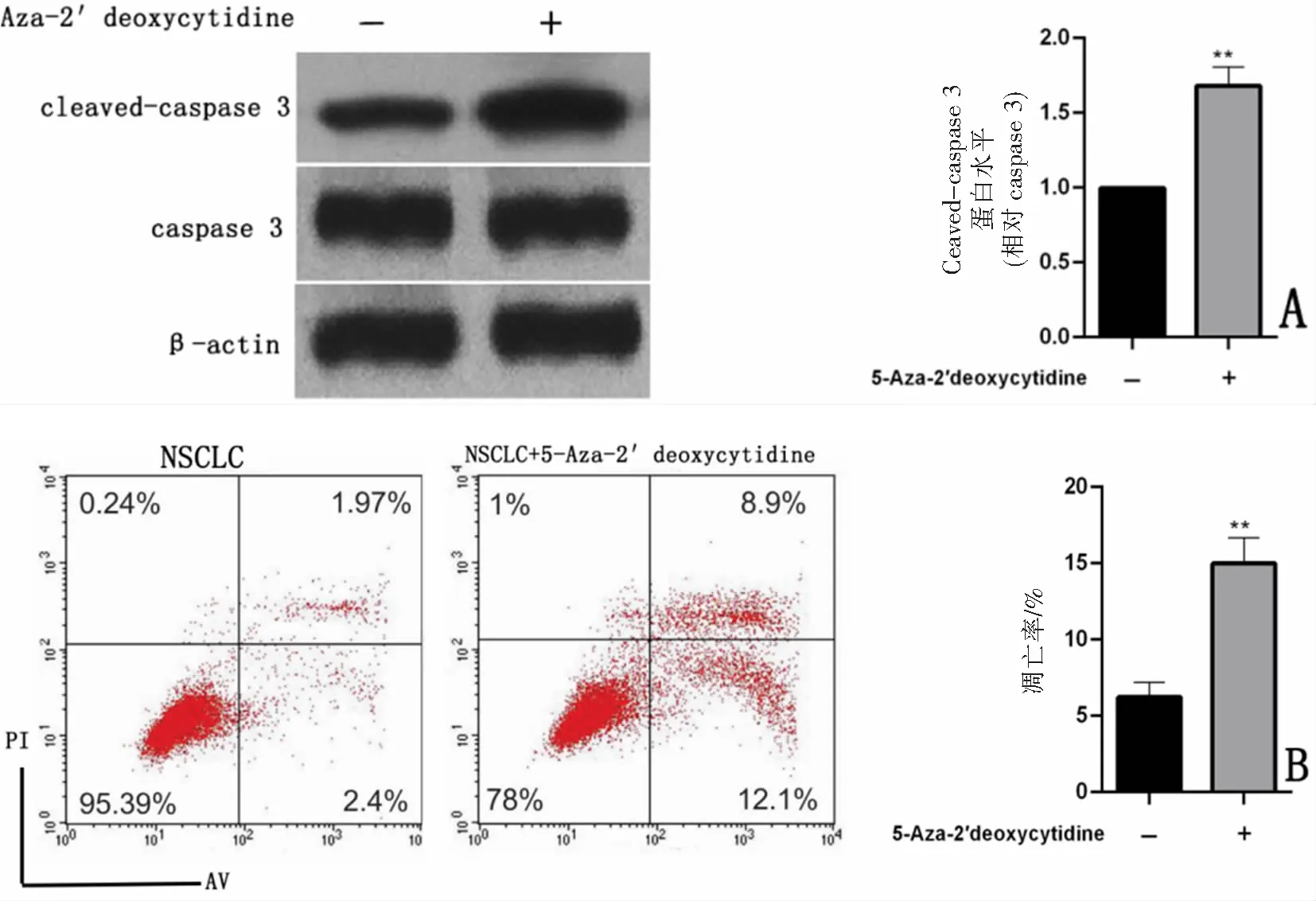
A:Western blot检测cleaved-caspase 3和caspase 3的表达,**P<0.01与NSCLC比较,n=6;B:流式细胞术检测细胞凋亡,**P<0.01与NSCLC比较,n=6。
3 讨论
肺癌是全球癌症死亡的主要原因[1],其中绝大多数的肺癌属于NSCLC[2]。有研究[3]发现,癌基因突变和DNA甲基化异常与NSCLC密切相关。作为机体内的抑癌基因,转录因子GATA4可能是NSCLC功能丧失的靶点,且GATA4启动子甲基化在其中起着关键的作用[12]。
本研究采用MSP法检测对照细胞与NSCLC细胞中的GATA4启动子DNA甲基化水平,发现NSCLC细胞中GATA4启动子甲基化率显著升高;采用焦磷酸测序进一步检测GATA4启动子区CPG岛的甲基化水平,NSCLC组细胞的GATA4启动子各位点的DNA甲基化水平同样显著升高;采用Real-time PCR检测发现NSCLC细胞中GATA4 mRNA水平明显降低,说明NSCLC细胞中GATA4启动子的甲基化可能导致GATA4 mRNA表达降低。由此,推测GATA4启动子的甲基化可能与NSCLC的发生发展密切相关。
抑制肿瘤细胞的增殖是NSCLC控制和治疗的方式之一。HELLEBREKERS等[13]发现,GATA4的过表达可以抑制一些肿瘤细胞的增殖。同样,AGNIHOTRI等[14]在恶性胶质瘤中的研究发现,GATA4的缺失使细胞增殖加速,患者病程加速。那么,GATA4是否可以对NSCLC细胞的增殖产生影响?而GATA4启动子的DNA甲基化是否参与其中?为此,本研究在NSCLC细胞中加入2 μmol·L-1的甲基化抑制剂5-Aza-2′deoxycytidine,培养48 h后,检测NSCLC细胞的GATA4 mRNA水平,发现细胞在加入甲基化抑制剂后GATA4的mRNA水平显著升高;分别在NSCLC细胞中加入不同浓度的甲基化抑制剂5-Aza-2′deoxycytidine,培养24 h后,CCK-8检测细胞增殖率,发现随着抑制剂浓度的变化,细胞的增殖率逐渐降低;检测细胞中增殖相关指标PCNA的蛋白表达,发现甲基化抑制后细胞的增殖相关蛋白PCNA的表达水平降低。提示GATA4启动子甲基化能增加NSCLC细胞的增殖。这与以往的研究[13-14]认为GATA4具有抑癌作用的结果一致。
NSCLC的控制和治疗同样依赖于NSCLC细胞的凋亡增加,推测在NSCLC中,GATA4启动子甲基化有可能对肺癌细胞的凋亡产生影响。为了验证这个假设,本研究采用Western blot检测细胞中凋亡指标cleaved-caspase 3和caspase 3的表达,发现抑制GATA4启动子甲基化后cleaved-caspase 3/caspase 3的比值增高;采用流式细胞术检测细胞凋亡,同样发现抑制GATA4启动子甲基化后NSCLC细胞凋亡率增加。提示GATA4启动子甲基化能降低NSCLC细胞的凋亡。GONG等[15]发现GATA4可以抑制胰腺导管癌增殖和分化,通过促进抑癌基因P53表达,并通过KEGG富集分析发现,GATA4调控基因部分富集在MAPK和JAK-STAT信号通路中。
综上所述,在NSCLC中,GATA4启动子DNA的甲基化水平升高,去甲基化减少,从而可能导致GATA4 mRNA表达降低,有可能诱导肺癌细胞的增殖,抑制肺癌细胞的凋亡,从而诱使NSCLC的发生并促进其发展。本研究为NSCLC的干预和治疗提供了新的靶点;然而,本课题仅粗略的探究了NSCLC中GATA4启动子DNA的甲基化与细胞增殖和凋亡的关系,并未深入探究其具体的机制,因此,将进一步研究GATA4启动子DNA的甲基化是依靠哪些途径来促进细胞增殖并抑制细胞凋亡的,从而为今后NSCLC的治疗和干预提供更进一步的理论基础。
