细胞破碎方法对Bacillus sp. DL-2 胞内蛋白酶拆分乙酸苏合香酯的影响
2021-03-25王晓敏董璐张继福张云胡云峰
王晓敏 , 董璐 , 张继福, 张云 , 胡云峰
1. 中国科学院南海海洋研究所, 中国科学院热带海洋生物资源与生态重点实验室, 广东省海洋药物重点实验室, 广东 广州 510301;
2. 南方海洋科学与工程广东省实验室(广州), 广东 广州 511458;
3. 广东省中医院, 广东 广州 510120;
4. 中国科学院大学, 北京 100049
(R)-1-苯乙醇是一类重要的手性化合物, 不同对映体可显示出不同的香气特征、香气强度和生物活性(Werkhoff et al, 2002; 刘树文, 2009; 田红玉, 2011)。(R)-1-苯乙醇可以被用来合成抑制胆固醇吸收的药物(Chua et al, 2004; De Los Ríos et al, 2012), 也可应用于化妆品生产、防腐剂和颜料等工业生产(Fan et al, 2011)。此外, 手性1-苯乙醇及相应的手性酯作为我国规定允许使用的食用香料, 可用于调配玫瑰香型精油和各种花香型香精, 也可用作配制蜂蜜、面包、桃子和浆果类等香精。
通常, 手性化合物的合成可以通过传统的化学方法合成, 但是化学合成需要有毒有机溶剂及重金属的参与, 对环境及人类具有严重的危害, 同时还会破坏产品的品质, 并且通过化学合成得到的手性化合物的光学纯度较低(Noyori et al, 1991)。此外, 手性化合物还可以通过生物催化剂的方法进行制备(Deng et al, 2016a, 2018; Huang et al, 2018; Wang et al, 2018a, b, 2019a, b)。与传统的化学合成相比, 酶法选择性拆分消旋体化合物, 具有高立体专一性和区域选择性、副反应少、产率高、产物光学纯度好以及反应条件温和的优点(Cao et al, 2016; Deng et al, 2016b; 公颜慧 等, 2016, 2018; Huang et al, 2016), 是一种被广泛认可的拆分方法(曹莹莹 等, 2016; Liang et al, 2016a, b; Deng et al, 2016c; 黄锦龙 等, 2017, 2018)。目前, 苯乙醇基本上都是采用廉价的化工原料利用化学合成的方法生产。随着生活水平的提高和对健康的关注, 人们越来越重视食品的安全性, 食品生产也越来越倾向使用天然添加剂。利用酶催化法制备(R)-1-苯乙醇相较于化学合成也更符合人们对食品安全的追求。
目前常见的微生物细胞破壁方式主要有: 化学法, 如利用表面活性剂和酸等; 物理法, 如反复冻融法、超声破壁法、机械法和玻璃珠法等; 生物法, 如酶解法等(Chang et al, 2007)。孙永红(2010)以臭曲霉为对象, 采用超声波、研磨、温和化学法3 种方法破碎臭曲霉菌体, 得出适合臭曲霉SH4 胞内酶最佳的提取方案为研磨法。吕国英等(2016)利用超声破碎刺芹侧耳M1 菌获取漆酶, 用于降解孔雀石绿效果良好。针对不同种微生物以及破碎目的的不同, 破碎方式也不尽相同。本实验室从西太平洋深海沉积物中筛选出一株芽孢杆菌Bacillus sp. DL-2, 经初步试验表明其胞内酶、胞外酶及全细胞均能水解乙酸苏合香酯(Dong et al, 2019a, b; 董璐 等, 2020), 本文旨在探寻不同细胞破碎方法对胞内蛋白酶拆分乙酸苏合香酯的影响。比较常用的3 种破碎细胞方法(表面活性剂破碎、溶菌酶破碎和超声破碎), 并优化了表面活性剂破碎和溶菌酶破碎的条件。在最优条件下, (R)-1-苯乙醇的对映体过量值达到96%, 转化率为23%, 为利用芽孢杆菌胞内蛋白酶生产手性(R)-1-苯乙醇提供了参考。
1 材料与方法
1.1 材料
芽孢杆菌Bacillus sp. DL-2 由本实验室筛选自西太平洋深海沉积物中, 菌落呈圆形凸起, 表面光滑, 边缘整齐, 呈淡黄色。乙酸苏合香酯购自上海阿达玛斯试剂有限公司, 表面活性剂购自广州东巨公司, 溶菌酶购自生工生物工程上海股份有限公司, 其他试剂皆为分析纯, 购自广州东巨公司。
1.2 方法
1.2.1 Bacillus sp. DL-2 胞内蛋白酶拆分乙酸苏合香酯反应
将破碎细胞后获取的胞内蛋白酶液500µL 与10mmol·L–1乙酸苏合香酯充分振荡反应。反应条件为: 35℃, 200r·min–1, 摇床振荡反应8h。反应完毕立即加入与拆分体系等量的乙酸乙酯, 2000r·min–1振荡萃取2min, 离心后取上层有机相进气相检测。气相检测条件为: 注射器温度210℃, 检测器温度210℃, 载气为N2, 流速1.2mL·min–1, 采用梯度升温进行分析: 80℃保持1min, 10℃·min–1升温到120℃, 120℃保持1min, 15℃·min–1升温到210℃, 保持1min。
产物(R)-1-苯乙醇的对映体过量值(e.e.)及转化率(C)按如下公式计算(Chen et al, 1982):
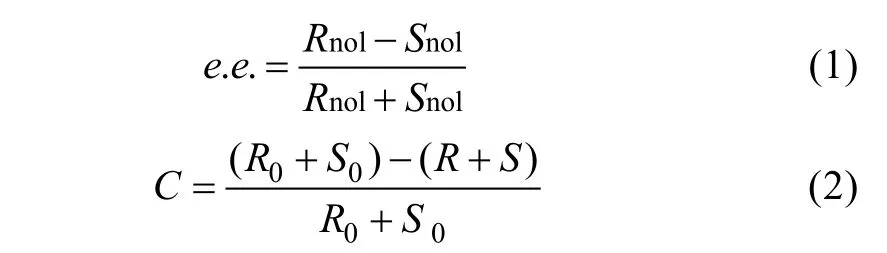
式中: e.e.表示(R)-1-苯乙醇的对映体过量值(单位: %); Rnol和Snol分别表示反应后(R)-1-苯乙醇和(S)-1-苯乙醇的峰面积(单位: µV·s)。C 为转化率(单位: %); R0、S0分别表示反应前对应构型的乙酸苏合香酯的浓度(单位: mmol·L–1); R、S 分别代表反应后对应构型的乙酸苏合香酯的浓度(单位: mmol·L–1)。
1.2.2 表面活性剂的初筛
磷酸盐(PB)缓冲液的配制: 6g NaH2PO4溶于1000mL 蒸馏水中配制成A 液, 7.1g Na2HPO4溶于1000mL 蒸馏水中配制成B 液, 以不同比例混合A液和B 液, 得到0.05mol·L–1的不同pH 的磷酸盐缓冲液。
柠檬酸-柠檬酸钠缓冲液的配制: 19.2g 柠檬酸溶于1000mL 蒸馏水中充分溶解, 29.4g 柠檬酸钠溶于1000mL 蒸馏水中充分溶解, 按不同比例混合两母液, 即得不同pH 的柠檬酸-柠檬酸钠缓冲液。
Tris-HCl 缓冲液的配制: 称量12.1g Tris 溶于1000mL蒸馏水中充分溶解, 取500mL加入0.1mol·L–1的稀盐酸调制相应pH, 加水定容至1000mL, 即得不同pH 的Tris-HCl 缓冲液。
表面活性剂溶液的配制: 量取或称量表面活性剂, 分别配制体积分数0.5%或质量分数0.5%的表面活性剂溶液, 溶剂为pH7.0 的磷酸盐缓冲液。
Bacillus sp.DL-2 经发酵培养后用pH 7.0 的磷酸盐缓冲液清洗两次, 去上清, 取湿重细胞0.5g 分别加入体积分数 0.5%的吐温 20 (Tween20, 分析纯)、吐温40 (Tween40, 分析纯)、吐温60 (Tween60, 分析纯)、吐温80 (Tween80, 分析纯)、曲拉通X-100 (TritonX-100, 分析纯, >99%)或质量分数0.5%的羧甲基纤维素钠(CMCNa, 分析纯)、三聚磷酸钠(STPP, 分析纯, 98%)、十六烷基三甲基溴化铵(CTAB, 99%)、脱氧胆酸钠(NaDC, 98%)、十二烷基硫酸钠(SDS, 分析纯)、十二烷基苯磺酸钠(SDBS, 95%)、司盘65 (Span65, 分析纯)等表面活性剂溶液20mL中, 置于35℃, 200r·min–1摇床中振荡破碎2h 后, 10000r·min–1离心10min, 取上清, 即得胞内蛋白酶液。使用胞内蛋白酶液按照上述拆分方法对乙酸苏合香酯进行水解拆分制备(R)-1-苯乙醇。综合比较e.e.值、转化率、配制表面活性剂溶液复杂程度及经济适用性, 选出最适表面活性剂。
1.2.3 表面活性剂的破碎条件优化
采用单因素试验, 优化表面活性剂破碎条件。选出最佳表面活性剂之后, 将发酵清洗好的湿重0.5g 细菌细胞加入20mL 表面活性剂溶液中, 在不同的试验条件下进行破碎, 破碎后10000r·min–1离心 10min, 获取胞内酶液用于拆分乙酸苏合香酯, 所有试验均重复3 次, 取平均值。
优化破碎温度。取湿重0.5g 细菌细胞加入用pH 7.0 的磷酸盐缓冲液配制的0.5%表面活性剂溶液20mL, 试验温度分别设置为20℃~55℃ (5℃间隔), 置于200r·min–1摇床中振荡破碎2h。
优化破碎时pH。取湿重0.5g 细菌细胞, 分别加入20mL 用不同pH 缓冲液(5.0~10.0, 0.5 间隔, 其中5.0~6.5 为柠檬酸-柠檬酸钠缓冲液, 7.0~7.5 为PB 缓冲液, 8.0~10.0 为Tris-HCl 缓冲液)配制的表面活性剂溶液, 置于35℃、200r·min–1摇床中振荡破碎2h。
优化破碎时间。取湿重0.5g 细菌细胞加入用pH 7.0 的PB 缓冲液配制的0.5%表面活性剂溶液20mL, 置于 35℃、200r·min–1摇床中振荡破碎不同时间(0~5h, 0.5h 间隔)。
优化表面活性剂浓度。取湿重0.5g 细菌细胞, 分别加入20mL 不同体积分数或质量分数(0.1%~1%, 0.1%间隔)的表面活性剂(用pH 7.0 磷酸盐缓冲液配制), 置于35℃、200r·min–1摇床中振荡破碎2h。
1.2.4 溶菌酶的破碎条件优化
10mg·mL–1溶菌酶溶液的配制: 称量1g 溶菌酶溶于100mL pH 7.0 的磷酸盐缓冲液中。
优化破碎温度。取湿重0.5g 细菌细胞, 加入20mL 10mg·mL–1的溶菌酶溶液, 分别置于不同温度(20~50℃, 5℃间隔) 200r·min–1摇床中振荡破碎2h。
优化破碎pH。取湿重0.5g 细菌细胞, 分别加入20mL 用不同pH 缓冲液(5.5~9.0, 0.5 间隔, 其中5.5~6.5 为柠檬酸-柠檬酸钠缓冲液, 7.0~7.5 为PB 缓冲液, 8.0~9.0 为Tris-HCl 缓冲液)配制的10mg·mL–1的溶菌酶溶液, 置于35℃、200r·min–1摇床中振荡破碎2h。
优化破碎时间。取湿重0.5g 细菌细胞加入20mL 10mg·mL–1的溶菌酶溶液, 置于35℃、200r·min–1摇床中振荡破碎不同时间(0~4h, 0.5h 间隔)。
溶菌酶浓度的优化。湿重0.5g 细菌细胞加入20mL 不同浓度(1~10mg·mL–1, 1mg·mL–1间隔)的溶菌酶溶液, 置于35℃、200r·min–1摇床中振荡破碎2h。
1.2.5 超声破碎对胞内酶拆分乙酸苏合香酯的影响
超声体系: 取发酵好的湿重0.5g 细菌细胞加入20mL 磷酸盐缓冲液(pH 7.0)。
超声破碎条件: 功率285W, 破碎30min (工作2s, 间歇3s)。10000r·min–1离心10min, 取上清, 即得超声破碎胞内酶液。
2 结果
2.1 表面活性剂的初筛
由图1 可知, 筛选检测的12 种表面活性剂破碎细胞后拆分的效果差别较大。非离子型表面活性剂(Tween20、Tween40、Tween60、Tween80、TritonX-100、Span65)对 Bacillus sp. DL-2 细胞的破碎效果整体要优于离子型表面活性剂(CMCNa、NaDC、SDS、SDBS、CTAB)及无机物表面活性剂(STPP)。推测可能是因为离子型表面活性剂在破碎细胞的过程中对细胞胞内蛋白酶的活性有较大的损伤, 导致Bacillus sp. DL-2胞内蛋白酶的拆分效果较差。使用Tween40、Tween60及TritonX-100 等非离子型表面活性剂破碎细胞后所得的胞内蛋白酶拆分(±)-乙酸苏合香酯制备的(R)-1-苯乙醇的e.e.值可达90%以上。综合考虑选择底物转化率最高的非离子型表面活性剂TritonX-100 作为最佳表面活性剂用于细胞破碎。
2.2 表面活性剂破碎细胞的优化
2.2.1 破碎温度对胞内蛋白酶拆分乙酸苏合香酯的影响

图1 不同表面活性剂破碎细胞对Bacillus sp. DL-2 胞内蛋白酶拆分乙酸苏合香酯的影响 Fig. 1 The effect of different surfactants breaking cells on asymmetrical hydrolysis of (±)-1-phenylethyl acetate using the intracellular proteases of Bacillus sp. DL-2

图2 表面活性剂破碎细胞的条件优化 a. 温度; b. pH; c. 破碎时间; d. 表面活性剂浓度 Fig. 2 The optimization of the conditions of breaking cells by surfactant. (a) Effect of broken temperature, (b) effect of broken pH, (c) effect of broken time, and (d) effect of surfactant concentration
筛选出最适表面活性剂TritonX-100 之后, 探究破碎温度对Bacillus sp. DL-2 胞内蛋白酶拆分乙酸 苏合香酯的影响。试验结果如图2a 所示, 在20~45℃破碎温度下所制备的(R)-1-苯乙醇的e.e.值基本一致, 破碎温度高于45℃时所制备的(R)-1-苯乙醇的e.e.值开始急剧下降。底物转化率在 3 5 ℃时达到 最大值; 在35℃之后, 随着温度的升高转化率逐步降低, 超过45℃后转化率几乎为0, 表明拆分乙酸苏合香酯的胞内酶最高耐受温度在35~40℃之间。虽然在40℃时产物e.e.值达到最大, 但考虑较高温度会对酶活性造成一定影响, 综合考虑选用35℃为最佳破碎温度。
2.2.2 破碎时的pH 对胞内蛋白酶拆分乙酸苏合香酯的影响
破碎时的pH 对胞内蛋白酶拆分乙酸苏合香脂的影响如图2b, 不同pH 的缓冲液对胞内蛋白酶拆分乙酸苏合香酯的影响较大, 在低pH 缓冲液(柠檬酸-柠檬酸钠缓冲液)条件下破碎细胞制备的胞内蛋白酶用于拆分反应中其底物转化率较高。用pH 超过8.0 的Tris-HCl 缓冲液配制的表面活性剂破碎细胞时, 其胞内酶拆分反应的转化率急剧下降。虽然当破碎时的pH 为5.0 和6.5 时, 拆分反应中底物的转化率较高, 但产物e.e.值较低。综合考虑转化率与产物e.e.值, 我们发现在pH 为7.0 时拆分效果最佳。因此, 选择pH 7.0 的磷酸盐缓冲液配制表面活性剂TritonX-100 用于破碎Bacillus sp. DL-2。
2.2.3 破碎时间对胞内蛋白酶拆分乙酸苏合香酯的影响
不同破碎时间也会对胞内蛋白酶拆分乙酸苏合香酯产生较大的影响。试验结果如图2c 所示, 随着破碎时间延长, 底物转化率逐步上升。产物e.e.值在破碎2h 时达到最大, 并且随着破碎时间的延长逐渐降低, 猜测表面活性剂的长时间作用会对胞内蛋白酶产生破坏, 影响胞内蛋白酶的拆分活性, 因此选择2h 为最佳破碎时间。
2.2.4 表面活性剂的体积分数对胞内蛋白酶拆分乙酸苏合香酯的影响
试验结果如图2d, TritonX-100 的体积分数不同对胞内蛋白酶拆分乙酸苏合香酯的影响较小。在高体积分数TritonX-100 溶液作用下, 底物转化率会稍微降低; 色谱图表明, 在体积分数0.5% TritonX-100破碎条件下, 制备的(R)-1-苯乙醇的e.e.值可以达到96%, 底物转化率可达23% (图3b), 因此选择体积分数为0.5%的TritonX-100 对细胞进行破碎。
2.3 溶菌酶破碎细胞的优化
2.3.1 破碎温度对胞内蛋白酶拆分乙酸苏合香酯的影响
溶菌酶在不同温度下破碎Bacillus sp. DL-2 细胞对拆分乙酸苏合香酯的影响较大。由图4a 所知, 底物转化率随温度升高逐步增大并在25℃时达到最大, 之后随着温度继续升高逐步降低。但在25℃时产物e.e.值较低, 并未达到最佳值; 在30℃、35℃和40℃条件下, 底物转化率及e.e.值相差不大, 但是在30℃条件下拆分结果均一性较差; 在35℃和40℃条件下破碎细胞达到的效果基本一致, 考虑到能耗问题及较高温度可能对胞内酶产生影响, 因此选择35℃为最佳破碎温度。
2.3.2 破碎时的pH 对胞内蛋白酶拆分乙酸苏合香酯的影响
溶菌酶在不同pH 时破碎Bacillus sp. DL-2 细胞对拆分乙酸苏合香酯有较大影响。试验结果如图4b所示, 用pH 6.0 的柠檬酸-柠檬酸钠缓冲液配制的溶菌酶破碎细胞后, 产生的胞内酶在拆分反应中制备的(R)-1-苯乙醇的e.e.值及底物转化率均比使用PB 缓冲液和Tris-HCl 缓冲液高。因此选择pH 6.0柠檬酸-柠檬酸钠缓冲液配制溶菌酶用以破碎Bacillus sp. DL-2 细胞, 并进行进一步优化。
2.3.3 破碎时间对胞内蛋白酶拆分乙酸苏合香酯的影响
探究0~4h 不同破碎时间对胞内蛋白酶拆分乙酸苏合香酯的影响, 试验结果如图4c 所示。随着细胞破碎时间增长, 底物转化率呈先上升后下降的趋势, 并在1.5h 达到最高值, 但此时产物e.e.值较低; 破碎时间超过3h 后, 产物e.e.值较好, 但是底物转化率较低, 且破碎时间过长会使工业生产过程更加繁琐。此外, 在破碎时间为1h 和1.5h 时, 制备的手性产品的光学纯度和转化率的均一性不佳。综合考虑, 选择破碎时间0.5h 为最适破碎时间。
2.3.4 溶菌酶质量浓度对胞内酶拆分乙酸苏合香酯的影响
试验结果如图4d 所示, 不同浓度的溶菌酶对产物e.e.值影响不大, 底物转化率呈不规则变化。从经济适用性方面考虑, 选取浓度为1mg·mL–1的溶菌酶为最佳破碎浓度。最优条件下, 拆分乙酸苏合香酯色谱图效果良好(图3c), (R)-1-苯乙醇的e.e.值达到95%, 底物转化率达到22%。
2.4 超声破碎Bacillus sp. DL-2 细胞获取胞内酶拆分乙酸苏合香酯
采取实验室常用参数条件(功率285W, 工作2s, 间歇3s, 破碎30min)进行破碎, 根据胞内蛋白酶拆分乙酸苏合香酯色谱图(图3d)计算, 底物转化率为11.2%, 产物e.e.值为95%。
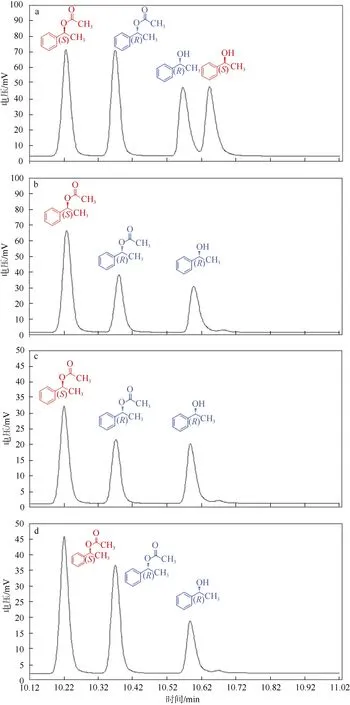
图3 胞内蛋白酶拆分乙酸苏合香酯色谱图 a. 标准品; b. 优化后的表面活性剂TritonX-100 破碎细胞获取胞内酶拆分色谱图; c. 优化后的溶菌酶破碎细胞获取胞内酶拆分色谱图; d. 超声破碎获取胞内酶拆分色谱图。红色代表S 型乙酸苏合香酯及相应的醇, 蓝色代表R-乙酸苏合香酯及相应的醇 Fig. 3 The gas chromatogram of asymmetric hydrolysis of (±)-1-phenylethyl acetate by intracellular proteases. (a) Standards of (±)-1-phenylethyl acetate and (±)-1-phenylethanol, (b) surfactant TritonX-100, (c) lysozyme, and (d) ultrasonication. The red color represents (S)-phenylethyl acetate and (S)-1-phenylethanol, and the blue color represents (R)-phenylethyl acetate and (R)-1-phenylethanol
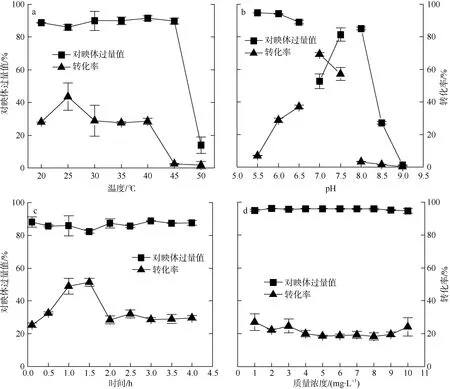
图4 溶菌酶破碎细胞条件的优化 a. 温度; b. pH; c. 破碎时间; d. 溶菌酶质量浓度 Fig. 4 The optimization of the conditions of breaking cells by lysozyme. (a) Effect of broken temperature, (b) effect of broken pH, (c) effect of broken time, and (d) effect of lysozyme concentration
3 讨论
(R)-1-苯乙醇及其衍生物的制备在工业生产中非常重要, 因为光学纯的单体分子是合成许多药物和化学制品的关键中间体。此外, (R)-1-苯乙醇由于具有独特的香气特征也可用于香料及化妆品的制备。传统的化学合成法需要有毒有机溶剂及重金属的参与, 而生物催化剂方法由于其对环境友好及产物光学纯度高等特点, 应用更加广泛(Wang et al, 2016a, b; Gong et al, 2018)。本研究通过破碎Bacillus sp. DL-2 细胞获取得到胞内蛋白酶, 选择及优化破碎方式和反应条件, 使其能有效拆分乙酸苏合香酯, 制备高光学纯的(R)-1-苯乙醇。
微生物破碎方式有很多种, 根据不同种微生物以及破碎目的的不同, 破碎方式也各不相同。表面活性剂可与生物膜蛋白质产生强烈相互作用使之变性或失去功能, 进而达到破碎细胞的目的。李清(2004)在获取胆固醇氧化胞内酶(COD)时比较了表 面活性剂TritonX-100 和Tween80 对COD 胞内酶的提取效果, 结果表明TritonX-100 效果最优。溶菌酶主要通过水解细菌细胞壁的肽聚糖导致细胞壁破裂而使细菌溶解。李琦等(2011)通过超声波破壁法、溶菌酶破壁法、反复冻融法和机械破壁法4 种不同破壁方式对嗜热链球菌SP1.1 进行破壁处理, 确定了溶菌酶方法提取胞内乳糖代谢关键酶效果最优。超声破碎在实验室规模应用较普遍, 处理少量样品时操作简便, 液量损失少; 但大容量装置声能传递和散热均有困难, 不适用于工业大规模生产。
通过优化破碎条件发现, 破碎温度、pH 及破碎时间对破碎效果均有影响, 表面活性剂体积分数和溶菌酶质量浓度对破碎效果的影响较小。经条件优化后的表面活性剂破碎效果优于溶菌酶及超声破碎(图5), 且表面活性剂性价比要远高于溶菌酶, 在贮藏条件要求上也低于溶菌酶; 超声破碎细胞在工业生产上具有技术性限制。

图5 表面活性剂破碎、溶菌酶破碎和超声破碎的Bacillus sp. DL-2 胞内蛋白酶拆分(±)-乙酸苏合香酯的比较 Fig. 5 Comparison of resolution of (±)-1-phenylethyl acetate using the intracellular proteases of Bacillus sp. DL-2 through surfactant, lysozyme and ultrasonication
4 结论
本试验对从西太平洋深海沉积物中筛选出来的Bacillus sp. DL-2 进行了表面活性剂破碎细胞、溶菌酶破碎细胞、超声破碎细胞3 种不同的破碎方法比较, 发现使用非离子型表面活性剂TritonX-100 破碎 细胞后获取的胞内蛋白酶拆分乙酸苏合香酯效果最优, 并确定了最优破碎条件为: 破碎温度35℃, pH 7.0, 破碎时间2h, 表面活性剂体积分数0.5%。在最优破碎条件下, 所制备的(R)-1-苯乙醇的 e.e.值为96%, 转化率为23%。
